Болезнь мойамойа на МРТ, ангиограмме
Обновлено: 23.04.2024
Болезнь моя-моя: клинический и патоморфологический случаи
Авторы: В.В. Пономарев, О.А. Юдина, Клиническая больница № 5, городское патологоанатомическое бюро, г. Минск, Беларусь
Версия для печати
Представлены результаты клинического и патоморфологического случаев диагностики синдрома и болезни моя-моя. Установлено, что данная патология может быть вариантом аутоиммунного гранулематозного гигантоклеточного артериита с преимущественным поражением внутренних сонных артерий и их ветвей. В патологический процесс вовлекаются все внутримозговые артерии с их прогрессирующим тромбозом, что приводит к тотальному некрозу вещества мозга. Обсуждаются вопросы этиопатогенеза, патоморфологии, клинических проявлений, диагностического алгоритма, дифференциальной диагностики, показаний к консервативному и оперативному (реваскуляризационному) лечению.
болезнь моя-моя, патоморфология, диагностика, лечение.
Болезнь моя-моя (БММ) относится к редкому варианту сосудистой патологии головного мозга и является хронической окклюзирующей васкулопатией. Заболевание впервые почти одновременно описано в Японии в 1968 году T. Kudo and A. Nishimoto и S. Takeushi и иногда в литературе называется болезнью Нишимото — Такеуши — Кудо. По данным этих авторов, БММ встречается в Японии с частотой 1 случай на 1 млн населения [9, 11]. К настоящему времени БММ описана во многих странах мира как у детей, так и у взрослых. Женщины болеют чаще (3 : 2 у взрослых и 2,5 : 1 у детей). Отмечено два пика болезни в возрасте 10–20 и 30–40 лет. Своим названием заболевание обязано наличием характерного расширения базальных коллатеральных артерий при МРТ или ангиографии, напоминающих клубящийся дым сигарет, висящий в воздухе (puff of cigarette smoke driffting in the air), что по-японски звучит как mouamoua. Патоморфологические нарушения при БММ проявляются изменением формы и размеров сосудов в виде плотных тяжей с узкими точечными просветами. Микроскопически стеноз сосудов развивается за счет резкого циркулярного утолщения интимы, в основе которой лежат разрастания эластической и коллагеновой ткани или эластофиброз. В коллатералях наблюдаются дезорганизация эластического каркаса, разрывы внутренней эластичной мембраны, некрозы гладкомышечных клеток, отечные изменения, перерастяжение стенок, их истончение и локальная дилатация [1].
Клинически БММ проявляется неспецифическим симптомокомплексом, наблюдающимся при транзиторных ишемических атаках (ТИА) или инфарктах мозга (различаясь в зависимости от пораженного бассейна), различными вариантами внутричерепных кровоизлияний, эпилептическими припадками, непроизвольными движениями и прогрессирующими когнитивными нарушениями [5, 7, 10, 11]. Причина заболевания в настоящее время окончательно не установлена. Предполагается несколько возможных вариантов: генетическая аномалия артерий, которая часто ассоциируется с аномалиями кожи головы и шеи (ангиомы, аплазии); аутоиммунный воспалительный процесс, протекающий по типу неспецифичного артериита и приводящий к повреждению интимы сосуда и последующему тромбозу; рецидивирующий спазм мозговых артерий [6, 7, 12]. В литературе обсуждаются возможная роль раннего атеросклероза, а также мультифакториальный характер заболевания. В лечении БММ предложены различные варианты медикаментозной терапии, а также методы хирургического (реваскуляризационного) вмешательства. Мы наблюдали клинический и патоморфологический случаи диагностики БММ. Приводим эти наблюдения.
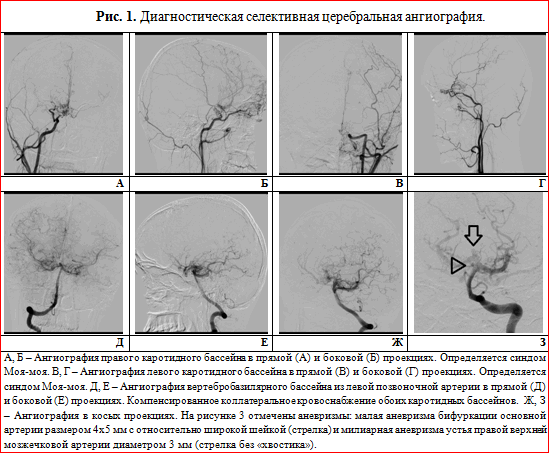
Больная К., 26 лет, домохозяйка, при поступлении в неврологическое отделение жалоб не предъявляла из-за речевых нарушений. Со слов родственников и из анализа медицинской документации выяснено, что в течение последних 3 лет у нее периодически появлялось чувство онемения в правой руке, которому она не придавала значения. Около 6 месяцев спустя постепенно присоединилась неловкость, затем — слабость в правой ноге, стало снижаться зрение. При обследовании по месту жительства при КТ головного мозга обнаружены очаги пониженной плотности в левой теменной области 2,5 см в диаметре, в правой лобной и переднетеменной области — 8 и 9 мм. Лечилась по поводу рассеянного склероза, получала глюкокортикоиды в средней терапевтической дозе с временным улучшением. Спустя месяц остро развилось нарушение речи, лечилась повторно по месту жительства без эффекта, после чего больная была переведена для уточнения диагноза в 5-ю клиническую больницу г. Минска. Из ранее перенесенных заболеваний отмечает редкие простудные заболевания, семейно-наследственный анамнез не отягощен. Замужем, имеет двоих здоровых детей 6 и 4 лет.

Таким образом, у больной с 23-летнего возраста начали повторяться ТИА в каротидных бассейнах, которые закончились формированием множественных инфарктов мозга, что клинически проявилось сенсомоторной афазией и другими нарушениями высших корковых функций (акалькулия, аграфия). Результаты допплерографического исследования и МРТ головного мозга позволили заподозрить сосудистый генез заболевания. МР-ангиография выявила характерный для БММ паттерн — расширение коллатеральных сосудов на основании мозга. Ведущей патогенетической причиной развития болезни в данном случае стал феномен обкрадывания вследствие прогрессирующего тромбоза внутренней сонной артерии и ее ветвей, что подтверждают показатели агрегатограммы. Основной причиной тромбоза артерий, по нашему мнению, стала аутоиммунная коагулопатия, о чем свидетельствовал высокий титр кардиолипиновых антител и антител к волчаночному антикоагулянту. Комплексное лечение (сочетание глюкокортикоидов и непрямых антикоагулянтов) привело к клиническому эффекту.
Больной Ч., 30 лет, безработный, при поступлении в инфекционную больницу г. Минска жалоб не предъявлял в связи с тяжестью состояния. Со слов родственников известно, что больной злоупотреблял алкоголем, жил на даче, где за 3 недели до поступления отмечался эпизод повышения температуры тела до 39–40 °С в течение нескольких дней, за медицинской помощью не обращался. За 4 дня до поступления вновь повысилась температура тела до 40 °С, появились головные боли, стал заговариваться, затем нарушилось сознание. Доставлен скорой помощью. При поступлении общее состояние больного тяжелое, сознание утрачено, контакту недоступен, положение тела вынужденное на боку с запрокинутой головой и подтянутыми к животу ногами. Правильного телосложения, кожные покровы бледные, ЧСС 102 уд./мин, АД 150/90 мм рт.ст., печень выступает на 2 см из-под реберной дуги, температура тела 39 °С. Неврологически: зрачки широкие, слабо реагируют на свет, глазные яблоки плавающие, повернуты вниз и влево. Горизонтальный нистагм, опущен левый угол рта, лицо амимично. Выражена ригидность мышц затылка, симптом Кернига положителен с двух сторон. При обследовании в общеклиническом анализе крови лейкоцитоз — 9,0 х 10 9 /л (в формуле палочки — 33 %, лимфоциты — 11%), СОЭ — 21 мм/ч. Биохимический анализ крови в норме. Спинномозговая жидкость: белок — 0,99 г/л, цитоз — 350 х 10 6 клеток/л (лимфоциты — 88 %, нейтрофилы — 12 %). Исследования крови и ликвора на менингококк, микобактерии туберкулеза, бледную трепонему, ВИЧ, токсоплазмоз, лептоспироз, цитомегаловирус, клещевой энцефалит, лайм-боррелиоз были негативными. МРТ головного мозга проведена только в режиме Т2w из-за беспокойного поведения больного: выявлено расширение желудочковой системы, кортикальных борозд, базальных цистерн. На фоне проводимой терапии по поводу вирусного менингоэнцефалита спустя сутки пришел в сознание, хотя оставался заторможенным, неадекватным, температура снизилась до субфебрильных цифр. Без положительной динамики оставались менингеальные симптомы и пирамидная недостаточность слева, а в спинномозговой жидкости сохранялись белок 0,99 г/л и цитоз 234 х 10 6 клеток/л (лимфоциты — 92 %, нейтрофилы — 12 %). Через 4 суток вновь потерял сознание, присоединились парез взора вверх, глубокий гемипарез слева, гемиплегия справа, патологические стопные симптомы Бабинского, Россолимо, а также клинические и рентгенологические явления правосторонней верхнедолевой пневмонии. Спинномозговая жидкость в этот период: белок — 0,99 г/л, цитоз — 126 х 10 6 клеток/л (лимфоциты — 100 %). Спустя еще несколько суток развилось нарушение дыхания (переведен на искусственную вентиляцию легких), затем — состояние атонической комы, а в ликворе отмечено увеличение белка — 2,48 г/л и цитоза — 932 х 10 6 клеток/л (лимфоциты — 30 %, нейтрофилы — 65 %, макрофаги — 5 %), сахар — 2,2 ммоль/л. Через 21 сутки после поступления наступила остановка сердечной деятельности, и больной умер.
На вскрытии макроскопически в мозге обнаружены тромбированные внутренние сонные артерии и их ветви, позвоночные артерии, сосуды вилизиевого круга и тотальный некроз головного мозга (рис. 2). В легких выявлены полисегментарная пневмония с нагноением и тромбоз сосудов мелкого и среднего калибра. Микроскопически в селезенке, легких, головном и спинном мозге выявлена картина гранулематозного гигантоклеточного васкулита. В головном мозге гранулемы локализовались преимущественно со стороны интимы артерий. При окраске по Цилю — Нильсону микобактерии туберкулеза в гигантских клетках не выявлены. При ШИК-реакции грибы не обнаружены. Мягкая мозговая оболочка склерозирована, с большим количеством новообразованных расширенных коллатеральных артерий, в стенке которых — плазматическое пропитывание, мукоидное набухание, сегментарный фибриноидный некроз с формированием микроаневризм.

Таким образом, у больного на фоне снижения иммунологической реактивности вследствие алкоголизма остро развились явления гранулематозного гигантоклеточного артериита с поражением сосудов головного, спинного мозга, легких, селезенки, что привело к тромбозу внутримозговых сосудов и некрозу головного мозга. Сложность прижизненной диагностики БММ в данном случае была связана с маскированием прогрессирующего тромбоза сосудов воспалительной реакцией оболочек головного мозга.
Несмотря на 35-летнюю историю изучения заболевания, этиологические механизмы развития БММ в большинстве случаев остаются неизвестными. По данным некоторых авторов, заболеванию часто (в 74 % случаев) предшествуют синусит, тонзиллит, отит или другие воспалительные процессы в области головы и шеи, что является косвенным признаком аутоиммунного патогенеза заболевания [4]. Другим фактом в пользу иммунного характера болезни является описание случаев сочетания БММ и неспецифического язвенного колита [7]. В 8–9,4 % случаев заболевание развивается после травмы головы. Роль генетического фактора окончательно не ясна, хотя в литературе описаны семейные случаи болезни в парах (у родных сестер, матери и ребенка, дяди и племянника)[7].
Основным патогенетическим механизмом развития болезни является прогрессирующая окклюзия сосудов, питающих головной мозг, как правило, начинаясь с уровня бифуркации внутренней сонной артерии. В этих условиях церебральный кровоток продолжает осуществляться через систему вертебробазилярных артерий, что проявляется созданием коллатеральной сети сосудов на основании мозга. По мере прогрессирования болезни в процесс может вовлекаться наружная сонная артерия через глазничную артерию, что проявляется формированием в орбите второй сети анастомозов, и это, как правило, прогностически носит неблагоприятный характер [4]. На этих стадиях БММ клинически проявляется симптомами обкрадывания и формированием в мозге ишемических очагов. Окклюзия магистральных артерий и их основных ветвей, использование резервных возможностей кровоснабжения мозга за счет анастомозов и коллатералей приводят к функционированию последних с большой нагрузкой. Это обстоятельство обусловливает функциональную перестройку данных сосудов и создает условия для формирования аневризм, которые чаще локализуются в вертебробазилярном бассейне, берущем на себя основную функцию кровоснабжения мозга, что имело место во втором случае. В этом бассейне артериальное давление часто повышается, хотя системное давление не страдает. Выделяют два наиболее частых варианта расположения аневризм: 1) в типичных местах развилок (тройники), чаще являющихся причиной кровотечений; 2) множественные милиарные по ходу сосудов, чаще спонтанно подвергающихся тромбированию [1, 4]. Разрывы аневризм приводят к развитию различных вариантов внутричерепных кровоизлияний.
Клинические проявления БММ различаются в зависимости от возраста. У детей и подростков (до 15 лет) на ранних стадиях заболевание проявляется неспецифическими симптомами головной боли, иногда типа гемикрании, несистемного головокружения, ухудшения памяти и внимания. По мере прогрессирования стеноза развиваются ТИА, проявляющиеся сенсомоторными, зрительными, речевыми нарушениями, которые часто провоцируются криком, натуживанием (в том числе игрой на музыкальных инструментах), гипервентиляцией. Повторные ТИА часто приводят к инфарктам мозга, чаще локализованным в каротидном бассейне. В клинической картине могут наблюдаться непроизвольные движения (хореоатетоидные гиперкинезы), а также парциальные и вторично-генерализованные эпилептические припадки [1, 4]. Интракраниальные гематомы у детей встречаются исключительно редко. У взрослых клиническая картина БММ проявляется субарахноидальными, субэпендимарными, внутримозговыми или внутрижелудочковыми кровоизлияниями из разорвавшихся аневризм.
Диагностика ранних стадий БММ затруднена в связи с отсутствием характерных для БММ симптомов, однако развитие ТИА или инфарктов мозга в молодом возрасте позволяет заподозрить данное заболевание [8]. Японским исследовательским комитетом по изучению БММ разработаны следующие диагностические критерии заболевания [4]: 1) стеноз или тромбоз внутренней сонной артерии на уровне бифуркации, а также проксимальных отделов передней и средней мозговых артерий; 2) характерное расширение базальных коллатеральных артерий, особенно лентикулостриарных и таламоперфорирующих; 3) двусторонний характер поражения.
Общеклинические и биохимические исследования крови при БММ малоинформативны. В план обследования этой категории больных необходимо обязательно включать иммуноферментные исследования (тесты с волчаночным антикоагулянтом и антикардиолипиновыми антителами). При КТ головного мозга выявляются неспецифические очаги пониженной плотности, локализованные в обоих каротидных бассейнах, атрофический процесс, сообщающаяся гидроцефалия или признаки внутричерепных кровоизлияний.
Диагноз БММ становится достоверным на основании характерной ангиографической картины, состоящей из двустороннего стеноза или окклюзии интракраниального отдела внутренней сонной артерии и развитой коллатеральной сети на основании мозга, напоминающей дым сигарет. Предложена ангиографическая классификация заболевания [4]: 1) выявляется только стеноз терминального супраклиноидного сегмента внутренней сонной артерии; 2) начало развития коллатеральной сети сосудов на основании мозга; 3) присоединение стеноза передней и средней мозговой артерии, развитие коллатеральной сети в области орбиты; 4) прогрессирующее исчезновение коллатеральной сети; 5) сужение задней мозговой артерии с едва видимыми передней и среднемозговой артериями; 6) тотальная облитерация артерий головного мозга, при этом мозговой кровоток поддерживается только через трансдуральные анастомозы.
В настоящее время в диагностике БММ отдается предпочтение МР-ангиографии, являющейся безопасным неинвазивным методом, результаты которого сопоставимы с данными ангиографии [3]. В ряде случаев оправдано проведение позитронно-эмиссионной томографии с использованием ксенона-133, которая позволяет обнаружить снижение мозговой перфузии в лобной и височных областях, изменение лобно-затылочного градиента и гиперемию в затылочных долях [4].
Характерная для БММ ангиографическая картина может развиваться при ряде специфических причин. К ним относятся бактериальная эмболия, туберкулезный менингит, опухоль, нейрофиброматоз, болезнь Дауна [6]. В этих случаях устанавливается диагноз «синдром моя-моя». При исключении этих причин предложен термин «вероятная болезнь моя-моя» [4].
В литературе преобладают пессимистические мнения в отношении результатов консервативного лечения БММ. Считается, что аспирин, глюкокортикостероиды, вазодилататоры, осмотические диуретики, низкомолекулярные декстраны в терапии ишемических проявлений БММ неэффективны [4]. При мозговых геморрагиях эффективны блокаторы кальциевых каналов (верапамил). Более оптимистичной считается разработка различных способов хирургических вмешательств. Ранее были предложены периваскулярная симпатэктомия и передняя шейная симпатическая ганглиоэктомия, которые в настоящее время не выполняются. В наши дни актуальным направлением хирургических методов лечения являются методы реваскуляризации пораженных отделов мозга. К ним относятся создание анастомозов между поверхностной височной и передней артериями, а также среднемозговыми артериями, транспозиции сальника или m.gracillis [5]. Несмотря на эти достижения, прогноз у данных больных пока не вполне благоприятен. В литературе отсутствуют работы, анализирующие результаты катамнеза у больных после консервативного лечения и подвергшихся реконструктивным операциям. Худший прогноз отмечен у больных с ранним началом, повторяющимися ТИА, мозговыми инсультами с остаточным неврологическим дефицитом, а также прогрессирующими когнитивными нарушениями [4].
Таким образом, БММ является редким вариантом аутоиммунного гранулематозного гигантоклеточного артериита с преимущественным поражением внутренних сонных артерий и их ветвей с последующим прогрессирующим тромбозом всех внутримозговых сосудов. Патогенетическая консервативная терапия в ряде случаев приводит к стабилизации процесса.
1. Медведев Ю.А., Мацко Д.Е. Аневризмы и пороки развития сосудов мозга. — СПб.: Изд. РНХЦ им. проф. А.Л. Поленова, 1993. — Т. 1. — С. 74-76.
2. Пономарев В.В. Редкие неврологические синдромы и болезни. — СПб., 2005. — 216 с.
3. Cano A., Roquer J., Herraiz J. et al. Moyamoya syndrome. Diagnosis with angio-MRI // Arch. Neurobiol. — 1992. — Vol. 55. — № 6. — P. 276-279.
4. Cerebrovascular Diseases / Ed. by B.P. Garg, A. Bruno, J. Biller. — Philadelphia: Lippencot-Raven Publichers, 1997. — P. 489-493.
5. Cerebrovascular Diseases in Clinical Practice / Ed. by D. Wiebers, V. Feigin, R. Broun. — 1997. — P. 353-354.
6. Gorrotxategi P., Reguilon M., Gaztanaga R. et al. Moyamoya disease in a child with multiple malformation // Rew. Neurol. — 1995. — Vol. 23. — № 120. — P. 403-405.
7. Ho C., Baraitser M. Neurological complications in one of a sibpair with aplasia cutis congenita // Clin. Dysmorphol. — 1992. — Vol. 1. — № 4. — P. 235-239.
8. Kong K., Chan K., Tan E. et al. Functional outcome in young strokes // Ann. Acad. Med. Singapore. — 1995. — Vol. 24. — № 1. — P. 172-176.
9. Kudo T. Spontaneus occlusion of the cicle of Willis: A disease apparently confined to Japanese // Neurology. — 1968. — Vol. 18. — № 5. — P. 485-496.
10. Magee R., Marshall M., Schaub M., Terrio L. Speech-language patterns in a child with mouamoua disease // Percept. Mot. Skills. — 1994. — Vol. 79. — № 3. — P. 1183-1192.
11. Nishimoto A., Takeushi S. Abnormal cerebrovascular network related to the internal carotid arteries // J. Neurosurg. — 1968. — Vol. 29. — № 3. — P. 225-230.
12. Shanahan P., Hutchinson M., Bohan A. et al. Hemichorea, mouamoua and ulcerative colitis // Mov. Disord. — 2001. — Vol. 16. — № 3. — P. 570-572.
Болезнь мойамойа на МРТ, ангиограмме
Болезнь мойамойа на МРТ, ангиограмме
а) Терминология:
• Прогрессирующее сужение дистальных отделов ВСА/проксимальных отделов сосудов вилизиева круга (ВК) сформированием коллатерального пути кровотока?
о Коллатеральные сосуды → структура по типу «клубка дыма» (мойамойа) при ангиографии
• Болезнь мойамойа (БММ) = первичная (идиопатическая) форма мойамойа:
о Выраженная неравномерность распределения Восток-Запад (БММ более распространена в Японии, Кореи)
• Мойамойа конфигурация коллатералей = встречается при многих причинах
б) Визуализация болезни мойамойа:
• Лучший диагностический критерий: снижение кровотока по сосудам ВК в сочетании с множественными мелкими участками потери сигнала за счет эффекта потока в структуре базальных ганглиев на МРТ
• Лучший инструмент визуализации: постконтрастные Т1-ВИ/МР-ангиография; ЦСА детальной визуализации сосудистых структур
(а) На рисунке коронального среза показано конусообразное сужение дистальных отделов обеих внутренних сонных артерий и выраженное расширение лентикулостриарных артерий, проходящих через базальные ганглии. Такую картину называют «клубы дыма, туман» (мойамойа).
(б) МРТ, Т2-ВИ, корональный срез: у трехлетней девочки с БММ определяется выраженное снижение кровотока в супраклиноидных отделах внутренних сонных артерий Также выявляется острый кортикальный инфаркт в бассейне кровоснабжения правой СМА. (а) МРТ, Т1 -ВИ, аксиальный срез: у этой же пациентки в сильвиевой борозде определяются мелкие практически незаметные участки потери сигнала за счет эффекта потока, соответствующие ветвям СМА.
Острый кортикальный инфаркт обусловливает развитие выраженного отека и набухания извилин. Обратите внимание на мелкие волнистые участки потери сигнала за счет эффекта потока, соответствующие базальным коллатеральным сосудам.
(б) Времяпролетная МР-ангиография, проекция максимальной интенсивности, корональный срез: у этой же пациентки определяется выраженное снижение кровотока в супраклиноидных отделах внутренних сонных артерий и вид базальных коллатеральных сосудов по типу клуба дыма.
в) Патология:
• Болезнь мойамойа:
о Полиморфизм гена RNF213 у 95% представителей популяции Восточной Азии, 79% - спорадические случаи:
- Коррелирует с ранним началом, тяжелой формой БММ
• Вторичный синдром мойамойа (мультифакторный генез):
о В составе синдрома (например, НФ1), воспалительные процессы, протромботические состояния, преждевременное старение, врожденные мезенхимальные дефекты, облучение супраселлярных структур в детском возрасте
г) Клиническая картина болезни мойамойа:
• Бимодальные возрастные пики (первый пик в 5-10 лет, второй - в течение четвертого десятилетия)
• Наиболее частая причина инсульта у азиатских детей
• Проявления:
о Дети: рецидивирующие ТИА; кровоизлияния развиваются редко
о Взрослые: ТИА, инфаркты, кровоизлияние (20%), мигрени
Болезнь мойамойа на МРТ, ангиограмме
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
Сибирский государственный медицинский университет, Томск
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(12): 143‑147
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
Болезнь моямоя - это хроническое прогрессирующее заболевание сосудов головного мозга, для которого характерно постепенное сужение просвета внутримозговых сосудов до полной их окклюзии. В течение болезни происходит формирование сети коллатеральных сосудов на основании мозга, что на ангиограммах создает впечатление легкой дымки. Заболевание встречается крайне редко, особенно за пределами Японии. В статье представлен клинический случай болезни моямоя у пациента 27 лет в городе Томске. Заболевание проявлялось острым нарушением мозгового кровообращения по ишемическому типу в бассейне правой средней мозговой артерии. Диагноз выставлен в соответствии с критериями заболевания на основании данных магнитно-резонансной ангиографии.
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
Сибирский государственный медицинский университет, Томск
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
Региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГАУЗ "Томская областная клиническая больница", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
ГБОУ ВПО "Сибирский государственный медицинский университет", Томск
Болезнь моямоя - это редкое хроническое прогрессирующее заболевание сосудов головного мозга. Впервые оно было описано японскими исследователями K. Takeuchi и K. Shimizu в 1957 г., а термин «болезнь моямоя» был введен в клиническую практику в 1967 г. [1, 2]. Название болезни произошло от японского mouamoua - «клубок дыма», что соответствует специфической ангиографической картине. В основе патологического процесса при болезни моямоя лежит постепенная окклюзия сосудов головного мозга преимущественно во внутричерепных сегментах внутренних сонных, начальных отделах передних мозговых и средних мозговых артерий (СМА), которая характеризуется медленным и прогрессирующим течением. На основании головного мозга формируется сеть коллатеральных сосудов, которая на ангиограммах создает впечатление легкой дымки [3].
Морфологические нарушения при болезни моямоя, по данным Ю.А. Медведева и Д.Е. Мацко [4], проявляются изменением формы и размеров сосудов в виде плотных тяжей с узкими точечными просветами. Микроскопически стеноз сосудов развивается за счет резкого циркулярного утолщения интимы, в основе которого лежат разрастания эластической и коллагеновой ткани. В коллатералях наблюдаются разрывы внутренней эластичной мембраны, некрозы гладкомышечных клеток, отечные изменения, перерастяжение стенок, их истончение и локальная дилатация с образованием аневризм. Патологический процесс начинается с уровня бифуркации внутренней сонной артерии (ВСА). В этих условиях церебральный кровоток продолжает осуществляться через систему вертебрально-базилярных артерий, что проявляется созданием коллатеральной сети сосудов на основании мозга. По мере прогрессирования болезни в патологический процесс вовлекается и наружная сонная артерия с формированием анастомоза через глазничную артерию, что приводит к образованию в орбите второй сети анастомозов [5].
Этиология болезни моямоя остается до конца не выясненной. Некоторые авторы предполагают участие воспалительных и аутоиммунных факторов в возникновении патологического процесса. Это связано с тем, что в 74% случаев заболеванию предшествуют синуситы, тонзиллиты, отиты или другие воспалительные процессы в области головы и шеи [6]. Кроме того, были описаны случаи сочетания болезни моямоя и неспецифического язвенного колита. У 8,0-9,4% больных заболевание развивалось после травмы головы. Роль генетического фактора окончательно не выяснена, вместе с тем в литературе описаны семейные случаи болезни у близких родственников (у родных сестер, матери и ребенка, дяди и племянника) [7].
Заболевание может возникать в любом возрасте. Первый пик начала болезни приходится на возраст около 4 лет, в котором обычно наблюдаются ишемические поражения. Второй пик - около 34 лет, большинство поражений связано с церебральной геморрагией [8, 9]. Клинические проявления болезни моямоя разнообразны и зависят от степени поражения магистральных сосудов, локализации, объема и характера очага поражения головного мозга.
Чаще всего заболевание проявляется в возрасте от 10 до 30 лет. У детей возникают нарушения кровообращения головного мозга в виде ишемических инсультов или транзиторных ишемических атак. Наиболее частыми симптомами являются преходящая слабость в конечностях и нарушение речи после гипервентиляции вследствие физических упражнений, надувания шариков, при употреблении горячей пищи или продолжительном плаче. Родители отмечали у детей с болезнью моямоя эпизоды чувствительных, зрительных нарушений и головную боль [10]. В старшей возрастной группе чаще развивались различные формы кровоизлияний (субарахноидальные, паренхиматозные, внутрижелудочковые) [8]. У взрослых пациентов наблюдались ишемические инсульты и деменция.
Японским исследовательским комитетом [6] по изучению болезни моямоя были разработаны диагностические критерии заболевания: 1) стеноз или тромбоз ВСА на уровне бифуркации, а также проксимальных отделов передней и СМА; 2) характерное расширение базальных коллатеральных артерий, особенно лентикулостриарных и таламоперфорирующих; 3) двусторонний характер поражения.
Статистические исследования распространенности болезни моямоя позволяют отнести ее в группу редких болезней: в Японии она встречается с частотой 1 случай на 1 млн населения. Это заболевание считалось специфичным для японцев. Однако после работы A. Subirana и М. Subirana в 1962 г. [цит. по 3], появились публикации о случаях во всем мире 14. За пределами Японии болезнь чаще встречается в Китае - 519 случаев (по сборным данным в литературе) и Корее - 289 наблюдений [16]. В России имеются единичные описания болезни моямоя. Учитывая редкость заболевания, считаем возможным представить собственное клиническое наблюдение.
Лечение болезни моямоя осуществляется с помощью медикаментозных и хирургических методов. Аспирин, антикоагулянты, глюкокортикостероиды, вазодилататоры, осмотические диуретики, низкомолекулярные декстраны, антиконвульсанты используются в симптоматической терапии ишемических и геморрагических повреждений, судорожных приступов, непроизвольных движений или внутричерепной гипертензии [16,17].
Хирургическое лечение болезни моямоя является наиболее эффективным методом для улучшения мозговой гемодинамики. Оперативное лечение приводит к увеличению мозгового кровотока до нормального уровня с исчезновением патологической коллатеральной циркуляции [10]. На сегодняшний день на основании опыта японских хирургов разработаны методы наложения прямого и непрямого анастомоза и их комбинации. Метод прямого анастомоза осуществляется с церебральными артериями - экстраинтракраниальный анастомоз. Операции непрямой реваскуляризации основаны на возможности образования коллатералей между артериями мозга и мягких тканей при их контакте (энцефало-дуро-артериосинангиоз, оментоцеребропексия, церебромиопексия). При наложении фрезевых отверстий над зоной ишемии, рассечении твердой мозговой оболочки, наложении на мозг височной мышцы анастомозы с ветвями поверхностной височной артерии, средней оболочечной артерией, глубокой височной артерией возникают в течение 6 мес. Эти операции применяют при невозможности наложения прямого анастомоза, чаще всего вследствие малого калибра сшиваемых сосудов. В Японии хирургическое лечение преобладает над медикаментозным [16, 17]. В клиниках на 1994 г. прямые анастомозы выполнены в 21% случаев, непрямые анастомозы - в 36%, комбинация прямых и непрямых анастомозов - в 20%, медикаментозное лечение - в 23% [16]. После хирургического лечения происходит улучшение функции мозга и исчезновение клинических симптомов. Этот вид хирургического лечения болезни моямоя рассматривается как основной метод профилактики ишемических или геморрагических проявлений заболевания у детей и взрослых.
Пациент Е., 27 лет, поступил в региональный сосудистый центр для лечения острых нарушений мозгового кровообращения ОГБУЗ «Томская областная клиническая больница» с жалобами на затруднение речи. Из анамнеза было выяснено, что у пациента в юности наблюдалась нестабильность артериального давления, в 21 год он перенес стертую форму клещевого энцефалита. Образование среднее, женат, имеет здорового ребенка. Заболел внезапно, когда появились головная боль, затруднение речи, асимметрия лица. Артериальное давление на момент поступления в стационар по скорой помощи было 100/60 мм рт.ст. При поступлении: состояние средней степени тяжести. В неврологическом статусе: сознание сохранено. Речь смазана по типу дизартрии. Объем движений глазных яблок полный, зрачки равные, фотореакции живые. Носогубная складка сглажена справа, язык отклоняется вправо. Голос звучный, поперхивания нет, глоточный рефлекс живой. Движения в конечностях в полном объеме, сила 5 баллов по всем мышечным группам, тонус не изменен. Рефлексы с конечностей живые, симметричные, патологических знаков нет. Чувствительность интактна, координаторных нарушений нет, менингеальных знаков нет.
Результаты МРТ головного мозга: признаки подострого ишемического инсульта в бассейнах центральных и периферических ветвей СМА справа, а также в бассейне передней ворсинчатой артерии справа. Формирующаяся постишемическая киста в бассейне СМА слева на фоне перенесенного лакунарного ишемического инсульта. Смешанная гидроцефалия (рис. 1, 2). Рисунок 1. МРТ головного мозга пациента Е., 27 лет, с болезнью моямоя в режиме T1 (а) и T2 (б). Рисунок 2. МРТ головного мозга пациента Е., 27 лет, с болезнью моямоя в режиме DWI (а) и FLAIR (б).
Окончательная постановка диагноза была основана на результатах МР-ангиографии, на которой был выявлен стеноз магистральных сосудов виллизиева круга, преимущественно справа, с формированием коллатералей, за счет которых обеспечивалось неадекватное кровоснабжение головного мозга, и, как следствие, развитие множественных ишемических повреждений разной степени давности: лакунарные инфаркты правого и левого полушарий, постишемическая киста в бассейне СМА слева (рис. 3, 4). Рисунок 3. МР-ангиография пациента Е., 27 лет. Диагноз болезни моямоя считается достоверным на основании характерной ангиографической картины, состоящей из двустороннего стеноза или окклюзии интракраниального отдела внутренней сонной артерии и развитой коллатеральной сети на основании мозга, напоминающей дым сигарет. Рисунок 4. МР-ангиография пациента Е., 27 лет. Детализация внутренних сонных артерий при проведении внутривенного контрастирования: правая внутренняя сонная артерия (а) и левая внутренняя сонная артерия (б).
Учитывая молодой возраст пациента, был проведен дифференциальный диагноз с аневризмой и артериовенозной мальформацией, кавернозной ангиомой СМА справа, нейрофиброматозом Реклингхаузена, церебральным васкулитом вследствие системного заболевания соединительной ткани. Так как артериовенозная мальформация представляет собой клубок варикозно-расширенных сосудов разного диаметра, в котором происходит шунтирование крови без так называемой капиллярной фазы, то ее наличие может осложниться ишемическим или геморрагическим инсультом. Во время проведения МР-ангиографии, артериовенозная мальформация и аневризмы сосудов головного мозга не были обнаружены. Системное заболевание соединительной ткани (системная красная волчанка (СКВ), склеродермия и т.п.) было исключено, исходя из предварительных анализов (отсутствие повышения скорости оседания эритроцитов, биохимический анализ крови не выявил поражение почек, на рентгенографии органов грудной клетки изменений не найдено) и отсутствия анамнестических данных о фотосенсибилизации. В литературе встречаются упоминания о сходстве между болезнью моямоя и волчаночным церебральным васкулитом в описании картины при МР-ангиографии. Однако в отличие от болезни моямоя подобные патоморфологические изменения наблюдаются в артериях мелкого и среднего диаметра (артерии 3-4-5-го порядка, капилляры). При длительном или злокачественном течении СКВ возможно и поражение более крупных сосудов, развитие коллатералей, инсультов. Врожденное заболевание нейрофиброматоз Реклингхаузена поражает периферические нервы, в том числе черепно-мозговые, корешки, ганглии. Учитывая, что при поступлении были жалобы на асимметрию лица и нарушение артикуляции речи (поражение n. facialis, бульбарной группы черепно-мозговых нервов), то такое предположение вполне правомочно. Однако внезапное развитие симптоматики, а также отсутствие характерного поражения кожи, подкожной клетчатки, пигментации, возраст пациента (болезнь проявляется в первые 3 года жизни) не позволили принять этот диагноз.
По данным МР-ангиографии, у пациента имелись множественные лакунарные инфаркты правого и левого полушарий различной степени давности, что указывает на постепенное развитие (стеноз участков ВСА, средней и передней мозговой артерий справа) и прогрессирование заболевания во времени.
Пациенту был выставлен диагноз «болезнь моямоя, ишемический инсульт в бассейне СМА справа, дизартрия, центральный парез мышц лица и языка слева». Диагноз был установлен на основании данных МР-ангиографии (стеноз ВСА, передних и средних мозговых артерий, передних коммуникантных артерий с обеих сторон с развитием массивного коллатерального кровотока из вертебрально-базилярной системы через глубокую и поверхностную венозные сети) и клинической картины заболевания - острое развитие очаговой неврологической симптоматики в бассейне СМА в виде дизартрии и поражения мышц лица и языка по центральному типу слева. Данные ангиографии соответствовали всем критериям диагностики болезни моямоя.
Больному была проведена сосудистая и метаболическая терапия. При выписке состояние больного значительно улучшилось, уменьшилась асимметрия лица, полностью восстановилась артикуляция речи. Были даны рекомендации для проведения планового специализированного высокотехнологичного хирургического лечения в НИИ патологии кровообращения им. Е.Н. Мешалкина (Новосибирск).
Болезнь мойамойа на МРТ, ангиограмме
- Главная /
- Редкие болезни /
- Энциклопедия заболеваний /
- Болезнь мойа-мойа
Болезнь мойа-мойа – редкое сосудистое заболевание, название которого введено в клиническую практику в 1967-1968 гг., когда почти одновременно оно было описано Т. Kudo, A. Nishimoto и S. Takeushi (поэтому иногда в литературе называется болезнью Нишимото—Такеуши—Кудо) [14].
В переводе с японского языка мойа мойа означает: “нечто, подобное сигаретному дыму, плывущему в воздухе” [7].
Немного статистики:
• В Японии самый высокий уровень заболеваемости в мире – 4–5 случаев на 100 000 населения (отличаются данные: по некоторым: 1 на млн)
• Эта болезнь также встречается в Китае и Южной Корее.
• Отсутствуют данные о частоте этого заболевания в Америке и России, поэтому публикации в России об этом заболевании посвящены единичным наблюдениям.
• Некоторые авторы указывают на целесообразность принципиального разделения понятий “болезнь мойа-мойа” и “синдром мойа-мойа”.
• Среди пациентов превалируют женщины, соотношение женщин и мужчин составляет 3:2 у взрослых и 2,5:1 у детей [14].
• Болезнь мойа-мойа по манифестации симптомов имеет два возрастных пика:
o первый пик приходится на детей в возрасте 10 лет (10-20 лет [14]),
o второй – на взрослых 30–40 лет.
• В Японии отмечено преобладание пациентов младшей возрастной группы [7, 10].
Этиология
Этиология и патогенез болезни мойа-мойа (БММ) остаются до настоящего времени неясными. В большей части случаев заболевание носит спорадический характер, но встречаются и семейные случаи.
Наследование
У 7–12% пациентов доказан генетически детерминированный характер заболевания [10]. На сегодняшний день выявлена значительная сопряженность между встречаемостью аллелей главного комплекса гистосовместимости HLA-B51-DR4 и болезнью мойа-мойа [4]. Однако исследования, проведенные с использованием МР-ангиографии, выявили высокую частоту семейных асимптомных случаев болезни мойа-мойа [6]. О наследственном характере заболевания свидетельствует также его ассоциация с синдромом Дауна, нейрофиброматозом I типа, гомоцистинурией и другими пороками развития. Системный характер болезни подтверждается наличием подобных изменений в сосудах почек, легких, сердца и поджелудочной железы у детей. В дополнение к генетическим факторам важную роль играют внешние факторы. Например, радиация или инфекционные болезни могут спровоцировать начало заболевания.
По данным некоторых авторов, заболеванию часто (74%) предшествуют синусит, тонзиллит, отит и другие воспалительные процессы в области головы и шеи, что является косвенным признаком аутоиммунного патогенеза заболевания [15]. Другим фактом в пользу иммунного характера болезни является описание случаев сочетания БММ и неспецифического язвенного колита [16]. В 8—9,4% случаев заболевание развивается после травмы головы.
Таким образом, наиболее вероятна многофакторная этиология болезни мойа-мойа [10].
Патогенез болезни мойя-мойя
Основным патогенетическим механизмом развития БММ является прогрессирующая окклюзия сосудов, питающих головной мозг, как правило, начиная с уровня бифуркации внутренней сонной артерии. В этих условиях церебральный кровоток продолжает осуществляться через систему вертебробазилярных артерий, что проявляется созданием коллатеральной сети сосудов на основании мозга. По мере прогрессирования болезни в процесс может вовлекаться наружная сонная артерия через глазничную артерию. Это проявляется формированием в орбите второй сети анастомозов, что прогностически неблагоприятно [15]. На этих стадиях болезни клинически проявляется симптомами «обкрадывания» и формированием в мозге ишемических очагов.
Окклюзия магистральных артерий и их основных ветвей, использование резервных возможностей кровоснабжения мозга за счет анастомозов и коллатералей приводит к тому, что последние функционируют с большой нагрузкой. Это обстоятельство вызывает функциональную перестройку данных сосудов и создает условия для формирования аневризм, которые чаще локализуются в вертебробазилярном бассейне, берущем на себя основную функцию кровоснабжения мозга. В этом бассейне артериальное давление часто значительно повышено, хотя системное давление не страдает. Выделяют два наиболее распространенных варианта расположения аневризм:
1) в типичных местах развилок артерий, чаще являющихся причиной кровотечений;
2) множественные «милиарные» по ходу сосудов, чаще спонтанно подвергающихся тромбированию [15, 17].
Разрывы аневризм приводят к развитию различных вариантов внутричерепных кровоизлияний.
Нейровизуализация
Образное сравнение с «дымкой» или «туманом» в полной мере соответствует ангиографической картине заболевания.
Феномен представляет собой накопление контрастного вещества сетью новообразованных коллатеральных сосудов, объединяющих корковые анастомозы диаметром 1,5–2 мм ветвей каротидного сифона, задней соединительной артерии, артерии Гюбнера, артерий сосудистого сплетения. Заболевание известно также под названием “болезнь Нисимото–Такеути–Кудо” [2, 3, 7].
Основные патологические изменения представлены стенозом обеих внутренних сонных артерий в интракраниальном отделе, характеризующимся пролиферацией интимы без признаков атеросклероза или воспаления [2, 5, 11]. В ответ на постепенно прогрессирующий стеноз в условиях повышенного кровотока компенсаторно развивается сеть коллатеральных сосудов с широким просветом. Эта двусторонняя сосудистая сеть широких и извитых сосудов, наполняющихся от внутренних сонных артерий, на ангиограммах напоминает клубы сигаретного дыма, повисшие в воздухе, и является специфическим ангиографическим паттерном болезни мойа-мойа [7]. Неравномерное расширение просвета, истончение, отсутствие мышечного слоя является результатом длительной перегрузки артерий небольшого калибра. Эти артерии могут быть источником внутримозговых и вентрикулярных кровоизлияний [2, 3, 7].
Клиническая картина
Клинические симптомы различаются в зависимости от возраста.
У детей ранними проявлениями заболевания являются транзиторные ишемические атаки и ишемические инсульты. Другие клинические проявления включают эпилептические припадки, обычно возникающие во время плача, головные боли и головокружения. При осмотре выявляются стигмы дизэмбриогенеза и кожные ангиомы. Интракраниальные гематомы у детей встречаются исключительно редко.
У взрослых болезнь проявляется как ишемическими, так и геморрагическими инсультами (субарахноидальными, внутримозговыми, вентрикулярными кровоизлияниями), однако частота внутримозговых кровоизлияний значительно выше, чем у детей. Ишемические нарушения мозгового кровообращения обычно развиваются первыми как проявление нарастающего стеноза обеих внутренних сонных артерий и нередко повторяются [7, 11]. Следствием многоочагового поражения головного мозга является развитие когнитивных и психических нарушений. По мере развития аномальной коллатеральной сети тонкостенных сосудов с неполноценной стенкой формируются условия для возникновения внутримозговых кровоизлияний [2, 3]. В клинической картине могут наблюдаться непроизвольные движения (хореоатетоидные гиперкинезы), а также парциальные и вторично-генерализованные эпилептические припадки [15, 17]. У взрослых клиническая картина БММ также может проявлятся субарахноидальными, субэпендимарными, внутримозговыми или внутрижелудочковыми кровоизлияниями.
Диагностика
Диагностика ранних стадий БММ затруднена в связи с отсутствием характерных для нее симптомов, однако развитие ТИА или инфарктов мозга в молодом возрасте позволяет заподозрить данное заболевание [13].
Общеклинические и биохимические анализы крови при БММ мало информативны.
В план обследования этой категории больных необходимо обязательно включать иммуноферментные исследования (тесты с волчаночным антикоагулянтом и антикардиолипиновыми антителами) [14].
При КТ головного мозга выявляются неспецифические очаги пониженной плотности, локализованные в обоих каротидных бассейнах, атрофический процесс, сообщающаяся гидроцефалия или признаки внутричерепных кровоизлияний.
Диагноз БММ становится достоверным на основании характерной ангиографической картины, состоящей из двустороннего стеноза или окклюзии интракраниального отдела внутренней сонной артерии и развитой коллатеральной сети на основании мозга, напоминающей «дым сигарет» (puff of smoke) [14].
Основной метод диагностики болезни мойа-мойа -нейровизуализационный. Ее основные признаки включают множественные очаговые изменения и церебральную атрофию с расширением желудочков и подпаутинного пространства полушарий большого мозга. Инфаркты мозга располагаются, как правило, в зонах смежного кровообращения передней, средней и задней мозговых артерий или в глубоких отделах мозга, также относящихся к зоне смежного кровообращения – между длинными и короткими радиальными артериями [1, 6]. Однако критерием диагноза являются данные ангиографического исследования. В типичных случаях выявляются двусторонние стенозы внутренних сонных артерий, распространяющиеся на проксимальные отделы передних и средних мозговых артерий с развитием выраженной коллатеральной артериальной сети – “сосудов мойа-мойа” [7].
Предложена ангиографическая классификация заболевания, согласно которой выделяются шесть стадий процесса [15]:
Стадия 1 – стеноз внутренней сонной артерии в интракраниальном отделе (выявляется только стеноз терминального супраклиноидного), обычно возникающий билатерально.
Стадия 2 – внутренняя сонная артерия сужена, другие церебральные артерии расширены, начинает формироваться аномальная сосудистая сеть дистальнее бифуркации внутренней сонной артерии.
Стадия 3 – присоединение стеноза передней и средней мозговых артерий, отсутствие контрастирования А1-сегмента передней и М1-сегмента средней мозговых артерий, отчетливо выявляется коллатеральная сеть сосудистых анастомозов.
Стадия 4 – окклюзия внутренней сонной артерии, распространяющаяся на заднюю соединительную артерию. Передняя и средняя мозговые артерии выполняются через сеть анастомозов. Аномальные сосуды формируют коллатерали.
Стадия 5 – окклюзия внутренней сонной артерии, передней и средней мозговых артерий. Начинают формироваться коллатерали из бассейнов экстракраниальных артерий.
Стадия 6 – тотальная облитерация артерий головного мозга. Кровоснабжение мозга осуществляется за счет наружных сонных и позвоночных артерий [7].
Согласно критериям, разработанным в Японии и принятым в мире, в диагностике болезни мойа-мойа основную роль играет церебральная ангиография.
Комплекс ангиографических признаков включает:
1) стеноз внутренней сонной артерии в области бифуркации;
2) стеноз проксимальных отделов передней и средней мозговых артерий;
3) развитие коллатеральной артериальной сети;
4) двусторонность изменений;
5) ассоциации с другими системными болезнями (аутоиммунные заболевания, синдром Дауна, болезнь Реклингхаузена и др.) [7, 8].
Формулировка диагноза:
Характерная для БММ ангиографическая картина может развиваться на фоне специфических причин: к ним относится бактериальная эмболия, туберкулезный менингит, опухоль головного мозга, нейрофиброматоз, болезнь Дауна [12]. В таких случаях устанавливается диагноз «синдром моя-моя». При исключении этих причин предложен термин «вероятная болезнь моя-моя» [15].
Лечение
В литературе преобладает пессимистическое мнение в отношении результатов консервативного лечения БММ. Считается, что аспирин, глюкокортикостероиды, вазодилататоры, осмотические диуретики, низкомолекулярные декстраны в терапии ишемических проявлений БММ неэффективны [15]. При мозговых геморрагиях полезно назначение блокаторов кальциевых каналов и верапамила.
В настоящее время отдается предпочтение хирургическим методам лечения болезни мойа-мойа. Ранее были предложены периваскулярная симпатэктомия и передняя шейная симпатическая ганглиоэктомия, которые в настоящее время не выполняются [14]. Описаны положительные результаты операции реваскуляризации – наложения анастомоза между поверхностной височной артерией и средней мозговой артерией [3].
Хирургические операции делятся на создание прямых, непрямых и комбинированных анастомозов. К первым относят операции наложения экстраинтракраниального анастомоза. Операции непрямой реваскуляризации основаны на возможности образования коллатералей между артериями мозга и мягких тканей головы [1, 9].
Общепринятыми считаются следующие показания к операции:
1) ишемические инсульты;
2) геморрагические проявления;
3) выраженная головная боль и эпилептические припадки;
4) критическое снижение церебрального кровотока (КТ/МРТ перфузия) без клинических проявлений (преимущественно у детей) [8].
Прогноз
Несмотря на некоторые определенные достижения, прогноз у данных больных пока не вполне благоприятный. В литературе отсутствуют работы, анализирующие результаты катамнеза у больных после консервативного лечения и подвергшихся реконструктивным операциям. Худший прогноз отмечен у больных с ранним началом, повторяющимися ТИА, мозговыми инсультами с остаточным неврологическим дефицитом, а также прогрессирующими когнитивными нарушениями [14,15].
Список литературы:
1. Панунцев В.С., Христофорова М.И. // Нейрохирургия. 2001. № 3. С. 12.
2. Чайковская Р.П. и др. // Патологическая анатомия хирургических заболеваний нервной системы. М., 1991. С. 251.
3. Чеботарева Н.М., Пуканов В.С. // Журн. невропатол. и психиатр. 1973. № 12. С. 1794.
4. Aoyagi M. et al. // Stroke. 1995. V. 26. Р. 415.
5. Masuda'J. et al. // Stroke. 1993. V. 24. P. 1960.
6. Rolak L.A., Rokey R. // Child Neurol. 1986. V. 1. P. 67.
7. Suzuki J., Takaku A. // Arch. Neurol. 1969. V. 20. P. 288.
8. Suzuki J. et al. // Child Brain. 1975. V. 1. P. 193.
9. Ueld K. et al. // Mayo Clin. Proc. 1994. V. 69. P. 749.
10. Wakai K. et al. // Clin. Neurol. Neurosurg. 1997. V. 99. Suppl. 2. P. 1.
11. Yamashita M. et al. // Stroke. 1984. V. 15. P. 264
12. Gorrotxategi P., Reguilon M., Gaztanaga R. et al. Moya-moya disease in a child with multiple malformation // Rew. Neurol. — 1995. — Vol. 23. — N. 120. — P. 403–405
13. Kong K., Chan K., Tan E. et al. Functional outcome in young strokes // Ann. Acad. Med. Singapore. — 1995. — Vol. 24. — N 1. — P. 172–176
14. В.В. Пономарев: Редкие неврологические синдромы и болезни 2005 г стр. 73-81
15. Cerebrovascular Diseases / Ed. B. P. Garg., A. Bruno, J. Biller By Lippincott-Raven Publishers. — Philadelphia, 1997. — P. 489–493
16. Ho C., Baraitser M. Neurological complications in one of a sibpair with aplasia cutis congenita // Clin. Dysmorphol. — 1992. — Vol. 1. — N 4. — P. 235–239;
17. Медведев Ю.А., Мацко Д.Е. Аневризмы и пороки развития сосудов мозга- СПб: Изд – во РНХЦ им. Проф. А. Л. Поленова 1993 — Т. 1. — с. 74–76
Наблюдение пациентов осуществляется мультидисциплинарной командой, в зависимости от проявлений заболевания.
• Пирцхелава Саломе Зурабовна, Невролог, Заведующий отделением неврологии "Медицинского лучевого центра" г. Краснодар
Читайте также:
