Фибромышечная дисплазия
Обновлено: 05.05.2024
Эта акция - для наших друзей в "Одноклассниках", "ВКонтакте", "Яндекс.Дзене", YouTube и Telegram! Если вы являетесь другом или подписчиком стр.
Для жителей районов Савеловский, Беговой, Аэропорт, Хорошевский
В этом месяце жителям районов Савеловский, Беговой, Аэропорт, Хорошевский» предоставляется скидка 5% на ВСЕ мед.
Второе мнение
Не уверены в правильности поставленного вам диагноза? Прочь сомнения! Приходите в «МедикСити» и бесплатно проконсультируйтесь у н.
Пора к флебологу!
Болезни вен и сосудов могут проявляться такими симптомами, на которые обычный человек и внимания не обращает. Однако тяжесть в ногах, "гудение.
Кунижев Анатолий Султанович
Главный врач, врач-хирург, пластический хирург, директор по развитию многопрофильной клиники
Кандидат медицинских наук
Поповцев Максим Александрович
Врач-хирург, флеболог, онколог, специалист по УЗ-диагностике и лазерному лечению заболеваний вен
Научный сотрудник кафедры хирургии МПФ Первого Московского государственного медицинского университета
Сычев Андрей Владимирович
Врач-хирург, флеболог, онколог, специалист по УЗ-диагностике
Врач высшей категории, кандидат медицинских наук, доцент кафедры хирургии Центральной государственной медицинской академии УД Президента РФ, член Российского общества хирургов, Российской ассоциации флебологов, Национальной коллегии флебологов
Мы в Telegram и "Одноклассниках"
Стеноз почечных артерий – вызванная наследственными или приобретенными изменениями артериальных сосудов патология, представляющая собой сужение одной или обеих почечных артерий либо их ветвей. Это состояние становится причиной нарушения процесса перфузии – прохождения жидкости – через почки, ведёт к упадку кровоснабжения почек, к повышенному артериальному давлению. Кроме того, стеноз почечных артерий может привести к развитию сердечной недостаточности, почечной недостаточности, к инсульту и инфаркту миокарда.
Причины развития стеноза почечных артерий
Среди заболеваний, провоцирующих стеноз почечных артерий, наиболее часто встречаются атеросклероз и фибромускулярная дисплазия.
Атеросклеротический, то есть сопровождающийся образованием в артериях бляшек из отсоединившихся от стенок кусочков ткани, стеноз почечных артерий обычно является спутником сахарного диабета, ишемической болезни сердца либо артериальной гипертензии.
При этом бляшки в большинстве случаев концентрируются в районе аорты, что чревато самыми тяжёлыми последствиями для больного.
Фибромускулярная дисплазия как причина стеноза нередко носит характер наследственной патологии и гораздо чаще встречается у женщин в возрасте 30-45 лет. Это заболевание представляет собой утолщение покрывающего ткань стенок артерий фиброза или мышечной ткани.
В некоторых случаях стеноз почечных артерий могут спровоцировать артериальные аневризмы, артериовенозные шунты, неспецифический аортоартериит, тромбозы или эмболии почечных артерий, сдавливание почечных сосудов инородным телом или опухолью, нефроптоз.
Признаки заболевания
Стеноз почечных артерий может протекать без каких-либо явных клинических признаков, поэтому важно наблюдаться у опытных квалифицированных врачей, обладающих широким спектром современных диагностических возможностей, и регулярно проходить обследование.
Симптомы, при которых можно заподозрить развитие стеноза почечных артерий – это прежде всего:
- высокое артериальное давление;
- почечная недостаточность;
- уменьшение одной или обеих почек.
Согласно статистическим данным, при подозрении на стеноз почечных артерий устойчивое повышенное давление (гипертония) у лиц младше 50 лет свидетельствует, как правило, о фибромускулярной дисплазии, а у больных старше 50 – об атеросклерозе почечных артерий.
Если стеноз почечных артерий ведёт к почечной недостаточности, то это может проявляться тупыми болями в области поясницы, а в запущенной стадии – почечным инфарктом.
При сочетании стеноза почечных артерий с атеросклерозом в других сосудах или, например, неспецифическим аортоартериитом может развиться ишемия (недостаточность кровоснабжения) желудочно-кишечного тракта, верхних и нижних конечностей.
Фибромускулярная дисплазия
Фибромускулярная дисплазия (ФМД) – патология артерий неатеросклеротического и невоспалительного происхождения, в результате которой наступает перерождение эластической ткани сосудов с одновременным разрастанием волокнистой и гладкомышечной тканей. Это приводит к сужению просвета сосудов и обескровливанию органов. Наиболее часто в процесс вовлекаются почечные артерии, реже – аорта, ветви аортальной дуги, артерии конечностей, включая стопы и кисти. Данное заболевание считается системным несмотря на то, что в каждом конкретном случае на первый план выходит поражение определенной локализации.
Эпидемиология
Фибромускулярная дисплазия более характерна для молодых и женщин. ФМД описывается как причина стеноза почечной артерии от 30% до 60% детей с РВГ.
Патология
Описано 5 гистологических типов фибромускулярной (фиброзно-мышечной) дисплазии (иногда их сводят к 3):
- Фиброплазия медии
- составляет 75-80% всех ФМД. При ней поражается tunica media, участки её фиброзных изменений, перемежаются с участками эктазии просвета. Это даёт классическую ангиографическую картину «нити бус», при которой определяется чередование участков сужений и вздутий, которые (основной признак!) больше диаметра артерии (т.е. между стенозами - мелкие аневризмы).
- встречается реже, менее 10% всех типов ФМД. Выраженные депозиты коллагена определяются в наружном листке tunica media. Отмечается неравномерной утолщение стенки артерии и при этом в пораженной зоне за участками стеноза нет участков аневризматического расширения (т.е. диаметр «бусины» не больше диаметра неизменённой артерии). При этом типе, помимо развития вазоренальной гипертензии отмечают повышенный риск развития диссекций, эмболий, окклюзий и прочих васкулярных катостроф, поэтому так важно его выявление. А узкая стенозирующая перегородка, мембрана может не визуализироваться даже (!) при селективной ЦСА и в этом случае (при отсутствии ангиографической картины стеноза при наличии его достоверных ДГ признаков) методом «золотого стандарта» становится внутрисосудистый ультразвук.
- менее 10% всех типов ФМД. Депозиты коллагена определяются вокруг внутреннего листка (tunica intima) стенки артерии. Она выглядит концентрически утолщенной с локальным достаточно равномерным сужением (или сужениями) просвета на ангиограмме (без формирования картины бус или чёток).
- Редкий вариант 1-2%. Истинная гиперплазия гладкомышечных волокон, без локального фиброза стенок. На ангиограммах выглядит также как интимальная гиперплазия.
- Редкий вариант, 1% ФМД. Изменения в адвентиции, причем депозиты коллагена (фиброз) отмечаются и периваскулярной жировой клетчатке, признаки воспалительных изменений в стенке и в примыкающей периваскулярной клетчатке.
Диагностика
Поскольку ФМД приводит к характерным изменениям сосудистой стенки. При ангиографии, как правило, описывается в виде «нитки с бисером». Средний или дистальный сегмент артерии обычно имеют утолщенную стенку. При цветном допплеровском ультразвуковом исследовании выявляется высокая скорость турбулентного потока. Цветное картирование потока помогает выявить неровные края пораженного сегмента почечных артерий. Скорость потока остается нормальной в проксимальном сегменте, который остается нетронутым.
Артериальная гипертензия у ребенка с фибромускулярной дисплазией, первично трактовавшейся как неспецифический аортоартериит. Клиническое наблюдение
Неспецифический аортоартериит (НАА) — заболевание из группы системных васкулитов, характеризующееся поражением аорты и отходящих от нее сосудов, с развитием деструктивно-продуктивного сегментарного аортита и субаортального панартериита, который приводит к
Неспецифический аортоартериит (НАА) — заболевание из группы системных васкулитов, характеризующееся поражением аорты и отходящих от нее сосудов, с развитием деструктивно-продуктивного сегментарного аортита и субаортального панартериита, который приводит к деформации сосудистого просвета и, следовательно, к ишемическим расстройствам. Заболевание встречается как в молодом, так и в детском возрасте, начинается чаще в возрасте от 10 до 20 лет, преимущественно болеют лица женского пола [1–3].
Относительная редкость данной патологии становится одним из факторов, определяющим сложность и несвоевременность ее диагностики, неадекватность лечения, что приводит к ранней инвалидизации и высокому риску развития жизнеугрожающих осложнений у больных с НАА [4].
НАА клинически характеризуется сменой двух стадий (фаз) течения: острой и хронической. В острой фазе преобладает общевоспалительный синдром: возможно повышение температуры тела, сосудистые боли, значительное увеличение СОЭ, гипохромная анемия и увеличение уровня С-реактивного белка. Характер клинических проявлений зависит от преимущественной локализации сегментарного поражения артериального русла [5]. В случае поражения почечных артерий развивается артериальная гипертензия ренального генеза и тогда наибольшие трудности представляет собой дифференциальная диагностика НАА с врожденными сосудистыми дисплазиями.
Представляем клиническое наблюдение фибромускулярной дисплазии, диагностированной у девочки 8 лет, которая первично трактовалась как НАА.
Клиническое наблюдение. Пациентка К., 8 лет поступила в стационар с жалобами на подъемы артериального давления (АД) максимально до 220 и 90 мм рт. ст., периодические головные боли.
Из анамнеза жизни известно, что девочка от второй беременности, протекавшей на фоне анемии и угрозы прерывания в первом триместре, первых срочных родов. Родилась с массой 2800 г, длиной 50 см, находилась на грудном вскармливании до 5 месяцев. В психомоторном развитии не отставала. Вакцинирована по календарю. Реакция Манту отрицательная. После двух лет 5–6 раз в год болела ОРВИ, дважды ангиной, перенесла ветряную оспу. Наследственность отягощена по линии отца: дед умер от разрыва аневризмы артерии головного мозга. Аллергологический анамнез: аллергическая сыпь на антибиотики цефалоспоринового ряда.
Анамнез заболевания: впервые в возрасте 5 лет у девочки отмечался эпизод болей в правом тазобедренном суставе. По месту жительства диагноз трактовался как ювенильный хронический артрит. При обследовании воспалительной активности не выявлено. Получала нестероидные противовоспалительные препараты (НПВП), внутривенное введение глюкокортикоидов, антибактериальную терапию, на фоне чего болевой синдром купировался. В дальнейшем артралгии не беспокоили. В 6,5 лет, при случайном измерении АД (в семье появился тонометр), выявлено его повышение до 190 и 100 мм рт. ст. Ребенок обследован в хирургическом стационаре, где по данным ультразвуковой допплерографии (УЗДГ) и рентгеноконтрастной компьютерной томографии выявлен стеноз левой почечной артерии до 70%. Несмотря на проводимую гипотензивную терапию (Норваск, Карведилол, Арифон), цифры АД сохранялись высокими. Через год при ангиографическом исследовании выявлен сегментарный стеноз проксимального отдела левой почечной и верхней брыжеечной артерий — заподозрен НАА. По результатам обследования в ревматологическом стационаре диагноз НАА был подтвержден, но базисная терапия не назначена в связи с отсутствием лабораторной активности. В качестве лечения девочка получала только гипотензивные средства без значимого эффекта. При повторной УЗДГ через 6 месяцев выявлены признаки гемодинамически значимого стеноза аорты в области отхождения от нее висцеральных ветвей (начальных отделов чревного ствола, верхней брыжеечной и обеих почечных артерий — не менее 70%). С учетом сохраняющейся и торпидной к стандартной терапии артериальной гипертензии, девочке была выполнена попытка баллонной ангиопластики левой почечной артерии без эффекта: сохранялись высокие цифры АД: днем до 200 и 100 мм рт. ст., ночью — до 170 и 90 мм рт. ст. Направлена в УДКБ Первого МГМУ им. И. М. Сеченова для верификации диагноза и лечения.
При поступлении состояние средней тяжести за счет артериальной гипертензии. Кожные покровы и видимые слизистые обычной окраски, девочка астенического телосложения. При аускультации в легких дыхание везикулярное, хрипов нет. Сердечные тоны звучные, акцент II тона над легочной артерией, выслушивается систолический сосудистый шум над областью обеих сонных артерий, подключичных, позвоночных артерий, в проекции брюшной аорты, почечных и бедренных артерий. Пульс симметричный, достаточного наполнения. Частота сердечных сокращений (ЧСС) — 96 ударов в минуту; АД на левой руке 180/90 мм рт. ст., на правой — 170/70 мм рт. ст. При лабораторном обследовании воспалительной активности, характерной для острой фазы НАА (повышение уровня СОЭ, С-реактивного белка, гиперфибриногенемия), не выявлено. По данным суточного мониторирования АД — признаки артериальной гипертензии систолического характера.
При инструментальном исследовании отмечаются допплерографические признаки стенозирования верхней брыжеечной артерии, чревного ствола и левой почечной артерии — то есть картина стеноза практически всех висцеральных ветвей брюшной аорты. Наряду с этим, при УЗДГ ветвей дуги аорты и магистральных артерий нижних конечностей, отмечаются признаки изменения кровотока со стенотическим спектром, утолщение комплекса «интима-медиа», нечеткость контуров, нарушение дифференцировки слоев стенок обеих сонных артерий, стеноза правой общей бедренной артерии (ОБА) до 50%, стеноза левой ОБА до 30%. Таким образом, у ребенка подтвержден распространенный характер поражения аорты и ее ветвей.
Учитывая несоответствие между обширным характером поражения аорты и ее ветвей и полным отсутствием воспалительной активности на протяжении двух лет наблюдения, в целях дифференциальной диагностики девочке была выполнена позитронно-эмиссионная томография (ПЭТ) всего тела, по результатам которой убедительных данных за наличие активного воспалительного процесса в стенках магистральных артерий не получено.
На основании жалоб, сведений наследственного анамнеза, клинико-лабораторных и инструментальных данных установлен диагноз: фибромускулярная дисплазия с поражением аорты, почечных артерий, верхней брыжеечной артерии и чревного ствола; вазоренальная артериальная гипертензия. При консультации в РНЦХ им. Б. В. Петровского диагноз подтвержден и рекомендовано хирургическое лечение. 04.08.2010 года девочке было выполнено двустороннее аутовенозное аортопочечное протезирование, получено гистологическое подтверждение диагноза фибромускулярной дисплазии. Состояние ребенка после операции удовлетворительное, жалоб нет, АД 100 и 60 мм рт. ст., головные боли не беспокоят, в настоящее время в гипотензивной терапии не нуждается.
Фибромускулярная (фиброзно-мышечная) дисплазия — это гиперпластическое заболевание, обусловленное мутацией в гене коллагена III типа (135580, 2q31, COL3A1) и характеризующееся поражением артерий среднего и мелкого калибров. Наиболее часто поражаются почечные артерии, реже сонные артерии, однако возможно вовлечение в патологический процесс и сосудов конечностей (подвздошной и/или подключичной артерии), а также коронарных артерий. Как и НАА, данная патология возникает преимущественно у детей и молодых женщин. Впервые заболевание было описано в 1955 году Л. Маккормиком.
При фибромускулярной дисплазии может поражаться любой из слоев артериальной стенки — интима, медиа и адвентиция. Сужение просвета сосуда происходит в результате концентрического или эксцентрического отложения коллагена в просвете сосуда. При этом внутренняя эластическая мембрана утончается или фрагментируется. Патологический процесс проявляется мультифокальным, тубулярным или монофокальным стенозом артерий малого и среднего калибра. Более редкий тип поражения — в области интимы и периартериально — чаще встречается у детей, и при этом заболевание носит быстропрогрессирующее течение.
Клинические проявления и осложнения зависят от локализации поражения: перемежающаяся хромота, артериальная гипертензия (вазоренального характера как проявление стеноза почечных артерий), нарушение мозгового кровообращения, развитие расслаивающей аневризмы аорты, инфаркт миокарда.
Правильный диагноз заболевания удается поставить с помощью ангиографического исследования, магнитно-резонансной ангиографии — выявляют характерные изменения в виде «нитки жемчуга», «четок»: утолщенные участки артерии с гиперплазией чередуются с менее измененными участками.
У 85% больных отмечают поражение медии в дистальном отделе основной почечной артерии и ее ветвей, что и обуславливает наиболее частое клиническое проявление фибромускулярной дисплазии — вазоренальную артериальную гипертензию, торпидную к стандартным схемам гипотензивной терапии. По данным различных авторов, фибромускулярная дисплазия почечных артерий занимает второе место (10–15%) в структуре реноваскулярной артериальной гипертензии (после ишемической болезни почек вследствие атеросклероза) [6].
В представленном клиническом наблюдении имеется классическая симптоматика поражения почечных артерий при фибромускулярной дисплазии в виде развития неконтролируемой стандартными схемами гипотензивной терапии вазоренальной артериальной гипертензии, первично трактовавшейся как НАА. Отсутствие общевоспалительного синдрома в дебюте заболевания и признаков лабораторной активности на протяжении всего периода наблюдения не позволило подтвердить диагноз НАА. В качестве нового дифференциально-диагностического метода исследования была использована позитронно-эмиссионная томография, позволившая объективно оценить отсутствие активного воспалительного процесса в стенках магистральных артерий. Попытка баллонной ангиопластики не привела к ожидаемому эффекту. Только проведенное двустороннее аутовенозное аортопочечное протезирование позволило купировать вазоренальную артериальную гипертензию.
Литература
- Покровский А. В., Зотиков А. Е., Юдин В. И., Грязнов О. Г., Рахматуллаев Р. Р. Диагностика и лечение неспецифического аортоартериита. Руководство для практикующих врачей. М.: «ИРИСЪ», 2003.
- Лыскина Г. А. Системные васкулиты. Детская ревматология. Руководство для врачей. Под ред. А. А. Баранова, Л. К. Баженовой. М.: Медицина, 2002; 221–270.
- Al Abrawi et al. Takayasu arteritis in children // Pediatr Rheumatol. 2008, Sep 28; 6: 7.
- Johnston S. L., Lock R. G., Gompels M. M. Takayasu arteritis: a review // J Clin Pathol. 2002, July; 55 (7): 481–486.
- Успенская Е. В. Клиника, лечение и исходы неспецифического аортоартериита у детей // Диссертация на соискание ученой степени канд. мед. наук. М., 2001.
- Сиренко Ю. Н. Симптоматические формы артериальной гипертензии // Украинский медицинский журнал. Киев, 2008, 3 (65), с. 48–79.
Г. А. Лыскина, доктор медицинских наук, профессор
Ю. О. Костина
Е. В. Успенская, кандидат медицинских наук
Г. М. Рабиева
А. Б. Степаненко, доктор медицинских наукПервый МГМСУ им. И. М. Сеченова, Москва
Эндоваскулярное лечение стеноза почечной артерии, вызванного фибромускулярной дисплазией. Клинический случай
Введение. Фибромускулярная дисплазия (ФМД) — идиопатическое, не атеросклеротическое, не воспалительное поражение артерий. Тщательное изучение данной патологии показало, что при ФМД поражаются все сосудистые русла, наиболее чаще встречаемые — это почечные артерии и экстракраниальные отделы сонных и позвоночных артерий. Клиническая картина ФМД определяется локализацией пораженного сосудистого бассейна и тяжестью стеноза. На сегодняшний день ФМД является весьма редким заболеванием. Его распространенность примерно 4 на 1000 человек. Своевременная диагностика затруднена, и диагностический поиск может занять много времени. Согласно последним рекомендациям Европейской ассоциации кардиологов пациентам с ФМД показана баллонная ангиопластика почечной артерии, при хорошем ангиографическом результате (отсутствие диссекции, кровоток TIMI 3) без имплантации стента в почечную артерию. Успех лечения зависит от ранней диагностики заболевания.
Материалы и методы. В статье представлен клинический случай успешного эндоваскулярного лечения стеноза почечной артерии, вызванного фибромускулярной дисплазией, при помощи баллонной ангиопластики без стентирования.
Результаты и обсуждение. Длительная диагностика заболевания может привести к ухудшению качества жизни и неблагоприятным исходам, таким как плохо контролируемая гипертензия и ее последствия, ТИА, инсульт, диссекция или разрыв аневризмы. Следует отметить, что ФМД может быть обнаружена случайно, когда визуализация выполняется по другим причинам или когда слышен систолический шум при аускультации артерий у бессимптомного пациента без классических факторов риска атеросклероза. По современным рекомендациям пациентам со стенозом почечных артерий при ФМД для лечения гипертонии показано эндоваскулярное лечение, которое дает хороший эффект в улучшении качества жизни.
Заключение. Эндоваскулярная баллонная ангиопластика почечной артерии может успешно применяться у пациентов с фибромускулярной дисплазией.
Ключевые слова
Для цитирования:
For citation:
Фибромускулярная дисплазия (ФМД) представляет собой идиопатическое, не атеросклеротическое, не воспалительное поражение артерий, выявляемое преимущественно у молодых женщин [1]. До 2014 года считалось, что при ФМД чаще поражаются почечные артерии [2]. Однако более глубокое изучение данной патологии показало, что при ФМД поражаются все сосудистые русла. Наиболее распространенная локализация — почечные артерии и экстракраниальные отделы сонных и позвоночных артерий [3]. Более 1600 пациентов, включенных в реестр США, имеют различные варианты поражения артерий, такие как фокальный и мультифокальный стенозы, аневризмы, диссекции и извитости артерий [4, 5]. Клиническая картина ФМД зависит от локализации пораженных сосудистых бассейнов и тяжести стеноза, чаще всего это двухстороннее поражение артерий парных органов. Артериальная гипертензия является наиболее распространенным проявлением ФМД почечной артерии, однако ФМД может протекать и бессимптомно. На сегодняшний день ФМД является весьма редким заболеванием, его распространенность составляет 4 на 1000 человек [6], поэтому своевременная диагностика затруднена и на диагностический поиск может быть затрачено много времени.
Клинический случай
У 20-летней пациентки без отягощенного семейного анамнеза с 2007 г. развилась артериальная гипертония (АГ) с максимальным АД до 170/100 мм рт. ст., молодая женщина адаптирована к 120/80 мм рт. ст. Учитывая молодой возраст и недостаточную эффективность консервативной терапии, проводилось обследование для выявления причин данной патологии. Эндокринный генез АГ исключен. В связи с дизурическими явлениями в 2010 г. обследована урологом, выставлен диагноз хронического цистита, по урографии описан нефроптоз и умеренная пиелоэктазия справа, конкрементов не выявлено. При проведении МСКТ в 2012 г. описана деформация с сужением в средней трети левой почечной артерии. По сцинтиграфии от 2012 г. описана вторично сморщенная левая почка со снижением секреторно-экскреторной функции, функция правой почки сохранена, кист и конкрементов не выявлено; при урографии — выделительная функция почек не нарушена. Была выполнена ангиография почечных артерий, при которой отмечалось сужение левой почечной артерии до 90 %, типичное для фиброзно-мышечной дисплазии, сужение правой почечной артерии до 50 %. В 2013 г., спустя 6 лет после возникновения симптоматики, пациентке была выполнена операция — протезирование левой почечной артерии синтетическим протезом Vascutek 7 мм. При контрольном УЗИ — без особенностей, по результатам гистологического исследования — фиброзно-мышечная дисплазия. Консультирована генетиком: выявлены умеренные признаки дисплазии соединительной ткани, недостаточные для диагностики наследственных форм, наиболее вероятно, порок является изолированным. После выписки принимала кардиомагнил, бетаксолол 10 мг/сут с последующей отменой препаратов на фоне нормализации АД и отсутствия симптоматики.
При симптоматическом течении ФМД со снижением почечной функции, которые наблюдались у данной пациентки, показано хирургическое лечение. В 2013 году, на момент операции у данной пациентки, было признано, что хирургическое вмешательство (протезирование почечной артерии) имеет большую эффективность, чем стентирование при стенозе почечной артерии фибромускулярного генеза.
В 2015 г. у пациентки вновь стало отмечаться повышение цифр АД (в течение 2 лет отсутствовала симптоматика), был возобновлен прием бетаксолола — без эффекта. По УЗИ с УЗДГ от 06.2016: левая почка уменьшена 91x42 мм, извитость правой почечной артерии, аневризматическое расширение в дистальном отделе протезированной левой почечной артерии с формированием постстенотического типа кровотока на уровне паренхиматозных сосудов. При КТ-ангиографии от 06.2016: признаки нефросклероза слева, без существенной динамики по сравнению с 2013 г., стеноз 70 % в области дистального анастомоза шунта левой почечной артерии, правая почечная артерии без гемодинамически значимых стенозов, патологии аорты не описано, рекомендовано динамическое наблюдение.
В апреле 2017 г. поступила в НМИЦ ПМ с жалобами на бессимптомные повышения АД до 170/100 мм рт. ст. На момент осмотра АД 170/85 мм рт. ст. на правом плече, 160/80 мм рт. ст. — на левом, ЧСС 70/мин. Выслушивается локальный «дующий» систолический шум в области проекции брюшного отдела аорты, в эпигастрии. В точках аускультации почечных, сонных, бедренных артерий патологические шумы не выслушиваются. Выполнено дуплексное сканирование почечных артерий: в правой почечной артерии выявлен гемодинамически значимый стеноз (более 65 %) на уровне дистального сегмента (на расстоянии 0,7 см от «ворот» почки). Кровоток при цветовом доплеровском картировании турбулентный, значимое увеличение линейной скорости кровотока — 271 см/с. Левая почечная артерия: состояние после протезирования синтетическим протезом. На уровне дистального сегмента протеза кровоток при цветовом доплеровском картировании турбулентный, выраженное увеличение линейной скорости кровотока — 370 см/с.
Пациентке была выполнена МСКТ-ангиография брюшной аорты и висцеральных артерий с введением контрастного вещества, по результатам которого выявлен гемодинамически незначимый стеноз шунтированной артерии в проксимальном отделе, значимый стеноз в дистальном отделе левой почечной артерии — по дистальному краю шунта (рис. 1).
![]()
Рисунок 1. А. Стеноз левой почечной артерии сразу после шунта. Б. Диаметр почечной артерии в месте стенозирования (3,6 мм) и после стеноза (5,3 мм)
Picture 1. A. Left renal artery stenosis, immediately after angioplasty. Б. Diameter of the renal artery at the stenosis site (3.6 mm) and after stenosis (5.3 mm)
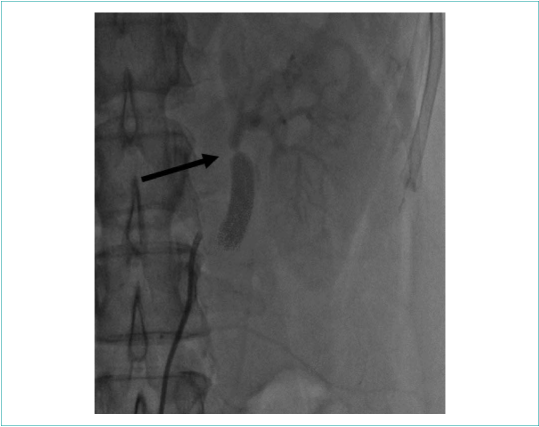
Выполнена ангиография почечных артерий, по результатам которой выявлен 95 % стеноз в дистальном отделе левой почечной артерии сразу за дистальным анастомозом шунта, в правой почечной артерии гемодинамически значимых стенозов не выявлено (рис. 2, 3).
![]()
Рисунок 2. Ангиография левой почечной артерии (95 % стеноз указан стрелкой)
Picture 2. Left renal artery angiography (95% stenosis indicated by arrow)
![]()
Рисунок 3. Ангиография правой почечной артерии (без гемодинамически значимых стенозов)
Picture 3. Right renal artery angiography (no hemodynamically significant stenosis)
В отличие от атеросклеротического стенозирования почечных артерий, у пациентов с ФМД после реваскуляризации довольно распространено повторное повышение АД (на 30-50 % от нормотензии) [7]. Согласно рекомендациям Европейской ассоциации кардиологов 2017 года, при наличии гипертонии у пациентов с ФМД рекомендована баллонная ангиопластика со стентированием почечной артерии, уровень доказательности IIb [8]. В настоящее время нет доказательной базы, свидетельствующей о превосходстве стентирования почечной артерии над баллонной ангиопластикой у пациентов с ФМД. Напротив, встречались случаи переломов стента в почечной артерии у данных пациентов с нефроптозом [9, 10]. Выбором первой линии считается баллонная ангиопластика почечной артерии. Стентирование при данной патологии выполнять не рекомендуется, если только это не требуется ввиду наличия периоперационных осложнений, таких как диссекция артерии [9, 11].
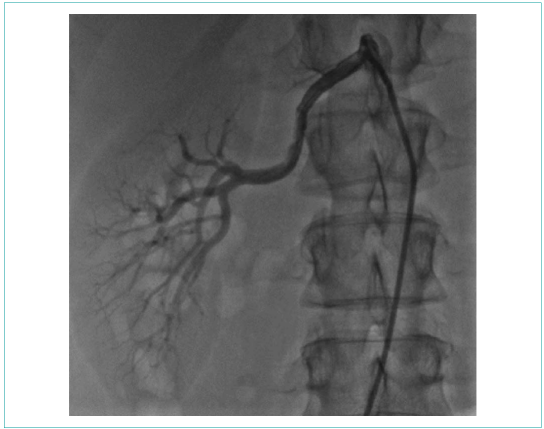
Пациентке была выполнена баллонная ангиопластика левой почечной артерии. Под местной анестезией через правый феморальный доступ был установлен интродьюсер 6F. Катетер-гид установлен в устье шунта к левой почечной артерии. Проводник проведен в дистальный отдел левой почечной артерии. Выполнена дилатация стенозированного участка некомплаенсным баллонным катетером 3,75x21 мм инфляцией 20 атм, затем выполнена дилатация баллонным катетером 5,0x20 мм инфляцией 12 атм (рис. 4). На контрольной съемке хороший ангиографический результат, признаков диссекции нет, остаточного стеноза нет (рис. 5).
![]()
Рисунок 4. Баллонная вазодилатация левой почечной артерии
Picture 4. Left renal artery, balloon vasodilation
![]()
Рисунок 5. Селективная ангиография левой почечной артерии после баллонной ангиопластики (стеноз устранен)
Picture 5. Selective angiography of left renal artery after balloon angioplasty (stenosis eliminated)
Во время проведения операции пациентка находилась в сознании, активно жалоб не предъявляла, гемодинамические показатели оставались стабильными. Больная была выписана на 2-е сутки послеоперационного периода. АД на фоне продолженной гипотензивной терапии стабилизировалось на уровне 120-130/75-85 мм рт. ст.
Результаты
У пациентов с ФМД через 1 месяц после реваскуляриза- ции обычно отмечается нормализация АД, при которой возможно сокращение или полное прекращение гипотензивной терапии [11, 12]. Поскольку рестенозы в основном происходят в первые 6 месяцев 15, рекомендуется выполнять дуплексное сканирование почечных артерий в течение этого периода времени. Если в течение 6 месяцев нет отрицательной динамики, то в дальнейшем пациенты наблюдаются так же, как при ФМД без стенозирования почечных артерий [11].
При контрольном амбулаторном обследовании через 7 месяцев после баллонной вазодилатации левой почечной артерии АД на уровне (100-110)/ (70-80) мм рт. ст. без приема гипотензивной терапии. Выполнено контрольное дуплексное сканирование почечных артерий. Правая почечная артерия без гемодинамически значимых стенозов, в левой — протез визуализирован на всем протяжении, полностью проходим, диаметр около 8 мм. За протезом на локальном участке выявлен турбулентный кровоток с умеренным увеличением линейной скорости кровотока — 178 см/с, гемодинамически значимые стенозы не выявлены.
ФМД — редко встречаемое заболевание, ранняя диагностика которого затруднена. По данным литературы, в среднем время от ранних симптомов заболевания до постановки диагноза составляет от 4 до 9 лет. Это, вероятно, связано с несколькими факторами: так как это редкое заболевание, оно не участвует в дифференциальной диагностике, а также влияет неспецифичность симптоматики. Длительная диагностика может привести к ухудшению качества жизни и неблагоприятным исходам, таким как плохо контролируемая гипертензия и ее последствия, ТИА, инсульт, диссекция или разрыв аневризмы. Следует также отметить, что ФМД может быть обнаружена случайно, когда визуализация выполняется по другим причинам или когда слышен систолический шум при аускультации артерий у бессимптомного пациента без классических факторов риска атеросклероза.
К сожалению, нет лекарства от ФМД. Это хроническое заболевание, но его можно лечить и лечить с хорошими результатами с помощью индивидуального подхода к лечению. План лечения для каждого пациента основывается на тяжести клинической картины, локализации пораженного сосудистого бассейна, а также на наличии аневризм и диссекций. Чрескожная транслюминальная ангиопластика почечных артерий, также называемая баллонная ангиопластика, является наиболее распространенной процедурой, выполняемой у пациентов с ФМД. Цель ангиопластики почечной артерии состоит в том, чтобы уменьшить степень стенозирования почечной артерии и тем самым снизить АД, которое было устойчиво к медикаментозной терапии. Современные рекомендации по диагностике и лечению заболеваний периферических артерий от 2017 года также указывают на то, что пациентам со стенозом почечных артерий при ФМД для лечения гипертонии показано эндоваскулярное лечение, при котором достигается хороший эффект в улучшении качества жизни.
Заключение
Данный пример является иллюстрацией того, что правильный выбор тактики лечения позволяет добиться максимально эффективных результатов. Эндоваскулярный метод лечения имеет большую практическую значимость при лечении ФМД. Также успех лечения ФМД зависит от ранней диагностики заболевания. Оптимизация методов диагностики и лечения позволит достигнуть наиболее оптимальных результатов.
Информация о конфликте интересов.
Конфликт интересов отсутствует.Информированное согласие.
Информированное согласие пациента на публикацию своих данных получено.Информация о спонсорстве.
Данная работа не финансировалась.Список литературы
1. O’Connor S.C., Poria N., Gornik H.L. Fibromuscular dysplasia: an update for the headache clinician. Headache. 2015;55(5):748–55. DOI: 10.1111/head.12560
2. Slovut D.P., Olin J.W. Fibromuscular dysplasia. N Engl J Med. 2004;350:1862–71. DOI: 10.1056/NEJMra032393
4. Bolen M.A., Brinza E., Renapurkar R.D., Kim E.S.H., Gornik H.L. Screening CT angiography of the aorta, visceral branch vessels, and pelvic arteries in fibromuscular dysplasia. JACC Cardiovasc Imaging. 2017;10(5):554–61. DOI: 10.1016/j.jcmg.2016.04.010
5. Olin J.W., Froehlich J., Gu X., Bacharach J.M., Eagle K., Gray B.H., et al. The United States Registry for Fibromuscular Dysplasia: results in the first 447 patients. Circulation. 2012;125(25):3182–90. DOI: 10.1161/ CIRCULATIONAHA.112.091223
6. Plouin P.F., Baguet J.P., Thony F., Ormezzano O., Azarine A., Silhol F., et al. High prevalence of multiple arterial bed lesions in patients with fibromuscular dysplasia: The ARCADIA Registry (Assessment of Renal and Cervical Artery Dysplasia). Hypertension. 2017;70(3):652–58. DOI: 10.1161/HYPERTENSIONAHA.117.09539
8. Aboyans V., Ricco J.B., Bartelink M. E. L. Björck M., Brodmann M., Cohnert T., et al. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J. 2018;39(9):763–816. DOI: 10.1093/eurheartj/ehx095
9. Raju M.G., Bajzer C.T., Clair D.G., Kim E.S., Gornik H.L. Renal artery stent fracture in patients with fibromuscular dysplasia: a cautionary tale. Circ Cardiovasc Interv. 2013;6(3):e30-1. DOI: 10.1161/CIRCINTERVENTIONS.113.000193
10. Wang L.C. Scott D.J., Clemens M.S., Hislop S.J., Arthurs Z.M. Mechanism of stent failure in a patient with fibromuscular dysplasia following renal artery stenting. Ann Vasc Surg. 2015;29(1):123.e19–21. DOI: 10.1016/j.avsg.2014.08.002
11. Persu A., Giavarini A., Touzé E., Januszewicz A., Sapoval M., Azizi M., et al. European consensus on the diagnosis and management of fibromuscular dysplasia. J Hypertens. 2014;32(7):1367–78. DOI: 10.1097/ HJH.0000000000000213
12. Hendricks N.J., Matsumoto A.H., Angle J.F., Baheti A., Sabri S.S., Park A.W., et al. Is fibromuscular dysplasia underdiagnosed? A comparison of the prevalence of FMD seen in CORAL trial participants versus a single institution population of renal donor candidates. Vasc Med. 2014;19(5):363–7. DOI: 10.1177/1358863X14544715
13. Iwashima Y., Fukuda T., Yoshihara F., Kusunoki H., Kishida M., Hayashi S., et al. Incidence and risk factors for restenosis, and its impact on blood pressure control after percutaneous transluminal renal angioplasty in hypertensive patients with renal artery stenosis. J Hypertens. 2016;34(7):1407–15. DOI: 10.1097/HJH.0000000000000928
14. Prasad M., Tweet M.S., Hayes S.N., Leng S., Liang J.J., Eleid M.F., et al. Prevalence of extracoronary vascular abnormalities and fibromuscular dysplasia in patients with spontaneous coronary artery dissection. Am J Cardiol. 2015;115(12):1672–7. DOI: 10.1016/j. amjcard.2015.03.011
15. Sethi S.S., Lau J.F., Godbold J., Gustavson S., Olin J.W. The S curve: a novel morphological finding in the internal carotid artery in patients with fibromuscular dysplasia. Vasc Med. 2014;19(5):356–62. DOI: 10.1177/1358863X14547122
Об авторах
Национальный медицинский исследовательский центр профилактической медицины
Россия
Чигидинова Дарья Сергеевна — врач отделения рентгенэндоваскулярных методов диагностики и леченияНациональный медицинский исследовательский центр профилактической медицины
Россия
Гаврилова Наталья Евгеньевна — д.м.н., главный врач, старший научный сотрудникНациональный медицинский исследовательский центр профилактической медицины
Россия
Руденко Борис Александрович — д.м.н., руководитель отдела инновационных методов профилактики, диагностики и лечения сердечно-сосудистых и других хронических неинфекционных заболеванийНациональный медицинский исследовательский центр профилактической медицины
Россия
Шаноян Артем Сергеевич — к.м.н., зав. отделением рентген-хирургических методов диагностики и леченияНациональный медицинский исследовательский центр профилактической медицины
Россия
Мазаев Владимир Павлович — д.м.н., руководитель лаборатории рентгенэндоваскулярных методов диагностики и леченияНациональный медицинский исследовательский центр профилактической медицины
Россия
Шукуров Фирдавс Баходурович — врач отделения рентгенэндоваскулярных методов диагностики и леченияПубликации в СМИ
Фиброзно-мышечная (фибромускулярная) дисплазия (135580, 2q31, ген коллагена COL3A1,
Â) — гиперпластическое заболевание, поражающее артерии среднего и мелкого калибров. Обычно поражаются почечные и сонные артерии, однако возможно вовлечение сосудов конечностей (подвздошной и/или подключичной артерии), коронарных артерий. Возникает преимущественно у молодых женщин. Патоморфология. Гистологически выделяют: дисплазию внутренней оболочки, дисплазию средней оболочки и дисплазию околоадвентициальных тканей. Дисплазия средней оболочки артерии — наиболее частый тип дисплазии; он характеризуется гиперплазией в сочетании с фиброзом эластической мембраны или без него.Клинические проявления зависят от локализации поражения • Наиболее часто отмечают артериальную гипертензию (вазоренального характера как проявление стенозирования почечных артерий), нарушения мозгового кровообращения (обычно хроническое, однако возможен и инсульт) • Возможно развитие расслаивающей аневризмы аорты, ИМ • Вовлечение артерий конечностей характеризуются типичными симптомами стенозирования, включая перемежающуюся хромоту (см. Атеросклероз периферических артерий).
Диагностика. Ангиография — выявляют характерные изменения в виде «нитки жемчуга»: утолщённые участки артерии с гиперплазией чередуются с менее изменёнными участками. Лечение — хирургическое.
МКБ-10 • I77.3 Мышечная и соединительнотканная дисплазия артерий
Код вставки на сайт
Дисплазия фиброзно-мышечная
Фиброзно-мышечная (фибромускулярная) дисплазия (135580, 2q31, ген коллагена COL3A1,
Â) — гиперпластическое заболевание, поражающее артерии среднего и мелкого калибров. Обычно поражаются почечные и сонные артерии, однако возможно вовлечение сосудов конечностей (подвздошной и/или подключичной артерии), коронарных артерий. Возникает преимущественно у молодых женщин. Патоморфология. Гистологически выделяют: дисплазию внутренней оболочки, дисплазию средней оболочки и дисплазию околоадвентициальных тканей. Дисплазия средней оболочки артерии — наиболее частый тип дисплазии; он характеризуется гиперплазией в сочетании с фиброзом эластической мембраны или без него.Клинические проявления зависят от локализации поражения • Наиболее часто отмечают артериальную гипертензию (вазоренального характера как проявление стенозирования почечных артерий), нарушения мозгового кровообращения (обычно хроническое, однако возможен и инсульт) • Возможно развитие расслаивающей аневризмы аорты, ИМ • Вовлечение артерий конечностей характеризуются типичными симптомами стенозирования, включая перемежающуюся хромоту (см. Атеросклероз периферических артерий).
Диагностика. Ангиография — выявляют характерные изменения в виде «нитки жемчуга»: утолщённые участки артерии с гиперплазией чередуются с менее изменёнными участками. Лечение — хирургическое.
МКБ-10 • I77.3 Мышечная и соединительнотканная дисплазия артерий
Читайте также: