МРТ при гипертрофической нейропатии
Обновлено: 23.04.2024
Интерес ортопедов и ревматологов к МРТ суставов продолжает растёт год от года, что обусловлено огромным потенциалом данной методики, все увеличивающимся благодаря ее быстрому развитию в последние годы.
Это особенно ценно при планировании операции, при диагностике травм и новообразований (опухолей). С помощью снимков МРТ врач может выявить все структурные изменения в костной и хрящевой тканях, в связках задолго до того, как это можно будет «увидеть» с помощью других методов исследования. Кроме того, отсутствие лучевой нагрузки дает возможность использовать МРТ для контроля за эффективностью проводимого лечения.
В отличие от других методов диагностики, магнитно-резонансная томография позволяет получить четкое изображение не только костных структур и хрящевых тканей, но и мягких тканей вокруг состава. Поэтому наиболее часто проводится МРТ коленного сустава и других крупных суставов.
МРТ коленного сустава
Особая диагностическая ценность МРТ коленного сустава состоит в получении исчерпывающей картины дегенеративно-дистрофических изменений (хронические артриты и остеоартрозы, повреждения суставных поверхностей) и возможности визуализации самых мелких травм (разрывы связок, сухожилий, переломы), визуализация хряща с последующим его картированием для определения дистрофических и травматических изменений.

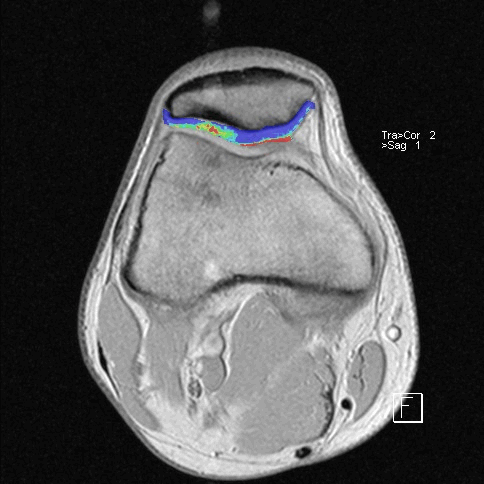
Дистрофические изменения суставного хряща надколенника (с использованием опции «картирования хряща»)
МРТ помогает с большой точностью установить полный или же частичный разрыв мениска, прекрасно и наглядно отображает состояние связок коленного сустава. При диагностировании передней крестообразной связки МРТ показывает разрывы ясно и четко в 96%. Магнитно-резонансная томография наглядно демонстрирует не только разрывы сухожилий, но и гораздо более тонкие проблемы, возникающие во внутренней структуре, сопряженные с воспалением или рубцеванием тканей, которые при неблагоприятном прогнозе могут вызвать определенные хронические заболевания.
Кроме того, МРТ коленного сустава и других крупных суставов оказывает большую помощь для планирования хирургических операций (протезирования, артроскопии), а также в период послеоперационного мониторинга состояния.
МРТ коленного и других крупных суставов проводится при следующих общих показаниях:
- травма сустава (повреждение внутрисуставных и наружных связок, суставных хрящей);
- переломы в области суставов (в том числе рентгенологически скрытые);
- частичный или полный разрыв мениска;
- дистрофические изменения сустава (остеоартроз);
- хронический артрит;
- выраженный болевой синдром в суставе или в мягких тканях вокруг него;
- припухлость сустава;
- наличие жидкости в полости сустава.
МРТ плечевого сустава
Плечелопаточный периартрит (периартроз, периартикулярные поражения области плечевого сустава) - собирательный термин всех периартикулярных поражений области плечевого сустава. Нередко боли в области плечевого сустава вызваны не поражением самого сустава, а околосуставных мягких тканей. Наиболее частой причиной острой или хронической боли в области плечевого сустава является дегенеративно-воспалительное поражение сухожилий мышц, участвующих в движениях плеча (тендиниты). От чрезмерной физической нагрузки (у маляров, спортсменов и людей других профессий) сухожильные волокна растягиваются и надрываются. В конечном итоге развивается воспалительный процесс. Острый период с резкими болевыми ощущениями у таких пациентов длится обычно несколько недель, и при эффективном лечении интенсивность болей в плече снижается, функция сустава восстанавливается. Однако благоприятное течение заболевания с полным выздоровлением заканчивается далеко не у всех. У многих больных при неблагоприятном развитии патологического процесса боли в плече не проходят, а подчас усиливаются не только при физической нагрузке, но и в покое, приобретают постоянный характер. Движения в суставе, как правило, сопровождаются хрустом различной интенсивности. В далеко зашедших случаях может возникнуть тугоподвижность сустава, атрофия мышц и остеопороз головки плечевой кости. При рентгеновском исследовании чаще всего определяется кальцификация (отложение солей) в суставных сумках и в окружающих сустав тканях. МРТ дает полную картину патологических изменений в периартикулярных тканях на ранних этапах заболевания - это отек в области сухожилий, их истончение или неполный разрыв, наличие выпота в суставных синовиальных сумках, атрофия отдельных групп мышц и др. Среди основных показаний к МРТ исследованию плечевого сустава являются нестабильности в суставе и разрывы вращательной манжеты плеча.
Нестабильность плечевого сустава отмечается при слабой фиксации головки плечевой кости в суставной впадине лопатки, которая приводит к повышенной подвижности в суставе и часто к развитию вывихов и подвывихов при травмах, определенных положениях руки (например, при бросании предметов из-за головы вперед). Если диагностика вывихов не представляет особых затруднений при обычном рентгенологическом исследовании, то подвывихи не всегда четко визуализируются при данном методе лучевой диагностики. МРТ диагностика в этих случаях позволяет визуализировать даже незначительные нарушения взаимоотношений головки плечевой кости и суставной впадины лопатки.
Разрывы вращательной манжеты плеча являются наиболее частой причиной болевого синдрома в плечевом суставе во всех возрастных группах взрослого населения и невозможности поднять или отвести руку. МРТ диагностика при данной травме позволяет визуализировать как полный разрыв связок, так и частичное их повреждение. Как правило, сопутствующими осложнениями повреждений вращательной манжеты плеча является скопление жидкости в субакромиальной и поддельтовидной сумках (находятся между мышцами), что также хорошо выявляется при МРТ исследовании. А восстановление разрыва сухожилий вращательной манжеты является сложной хирургической операцией.

МРТ признаки повреждения акромиально-ключичного сочленения на уровне плечевого сустава

МРТ плечевого сустава
МРТ локтевого сустава
Травма в области локтевого сустава чаще, чем в других местах, осложняется нарушением кровообращения, при котором руку может спасти только раннее оперативное вмешательство. Диагностика заболеваний локтевого сустава обычно не вызывает затруднений, поскольку он хорошо доступен для обследования. Среди всех поражений локтевого сустава чаще всего встречаются травматические повреждения (особенно у спортсменов). Переломы костей, образующих локтевой сустав, хорошо диагностируются при рутинном рентгенологическом исследовании. Применение МРТ необходимо для визуализации повреждений суставной капсулы, связок и сумок локтевого сустава. Разрывы локтевой боковой связки представляют собой один из наиболее характерных видов спортивных травм и часто сочетаются с разрывами капсулы сустава, переломами внутреннего надмыщелка и венечного отростка локтевой кости. Прямыми МРТ признаками разрыва локтевой боковой связки являются прерывистость хода ее волокон, наличие жидкости в полости сустава и отек мягких тканей вокруг. Часто, как следствие острой или хронической травмы, развивается бурсит в области локтевого отростка с наличием выпота в поверхностной сумке, который отчетливо виден при осмотре пациента. Другим характерным повреждением локтевого сустава является эпикондилит - хроническое дегенеративно-дистрофическое заболевание, обусловленное постоянной травматизацией сустава у спортсменов (теннисистов, бейсболистов, игроков в гольф, боулинг и др.), а также у людей определенных профессий (каменщиков, маляров, швей и др.). На МРТ изображениях определяется утолщение или истончение сухожилий мышц, прикрепляющихся к надмыщелкам плечевой кости, частичные разрывы этих связок с выпотом и отеком вокруг.

Посттравматическая энтезопатия общего сухожилия мышц-разгибателей («латеральный эпикондилит»)
МРТ кисти и лучезапястного сустава — самый информативный метод диагностики, дающий возможность оценки состояния костно-суставных и мягких тканей.
Показания к МРТ кисти и лучезапястного сустава: спортивные, производственные и бытовые травмы кисти и лучезапястного сустава, в том числе повреждения связочного аппарата кисти, хрящей, разрывы капсулы лучезапястного сустава и связок запястья, инородные тела, ущемление сухожилий, а также ущемление нервов (карпальный туннельный синдром), заболевания связочно-мышечного аппарата кисти и лучезапястного сустава различной природы (теносиновиты, гигромы, контрактура Дюпюитрена, флегмона и др.), заболевания суставов различной природы (артриты, артрозы, поражение суставов при коллагенозах, сахарном диабете, подагре, остеомиелите и т.д.) – все эти виды патологии кисти и лучезапястного сустава с высокой степенью достоверности можно установить с помощью МРТ. Показаниями к проведению МРТ являются противоречивость клинических данных и неясность или отсутствие характерных рентгенологических признаков повреждений области лучезапястного сустава, болевой синдром и нарушение функции кистевого сустава неясного генеза, в том числе при отсутствии травмы в анамнезе. Магнитно-резонансная томография является эффективным методом диагностики не только повреждений кистевого сустава и их последствий, но и мониторинга результатов проводимого лечения, так как обеспечивает возможность комплексной визуализации костных и мягкотканных структур этой области. МРТ кистевого сустава целесообразно проводить всем пациентам на начальном этапе лучевого обследования после рентгенологического исследования при травме кистевого сустава и неясной клинико-лучевой картине, а также при тяжелой травме со значительными повреждениями костных и мягкотканных структур, либо при болевом синдроме и нарушении функции в суставе неясного генеза при отсутствии травмы в анамнезе.

МРТ голеностопного сустава
Минимальные костные повреждения, обычно не выявляемые при рентгене, хорошо визуализируются при МРТ и КТ.
Для выявления изменений внесуставных стабилизаторов голеностопного сустава УЗИ и МРТ имеют примерно одинаковую диагностическую информативность. Оптимальным видом лучевого исследования для выявления изменений внутрисуставных структур голеностопного сустава является МРТ.
МРТ является наиболее универсальным методом визуализации повреждений всех структур голеностопного сустава. КТ позволяет детализировать (оценить степень и распространенность) выявленных при МРТ минимальных костных переломов. Повреждение связок по данным некоторых авторов в 16-21% случаев сопровождает спортивные травмы голеностопного сустава. При острой травме чаще всего повреждается передняя таранно-малоберцовая связка, реже - пучки дельтовидной связки.
Поскольку острые повреждения связок редко лечатся хирургически, магнитно-резонансная томография чаще всего назначается при наличии клинических признаков нестабильности сустава для решения вопроса о тактике ведения пациента и профпригодности.
МРТ критерии диагностики острых разрывов включают изменение интенсивности сигнала внутри и вокруг связок, прерывистость волокон, исчезновение жировых включений в структуре связки, признаки отека окружающих мягких тканей, контузию сочленяющихся костей.
По данным P.W. Bearcroft и соавт. чувствительность МРТ в выявлении острых повреждений связок голеностопного сустава составляет 94-96%, для хронических разрывов – 82-90%. МРТ обладает наибольшей чувствительностью (96-97%) и специфичностью (98%) в выявлении стрессовых переломов на ранней стадии.

Патологическое образование сухожилия подошвенной фасции
Остеохондральные повреждения в суставах (малые и крупные повреждения кости и хряща) - по существу МРТ является единственным методом, дающим исчерпывающую информацию о размере и локализации повреждения, состоянии покровного суставного хряща, конгруэнтности суставных поверхностей, жизнеспособности костного фрагмента, стабильности или степени восстановления между остеохондральным фрагментом и местом-донором, локализации костного фрагмента при его смещении в полость сустава.
Нейропатии периферических нервов конечностей, возникающие вследствие ущемления нервов конечности, обычно не всегда диагностируются из-за несовершенства техники клинического исследования, а результаты электрофизиологического анализа не надежны. Магнитно-резонансная томография дает детальную информацию о ходе и морфологии периферического нерва, а также точную дифференцировку окружающих мягкотканных структур и костных тканей, которые могут привести к ущемлению нерва.

Туннельная невропатия локтевого нерва
Таким образом, магнитно-резонансная томография по сравнению с другими методами лучевой диагностики дает лучшую визуализацию мягких тканей, а также позволяет определить костные изменения на ранней стадии, дополняя и превосходя рентгенологические данные:
Новые методы прогнозирования желудочковых нарушений ритма и синкопальных состояний у пациентов с гипертрофической кардиомиопатией Текст научной статьи по специальности «Клиническая медицина»
ГИПЕРТРОФИЧЕСКАЯ КАРДИОМИОПАТИЯ / 2D SPECKLE TRACKING ЭХОКАРДИОГРАФИЯ / МРТ СЕРДЦА С ОТСРОЧЕННЫМ КОНТРАСТИРОВАНИЕМ ГАДОЛИНИЕМ / ШКАЛА ПРОГНОЗИРОВАНИЯ ЖИЗНЕУГРОЖАЮЩИХ АРИТМИЙ / HYPERTROPHIC CARDIOMYOPATHY / 2D SPECKLE TRACKING ECHOCARDIOGRAPHY / CMR WITH DELAYED CONTRAST GADOLINIUM / A SCALE PREDICTING LIFE- THREATENING ARRHYTHMIAS
Аннотация научной статьи по клинической медицине, автор научной работы — Захарова Е.Ю.
Обследовано 152 пациента с гипертрофической кардиомиопатией . Для выявления новых предикторов желудочковых нарушений ритма проводили МРТ сердца с отсроченным контрастированием гадолинием и с Т1-картированием, 2D Speckle tracking эхокардиогра- фию. По результатам обследования выявили новые предикторы желудочковых тахиаритмий (ECV, региональная септальная деформация миокарда), на основании которых разработана шкала прогнозирования риска жизнеугрожающих аритмий, ее можно использовать для ранней стратификации групп риска внезапной сердечной смерти.
Похожие темы научных работ по клинической медицине , автор научной работы — Захарова Е.Ю.
Новые методы прогнозирования прогрессирования хронической сердечной недостаточности у пациентов с гипертрофической кардиомиопатией
Прогностическое значение глобальной продольной деформации у пациентов с гипертрофической кардиомиопатией
Дополнительная ценность количественного определения фиброза миокарда методом магнитно-резонансной томографии c контрастированием в идентификации пациентов с гипертрофической кардиомиопатией и риском внезапной сердечной смерти
New methods for predicting ventricular rhythm and syncope disorders in patients with hypertrophic cardiomyopathy
152 patients with hypertrophic cardiomyopathy were examined. To identify new predictors of ventricular arrhythmias, patients underwent CMR with delayed contrasting gadolinium and T1-mapping, 2D Speckle tracking echocardiography . New predictors of ventricular tachyarrhythmias (ECV, regional septal myocardial deformity) were revealed, based on which a scale for predicting the risk of life-threatening arrhythmias was developed, which can be used for early stratification of risk groups for sudden cardiac death.
Текст научной работы на тему «Новые методы прогнозирования желудочковых нарушений ритма и синкопальных состояний у пациентов с гипертрофической кардиомиопатией»
в остальных группах и гораздо более выраженной при синдроме гипертиреоза -42,9% и гипотиреоза - 32,3%, при этом различия между показателями не были статистически значимы (р>0,05).
3. Автономная нейропатия с поражением парасимпатической иннервации при синдроме гипертиреоза составляла 14,3% и отсутствовала при синдроме гипотиреоза и у больных с эутиреоидной патологией ЩЖ.
Л И Т Е Р А Т У Р А
1. Qurbanov YZ., Qliyeva G.I., Mirzazada VA. // Azarbayxan tababatinin mûasir nalliyyyatlari. -2017. - №3. - P.3-9.
2. Алиева Г.И., Мирзазаде М.В., Гурбанов Я.З. // Биомедицина. - 2017. - №4.
3. Мирзазаде В.А., Алиева Г.И., Гурбанов Я.З. Автономная диабетическая нейропатия.
4. Qliyeva G.I. // Azarbaycan Metabolizm Jurnali. -
2015. - Vol.1. - P.46-47.
5. Qliyeva G.I., Qurbanov YZ., Hasanova MT, Qliyeva X.FF // Azarbaycan Metabolizm Jurnali,
2016. - Vol.13. - P.31-32.
6. Saidova FFX., Mirzazada VA. Endokrinologiya. Giri§ / Baki, «Tabib na§riyyati», 2016. - 313 s.
7. Аметов А.С. Избранные лекции по эндокринологии. - Москва, 2009. - 496 с.
8. Дедов И.И., Мельниченко Г.А. Эндокринология: Национальное руководство. - Москва, 2008. -1072 с.
9. Древаль А.В. Эндокринные синдромы. Диагностика и лечение. - М., 2014. - 416 с.
10. Мирзазаде В.А. Автономная диабетическая нейропатия (патогенез, клиника, диагностика,
лечение): Дис. . д-ра мед. наук. - Баку, 1991. -341 с.
11. Vinik A.I., Ziegler D. // Circulation. - 2007. -Vol.115. - Р.387-397.
12. Ewing D.J., Campbell I.W., Burt A.A., Clarke B.F // Lancet. - 1973. - Vol.2. - Р.1354-1356.
13. Qliyeva G.I., Qurbanov YZ., Mirzazada VA., Novruzova M.S. // Azarbayxan tababatinin müasir nalliyyyatlari. - 2017. - Vol.4. - P.17-23.
14. Алиева Г.И., Гурбанов Я.З., Мирзазаде В.А. Решение проблемы несогласованности результатов ЭКГ-тестов для оценки состояния парасимпатической иннервации у больных сахарным диабетом типа 2 с помощью балльной системы.
Поступила 04.07.2018 г.
Новые методы прогнозирования желудочковых нарушений ритма и синкопальных состояний у пациентов
с гипертрофической кардиомиопатией
Республиканский научно-практический центр«Кардиология», Минск, Беларусь
Republican Scientific and Practical Center"Cardiology", Minsk, Belarus New methods for predicting ventricular rhythm and syncope disorders in patients with hypertrophic cardiomyopathy
Резюме. Обследовано 152 пациента с гипертрофической кардиомиопа тией. Для выявления новых предикторов желудочковых нарушений ритма проводили МРТ сердца с отсроченным контрастированием гадолинием и с Т1-картированием, 2D Speckle tracking эхокардиогра-фию. По результатам обследования выявили новые предикторы желудочковых тахиаритмий (ECV, региональная септальная деформация миокарда), на основании которых разработана шкала прогнозирования риска жизнеугрожающих аритмий, ее можно использовать для ранней стратификации групп риска внезапной сердечной смерти.
Ключевые слова.: гипертрофическая кардиомиопатия, 2D Speckle tracking эхокардиография, МРТ сердца с отсроченным контрастированием гадолинием, шкала прогнозирования жизнеугрожающих аритмий.
Keywords: hypertrophic cardiomyopathy, 2D Speckle tracking echocardiography, CMR wtth delayed contrast gadolinium, a scale predicting life-threatening arrhythmias.
Meditsinskie novosti. - 2018. - N12. - P. 73-75.
Идентификация пациентов с высоким риском жизнеугрожающих аритмий для первичной профилактики внезапной сердечной смерти (ВСС) является актуальной задачей. Согласно существующим рекомендациям Европейского общества кардиологов (ESC) 2014 года [1], шкала подсчета риска развития ВСС включает оценку наличия неустойчивой желудочковой тахикардии (НЖТ) как предиктора неблагоприятных событий, определяемой с помощью
Миокардиальный фиброз играет важную роль в аритмогенезе у пациентов
с ГКМП. Электрофизиологические исследования показали, что у пациентов с ГКМП со злокачественными аритмиями имеет место усиление электрической нестабильности миокарда и негомогенность внутрижелудочковой проводимости, вероятно, в связи с гипертрофией кардиомиоцитов и наличием миокарди-ального фиброза, формирующих субстрат для желудочковых аритмий [3].
Исследования МРТ с отстроченным контрастированием в клинической
П Клинико-инструментальная характеристика у пациентов с наличием или отсутствием эпизодов НЖТ
Показатель Пациенты с НЖТ (I группа), n=74 Пациенты без НЖТ (II группа), n=78 Достоверность
Возраст включения в исследование, лет 46,5±12,8** 40,2±12,6** 0,0051
ВСС в семейном анамнезе, п(%) 17 (23%) 15 (19%) 0,1290
Наличие синкопе, п (%) 15 (20,3%) 16 (20,5%) 0,6601
Балл риска ВСС по шкале Е5С-2014 (46) 7,3±4,4** 3,1±1,9**
ТМЖП максимальная, мм 20,6±4,5 20,1±4,6 0,7397
ФВЛЖ, % 60,9±9,7** 66,6±7,7** 0,0012
ГД ВТЛЖ >30 мм рт.ст., п (%) 34 (31%) 39 (50%) 0,5765
ММЛЖ, г 311,7±96,6 307,3±107,2 0,8086
ИММЛЖ, г/м2 166,7±47,6 155,8±45,9 0,4162
Число пациентов с фиброзом 44 (59,4%) 41 (52,5%) 0,4032
Число сегментов с фиброзом миокарда 5,6±3,9 3,6±3,2 0,0055
Процент объема фиброза 20,8±17,1** 12,3±12,1** 0,0044
ЕСУ % (48) 33,9±8,2** 27,8±4,3** 0,0036
практике показали, что наличие очагов фиброза миокарда является важным фактором риска развития ВСС у пациентов с ГКМП [3]. Тем не менее, B. Maron и соавт. не обнаружили существенных различий в основных клинических событиях у пациентов с ГКМП и наличием или отсутствием очагов фиброза. Очаги отсроченного контрастирования потенциально недооценивают количество фиброза миокарда, потому что этот метод требует наличия нормального нефибротического миокарда в качестве эталона, который часто отсутствует у пациентов с ГКМП с диффузным (субэндокардиальным) фиброзом миокарда. Кроме того, наличие очагов отсроченного контрастирования не было существенно различно у пациентов с ГКМП без синкопальных состояний и наличия эпизодов НЖТ. R.H. Chan и соавт. нашли нелинейную зависимость между степенью фиброза миокарда и наличием неблагоприятных событий. Однако эти события были только у пациентов с более крупными размерами фиброза >5% левого желудочка (ЛЖ) [4]. Т1-картирование и измерение внеклеточного объема (ECV) позволяют определить диффузный фиброз миокарда [7] независимо от удаленного нормального миокарда, что делает потенциально полезным использование этого метода для количественного определения эндокарди-ального фиброза у пациентов с ГКМП.
Оценка глобальной продольной деформации методом 2D Speckle tracking в дополнение к традиционным показателям, рекомендованным объединенными рекомендациями Американского эхокардиографического общества и Европейской ассоциации эхокардиографии по количественной оценке структуры и функции камер сердца при ГКМП [5], позволяет более точно определить состояние систолической функции миокарда. В ряде исследований было показано, что снижение глобальной продольной деформации связано с неблагоприятными исходами при ГКМП [6].
В данной работе проведена оценка отсроченного контрастирования и картирования МРТ включая определение внеклеточного объема для прогнозирования синкопальных состояний или желудочковых аритмий у пациентов с ГКМП.
Материалы и методы
Исследуемая когорта состояла из 152 пациентов в возрасте от 17 до 68 лет (99 мужчин и 53 женщин, медиана возраста - 46 лет), медиана наблюдений составила 3,5 года. При анализе прогноза заболевания использовался полный комплекс изучаемых и представленных в данной работе клинико-инстру-ментальных методов исследования. При ХМ ЭКГ оценивали количество желудочковых экстрасистол, наличие эпизодов неустойчивой желудочковой тахикардии (НЖТ) и фибрилляции предсердий (ФП). Наличие устойчивой желудочковой тахикардии (ЖТ) определялось при остановке синусового узла и документированной устойчивой ЖТ при ХМ ЭКГ или мониторинге ЭКГ в палате интенсивной терапии. НЖТ определялась при частоте желудочковых эктопий >3 в течение 3 секунд с частотой >100 ударов в минуту. Риск развития ВСС оценивали по шкале, предложенной ESC-2014. МРТ сердца осуществляли при включении пациентов в исследование, было выполнено у 102 из 152 пациентов. Оценку продольной региональной перегородочной дефор-
мации проводили методом 2D Speckle tracking эхокардиографии (оценивали показатели региональной деформации базального передне-перегородочного и базального перегородочного сегментов миокарда).
Результаты и обсуждение
Клинические конечные точки включали в себя наличие документированной устойчивой желудочковой тахикардии, остановки синусового узла и фибрилляции желудочков, синкопальные состояния, обусловленные эпизодом ЖТ или идиовентрикулярным ритмом, эпизоды неустойчивой ЖТ при 24-часовой ХМ ЭКГ.
При исходном обследовании среди 152 пациентов с ГКМП у 74 (48,6%) при ХМ ЭКГ регистрировали эпизоды НЖТ у остальных 77 (51,4%) пациентов НЖТ не выявили. Клиническая характеристика и инструментальные данные пациентов с наличием желудочковых
Таблица 2 Многофакторный анализ риска развития жизнеугрожающих желудочковых событий у пациентов с ГКМП
Фактор ОР (95% ДИ) Достоверность
Возраст, лет 1,1 (1,01-1,2) 0,0144
Балл риска по шкале ESC 2,2 (1,3-3,6) 0,0001
ECV, % 1,2 (0,97-1,4) 0,0554
Таблица 3 Шкала прогнозирования риска развития жизнеугрожающих аритмий и синкопальных состояний
Предиктор Состояние Балл
Global ECV % >30 23
Среднее БазПП и БазПеред (региональный септальный стрейн)
нарушений ритма (группа 1) и их отсутствием (группа 2) представлены в таблице 1.
У пациентов с наличием эпизодов НЖТ возраст вступления в исследование был значимо выше (р=0,0051) и выявлен более высокий балл риска развития ВСС по шкале ESC-2014 по сравнению с пациентами с отсутствием желудочковых нарушений ритма (р<0,005). По данным ЭхоКГ исследования у пациентов с желудочковыми нарушениями ритма значимых различий не выявлено.
По данным МРТ, процент зоны отсроченного контрастирования миокарда по отношению к объему миокарда и число сегментов с фиброзом миокарда у пациентов с эпизодами НЖТ был значимо больше (р<0,05). Показатель ЕСУ значимо различался у пациентов с желудочковыми аритмиями и при их осутствии (р=0,0036).
С целью определения предикторов неблагоприятных событий, связанных с развитием желудочковых тахиаритмий, был проведен одно-факторный регрессионный анализ, все значимые показатели в одно-факторном регрессионном анализе были включены в многофакторный анализ и определены их пороговые значения (табл. 2).
При определении порогового значения показателя ЕСУ для выявления пациентов с синкопальными состояниями и желудочковыми аритмиями методом ROC-анализа показано, что использование значения ЕСУ >32,5% привело к чувствительности 74% и специфичности
86%. Показатель ECV одинаково хорошо позволяет идентифицировать пациентов с риском возникновения синкопальных состояний или НЖТ как и шкала риска развития ВСС ESC-2014. Проведенный ROC-анализ показал, что при значении риска возникновения ВСС по шкале HCM-score ESC 3,92 существует высокая вероятность развития угрожающих желудочковых нарушений ритма (чувствительность - 81%, специфичность - 80%). Комбинированное использование шкалы риска возникновения ВСС с пороговым значением >3,9% и ECV >32,5% (AUC 0,841 и 0,761 соответственно) приводило к значительно лучшей диагностической точности.
Для простоты и большей доступности метода прогнозирования риска развития неблагоприятных событий и исходов нами разработана оценочная шкала стратификации групп риска, основанная на оценке клинико-инструментальных предикторов для пациентов с ГКМП (табл. 3).
Для каждого наблюдения независимой выборки было подсчитано суммарное количество баллов. Например, у пациента N. риск развития ВСС по шкале ESC=2,1 (0 баллов), ECV=33 (23 балла), Среднее БазПП и БазПеред - 7,6 (9 баллов). Итого у пациента N. в сумме получилось 32 балла. Подсчитав суммарное количество баллов для каждого пациента посредством ROC-анализа, устанавливаем оптимальное пороговое значение 38 (чувствительность - 87% и специфичность - 79%, AUC=0,84).
Таким образом, на основании оценки предикторов риск развития ВСС по шкале ESC, глобального внеклеточного объема по данным МРТ сердца с Т1-картированием и показателем региональной продольной септальной деформации по данным 2D Speckle tracking эхокардиографии у конкретного пациента с помощью подсчета баллов можно с высокой вероятность прогнозировать наличие или отсутствие жизнеугрожающих аритмий. Суммарный балл выше 38 говорит о наличии жизне-угрожающих аритмий и синкопальных состояний.
В ходе данного исследования была разработана шкала прогнозирования риска развития желудочковых аритмий и синкопальных состояний у пациентов с гипертрофической кардиомио-патией. Суммарный балл выше 38 с высокой вероятностью ассоциирован с развитием жизнеугрожающих аритмий и синкопальных состояний (чувствительность - 87%, специфичность - 79%). Полученная шкала улучшает прогнозирование желудочковых тахиаритмий и синкопальных состояний у пациентов с гипертрофической кардиомиопатией, что может помочь в стратификации риска и своевременной профилактике развития внезапной сердечной смерти.
Л И Т Е Р А Т У Р А
1. Elliott P.M., Anastasakis A., Borger M.A., et al. // Eur. Heart J. Hypertrophic Cardiomyopathy. - 2014. -Vol.35. - P.2733-2779.
2. Maron B.J. // Circulation. - 2010. - Vol.121. -P.445-456.
4. Chan R.H., Maron B.J., Maron M.D., et al. // Circulation. - 2014. - Vol.130, N6. - P.484-495. doi:10.1161/circulationaha.113.007094
5. Lang R.M., Bierig M., Devereux R.B., et al. // J. Am. Soc. Echocardiogr. - 2005. - Vol.18. -P.1440-1463.
6. Reant P., Mirabel M., Lloyd G., et al. // Heart. -2016. - Vol.102, N10. - P.741-747. doi:10.1136/ heartjnl-2015-308576. Epub 2016 Feb 8
7. Kammerlander A.A., Marzluf B.A., Zotter-Tufaro C., et al. // J. Am. Coll. Cardiol. Img. - 2016. - Vol.9. -P.14-23.
Магнитно-резонансная томография сердца при гипертрофической кардиомиопатии: диагностические возможности, применение в клинической практике, прогностическая значимость
В настоящее время визуализирующие методы исследований играют центральную роль в оценке состояния сердечно-сосудистой системы. Магнитно-резонансная томография (МРТ) сердца заняла одну из главных позиций в диагностике и прогностической значимости гипертрофической кардиомиопатии (ГКМП). В статье представлен краткий обзор, посвященный как традиционным, так и новым сферам применения МРТ при ГКМП. Особое внимание уделено роли МРТ в отборе пациентов для хирургического лечения ГКМП.
Ключевые слова
Об авторах
Светлана Вадимовна Шаяхметова — зав. отделением рентгенологической, рентгенотомографической и магнитно-резонансной диагностики
Валентин Евгеньевич Синицын — д. м.н., профессор, зав. кафедрой лучевой диагностики и лучевой терапии, руководитель отделения лучевой диагностики, факультет фундаментальной медицины
Александр Владимирович Афанасьев — к. м.н., врач сердечно-сосудистый хирург отделения приобретенных пороков сердца, Центр новых хирургических технологий
Список литературы
1. Агеев Ф. Т., Габрусенко С. А., Постнов А. Ю. и др. Клинические рекомендации по диагностике и лечению кардиомиопатий (гипертрофическая). Кардиологический вестник. 2016;1:3-22.
2. Elliot PM, Anastasakis A, Borger MA, et al. ESC recommendations for the diagnosis and treatment of hypertrophic cardiomyopathy: a target group for the diagnosis and treatment of hypertrophic cardiomyopathy of the European Society of Cardiology. Eur Heart J. 2014;35:2733-79. doi:10.1093/eurheartj/ehu284.
3. Maron BJ, Rowin EJ, Casey SA, et al. Hypertrophic cardiomyopathy in adulthood associated with low cardiovascular mortality with contemporary management strategies. J Am Coll Cardiol. 2015;65(18):1915-28. doi:10.1016/j.jacc.2015.02.061.
4. Maron MS, Rowin EJ, Olivotto I, et al. Contemporary natural history and management of nonobstructive hypertrophic cardiomyopathy. J Am Coll Cardiol. 2016;67(12):1399-409. doi:10.1016/j.jacc.2016.01.023.
5. Vatutin NT, Taradin GG, Maron MS. Hypertrophic cardiomyopathy: genetic changes, pathogenesis and pathophysiology. Russian Journal of Cardiology. 2014;(5):35-42. (In Russ.) Ватутин Н. Т., Тарадин Г. Г., Марон М. С. Гипертрофическая кардиомиопатия: генетические изменения, патогенез и патофизиология. Российский кардиологический журнал. 2014;(5):35-42. doi:10.15829/1560-4071-2014-5-35-42.
6. Baxi AJ, Restrepo CS, Vargas D, et al. Hypertrophic Cardiomyopathy from A to Z: Genetics, Pathophysiology, Imaging, and Management. RadioGraphics. 2016;36(2):33554. doi:10.1148/rg.2016150137.
7. Camici PG, Olivotto I, Rimoldi OE. The coronary circulation and blood flow in left ventricular hypertrophy. J Mol Cell Cardiol. 2012; 52(4):857-64. doi:10.1016/j.yjmcc.2011.08.028. Epub 2011 Sep 5.
8. Maron MS, Olivotto I, Harrigan C, et al. Mitral valve abnormalities identified by cardiovascular magnetic resonance represent a primary phenotypic expression of hypertrophic cardiomyopathy. Circulation. 2011;124:407. doi:10.1161/CIRCULATIONAHA.110.985812. Epub 2011 Jun 13.
9. Maron MS. Clinical utility of cardiovascular magnetic resonance in hypertrophic cardiomyopathy. J Cardiovasc Magn Reson. 2012;14:13. doi:10.1186/1532-429X-14-13.
10. O’Mahony C, Jichi F, Pavlou M, et al. A novel clinical risk prediction model for sudden cardiac death in hypertrophic cardiomyopathy (HCM Risk-SCD). European Heart Journal. 2013;35(30):2010-20. doi:10.1093/eurheartj/eht439.
11. Varma PK, Neema PK. Hypertrophic cardiomyopathy: Part 1 — Introduction, pathology and pathophysiology. Annals of Cardiac Anaesthesia. 2014;17(2):118. doi:10.4103/09719784.129841.
12. Bogaert J, Olivotto I. MR Imaging in Hypertrophic Cardiomyopathy: From Magnet to Bedside. Radiology. 2014;273(2):329-48. doi:10.1148/radiol.14131626.
13. Chun EJ, Choi SI, Jin KN, et al. Hypertrophic cardiomyopathy: assessment with MR imaging and multidetector CT. RadioGraphics. 2010;30(5):1309-28. doi:10.1148/rg.305095074.
14. To AC, Dhillon A, Desai MY. Cardiac magnetic resonance in hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 2011;4(10):1123-37.
15. Rudolph A, Abdel-Aty H, Bohl S, et al. Noninvasive detection of fibrosis applying contrast-enhanced cardiac magnetic resonance in different forms of left ventricular hypertrophy: relation to remodeling. J Am Coll Cardiol. 2009;53(3):284-91. doi:10.1016/j. jacc.2008.08.064.
16. Puntmann VO, Jahnke C, Gebker R, et al. Usefulness of magnetic resonance imaging to distinguish hypertensive and hypertrophic cardiomyopathy. Am J Cardiol. 2010;106(7):1016-22. doi:10.1016/j.amjcard.2010.05.036. Epub 2010 Aug 11.
17. Maron MS, Maron BJ. Clinical impact of contemporary cardiovascular magnetic resonance imaging in hypertrophic cardiomyopathy. Circulation. 2015;132:292-8. doi:10.1161/CIRCULATIONAHA.114.014283.
19. Sinitsyn VE, Mershina EA, Larina OM. Cardiac magnetic imaging opportunities in the diagnosis of cardiomyopathy. Clin. Experiment. Surg. Petrovsky J. 2014;1:54-63. (In Russ.) Синицын В. Е., Мершина Е. А., Ларина О. М. Возможности магнитно-резонансной томографиии в диагностике кардиомиопатии. Клин. и эксперимент. хир. Журн. им. акад. Б. В. Петровского. 2014;1:54-63.
20. Puntmann VO, Voigt T, Chen Z, et al. Native mapping of T1 in the differentiation of the normal myocardium from diffuse disease in hypertrophic and dilated cardiomyopathy. JACC Cardiovasc Imaging. 2013;6:475-84. doi:10.1016/j.jcmg.2012.08.08.019.
21. Dass S, Suttie JJ, Piechnik SK, et al. Characterization of myocardial tissue using magnetic resonance non-contrast t1 mapping in hypertrophic and dilated cardiomyopathy. Circ Cardiovasc Imaging. 2012;5:726-33. doi:10.1161/CIRCIMAGING.112.976738.
22. Sado DM, Flett AS, Banipersad SM, et al. Cardiovascular magnetic resonance measurement of extracellular myocardial volume in normal and pathological conditions. Heart. 2012;98:1436-41. doi:10.1136/heartjnl-2012-302346.
23. Ho CY, Abbasi SA, Neilan TG, et al. T1 measurements identify extracellular volume expansion in hypertrophic cardiomyopathy sarcomere mutation carriers with and without left ventricular hypertrophy. Circ Cardiovasc Imaging. 2013;6(3):415-22. doi:10.1161/CIRCIMAGING.112.000333. Epub 2013 Apr 2.
24. Sado DM, White SK, Pechnik SK, et al. Identification and assessment of AndersonFabry disease using T1 myocardial non-contrast mapping using cardiovascular magnetic resonance. Circ Cardiovasc Imaging. 2013;6:392-8. doi:10.1161/CIRCIMAGING.112.000070.
25. Fontana M, Banypersad SM, Treibel TA, et al. Native mapping of T1 in transthyretin amyloidosis. JACC Cardiovasc Imaging. 2014;7:157-65. doi:10.1016/j.jcmg.2013.10.008.
26. Green JJ, Berger JS, Kramer CM, et al. Prognostic value of late gadolinium enhancement in clinical outcomes for hypertrophic cardiomyopathy. JACC Cardiovasc Imaging. 2012 Apr;5(4):370-7. doi:10.1016/j.jcmg.2011.11.021.
27. A report of the American College of Cardiology Foundation/ American Heart Association Task Force on Practice Guidelines. 2011 ACCF/AHA guideline for the diagnosis and treatment of hypertrophic cardiomyopathy. J. Thorac. Cardiovasc. Surg. 2011;142:153-203.
28. Spirito P, Binaco I, Poggio D, et al. Role of Preoperative Cardiovascular Magnetic Resonance in Planning Ventricular Septal Myectomy in Patients with Obstructive Hypertrophic Cardiomyopathy. The American Journal of Cardiology. 2019;123(9):151726. doi:10.1016/j.amjcard.2019.01.041.
МРТ при гипертрофической нейропатии
ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента РФ, Москва
ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента РФ, Москва
Краниальная нейропатия вследствие персистирующей герпес-вирусной инфекции
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(3): 75‑78
Лаукарт Е.Б., Селищев А.Г. Краниальная нейропатия вследствие персистирующей герпес-вирусной инфекции. Журнал неврологии и психиатрии им. С.С. Корсакова. 2014;114(3):75‑78.
Laukart EB, Selishchev AG. Cranial neuropathy due to persistent herpes viral infection. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2014;114(3):75‑78. (In Russ.).
ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента РФ, Москва
ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента РФ, Москва
ФГБУ "Центральная клиническая больница с поликлиникой" Управления делами Президента РФ, Москва
Вирус Эпштейна-Барр (ВЭБ) относится к подсемейству Gamma-herpesviridae. Он тропен к В-лимфоцитам и эпителиальным клеткам. Источником инфекции является больной человек. Пути заражения - контактный, воздушно-капельный, трансплацентарный, гемотрансфузионный. Инфицированность вирусом составляет 50% у детей и 85% у взрослых. Первичное заражение в большинстве случаев протекает бессимптомно, однако иногда приводит к развитию картины инфекционного мононуклеоза 2. Обычно клиническая манифестация данной формы развивается в возрасте от 2 до 40 лет. Мононуклеоз регрессирует самостоятельно в течение нескольких недель или 1-2 мес. При этом ВЭБ сохраняется в В-лимфоцитах в латентной форме на протяжении всей жизни. Периодически возбудитель может реактивироваться, степень реактивации инфекции различна 5.
Выделяют хроническую персистенцию вируса, известную как реактивированная хроническая инфекция, вызванная ВЭБ. Клинически данное состояние может проявляться синдромом хронического мононуклеоза, для которого характерна постоянная слабость в условиях выраженного астенического синдрома при наличии или отсутствии изменений лабораторных показателей. Хроническая активная инфекция, вызванная ВЭБ, распространена у пациентов с иммунодефицитом. Наиболее часто она проявляется прогрессирующими лимфопролиферативными заболеваниями - лимфомой Беркитта, саркомой Капоши, первичными лимфомами ЦНС. Механизм развития злокачественных трансформаций, индуцированных ВЭБ, связан с его способностью инфицировать В-лимфоциты и нарушать их дальнейшую дифференцировку. При этом часть вирусного генома накапливается в инфицированных лимфобластах [4, 8].
Часто при отсутствии клинических проявлений мононуклеоза сложно определить причину поражения нервной системы - проявление первичного инфицирования или реактивацию латентной инфекции. Этиология в ряде случаев определяется ретроспективно при проведении серологического исследования и полимеразной цепной реакции (ПЦР) плазмы крови, слюны и цереброспинальной жидкости. Такие заболевания, как энцефалит или энцефаломиелит, могут быть единственными проявлениями реактивации герпетической инфекции. Определение его этиологии затруднено при отсутствии в анамнезе указаний на манифестные клинические проявления в виде мононуклеоза. Возможно как острое, так и хроническое течение энцефалита. Описаны хронические энцефалиты, вызываемые ВЭБ, в клинической картине которых преобладают когнитивные нарушения, поведенческие расстройства, эпилептические приступы и очаговая неврологическая симптоматика - афазия, апраксия и пр. [1, 11].
Основными симптомами поражения IX, X черепных нервов являются нарушение глотания и осиплость голоса. При обследовании определяются изменение чувствительности неба и задней стенки глотки на пораженной стороне, односторонний парез голосовой складки (выявляется при ларингоскопии), феномен кулисы: при вызывании глоточного рефлекса мягкое небо и задняя стенка отклоняются в здоровую сторону. Синдром Тапиа, характеризующийся поражением IX, X, XII черепных нервов, развивается при экстракраниальной аневризме сонной артерии или ее расслоении. Дифференциальный диагноз поражения черепных нервов следует проводить с параличом мягкого неба при дифтерии, а также псевдопаралитической формой миастении.
При поражении XI черепного нерва наблюдаются изолированные двигательные расстройства, в частности парез верхней части трапециевидной мышцы. Плечо опущено, лопатка не фиксирована, при попытке поднимания плеч сила на пораженной стороне снижена. Наблюдается при аномалиях краниовертебрального перехода, опухолях большого затылочного отверстия, синдроме затылочного отверстия [12]. Нейропатия XII черепного нерва проявляется атрофией и парезом половины языка на стороне поражения, возможными причинами могут быть перелом основания черепа в области задней черепной ямки, базилярная импрессия, опухоли основания черепа, расслаивающая аневризма сонной артерии. Кроме указанных, причиной краниальной нейропатии может быть инфекционный процесс, в том числе вызванный вирусами герпеса [3, 12, 13].
Приведенное наблюдение иллюстрирует вариант поражения нервной системы ВЭБ в виде изолированной левосторонней нейропатии IX-XII черепных нервов. С учетом изолированного левостороннего поражения указанных нервов (синдром Верне-Зибенманна в сочетании с парезом трапециевидной мышцы) пациенту проводилось обследование, направленное на выявление базилярной импрессии, опухоли основания черепа, расслаивающей аневризмы внутренней сонной артерии.
Больной П., 1980 года рождения, госпитализирован с жалобами на осиплость голоса, парестезии в области задней трети языка; редкие спонтанные подергивания мышц верхнего плечевого пояса слева.
В августе 2010 г. впервые обратил внимание на ощущение онемения задней трети языка. Спустя 6 мес возникло и постепенно нарастало изменение тембра голоса с эпизодами полной афонии. В 2008 г. перенес вирусную инфекцию, проявляющуюся высыпаниями на кожных покровах левой половины грудной клетки спереди и сзади. Кроме того, у больного часто рецидивировали в течение года высыпания в зоне красной каймы губ, похожие по описанию на инфекцию Herpes simplex.
Инфекционистом не наблюдался. Лечился самостоятельно противовирусными препаратами в виде мазей (ацикловир).
В раннем детстве перенес нейроинфекцию с остаточными явлениями в виде значительного снижения зрения на левый глаз. За последние 2 года с учетом жалоб на дисфонию неоднократно обследовался в различных региональных медицинских центрах, высказывалось предположение о дебюте демиелинизирующего заболевания. Выполнено МРТ головного мозга с внутривенным контрастированием. Однако очаговых изменений в веществе мозга выявлено не было. По рекомендации оториноларингологов проводились повторные курсы противовоспалительной и антибактериальной терапии без положительного эффекта.
При осмотре: общее состояние относительно удовлетворительное. Кожные покровы обычной окраски, периферических отеков нет. В легких хрипов нет. Пульс ритмичный, 68 в минуту. Артериальное давление 120/70 мм рт.ст.

Неврологический статус: сознание ясное, контактен, ориентирован правильно. Менингеальных симптомов нет. Правая глазная щель шире, зрачки симметричные. Зрение на левый глаз снижено. Отмечается мелкоразмашистый горизонтальный нистагм, больше при взгляде влево. Легкая асимметрия носогубных складок. Язык отклоняется влево. Отмечаются выраженные атрофические изменения левой половины языка (см. рисунок). Рисунок 1. Больной П. Атрофические изменения левой половины языка. Спонтанные фибрилляции языка слева. Глоточный рефлекс слева снижен, феномен кулисы, глотание не нарушено. Вкусовые ощущения сохранены. Отмечается дисфония. Парез трапециевидной мышцы слева - опущение плеча, отведение лопатки. Фасцикуляции мышц верхнего плечевого пояса слева, провоцируемые их перкуссией. Убедительных расстройств чувствительности не определяется. Координаторные пробы выполняет удовлетворительно. Легкий тремор пальцев вытянутых рук. В пробе Ромберга чуть пошатывается. Пальпация паравертебральных точек на уровне шейного отдела позвоночника умеренно болезненна (С4, С5, С6). Умеренно выраженный мышечно-тонический синдром на шейном уровне. Патологических стопных рефлексов нет.
Клинический анализ крови: эозинофилы 5,5%, гемоглобин 167 г/л, эритроциты 5,7 млн/мкл, гематокрит 48,5%, тромбоциты 176 тыс/мкл. Общий анализ мочи: микроскопия осадка: эритроциты единичные в препарате, лейкоциты 1-2 в поле зрения, кристаллы солей найдены, аморфные фосфаты - небольшое количество. Биохимический анализ крови: без патологии. Диагностика инфекций: ВИЧ (ИФА), гепатиты В, С (ИФА HBS-антиген, HCV), сифилис (IgG, IgМ) не обнаружены. Диагностика герпес-вирусной инфекции: антитела к вирусу простого герпеса 1-го типа IgG 5,4 - референтные значения: 1,2 положительный; антитела к цитомегаловирусу IgG 18,5 AU/ml - референтные значения 160 AU/ml - референтные значения 24 положительный; антитела к вирусу простого герпеса 1-го типа IgM, антитела к вирусу простого герпеса 2-го типа IgG, IgM; антитела к цитомегаловирусу IgM; антитела к ВЭБ VCA IgМ не обнаружены. Диагностика герпес-вирусной инфекции с помощью ПЦР: в слюне обнаружена ДНК ВЭБ; в крови ДНК ВЭБ не обнаружена.
Фибротрахеобронхоскопия: бронхи свободны с обеих сторон, без признаков эндобронхиального инфильтративного или перибронхиального компрессионного деформирующего процессов.
МРТ головного мозга с внутривенным контрастированием (3,0 Т): расширение преимущественно наружных ликворосодержащих пространств. Признаков патологических изменений в области основания головного мозга не получено. В шейном отделе позвоночника (3,0 Т) картина остеохондроза, задние протрузии межпозвонковых дисков С3-С4, С5-С6, С6-С7; очагов накопления контраста нет.
Мультиспиральная компьютерная рентгеновская томография (МСКТ) экстра- и интракраниальных артерий: S-образная извитость правой внутренней сонной артерии с наличием стеноза на уровне изгиба до 50% за счет компрессии сосуда гипертрофированным шиловидным отростком (вариант анатомического строения). На остальном протяжении данных за наличие дефектов контрастирования, гемодинамически значимых стенозов, аневризм, сосудистых мальформаций, других аномалий сосудистого русла не получено.
МСКТ области шеи (лучевая нагрузка 4 мЗв): гипертрофический ларингит (асимметрия размеров голосовых складок за счет утолщения правой голосовой складки, функциональный парез левой голосовой складки).
Электромиографическое исследование: для обследования доступны только добавочные нервы, М-ответ трапециевидной мышцы в норме, относительное снижение по сравнению со здоровой стороной в 2 раза, латентность в норме. Отмечаются выраженные фасцикуляции в трапециевидной мышце слева, а также признаки денервации мышечных волокон. Результаты игольчатой ЭМГ характерны для нейронального типа поражения добавочного нерва.
ЭЭГ: регистрируется низкоамплитудная полиморфная активность за счет преобладания активирующих влияний ретикулярной формации, что может быть вариантом нормы или проявлением дисфункций стволовых образований мозга. Эпилептической, очаговой активности не отмечено.
Стволовые акустические и зрительные вызванные потенциалы: показатели, характеризующие состояние стволовых структур, в пределах слухового тракта находятся в пределах возрастной нормы слева. Справа снижена амплитуда начальных пиков, что может указывать на дисфункцию периферической порции слухового нерва. Данных за демиелинизацию нет. Зрительные потенциалы - без существенных особенностей справа. Слева резко снижена амплитуда, по-видимому, в связи с патологией периферического анализатора. Данных за демиелинизацию нет.
Ультразвуковое цветовое дуплексное сканирование экстракраниальных отделов брахиоцефальных артерий: гемодинамически значимая S-образная извитость правой внутренней сонной артерии с углом деформации менее 90°. Вариант входа обеих позвоночных артерий в костный канал на уровне поперечных отростков 5-го шейного позвонка. С-образная извитость экстравертебрального отдела левой позвоночной артерии. Внутренние яремные вены не расширены, проходимы.
Транскраниальное ультразвуковое триплексное сканирование артерий виллизиева круга: признаки ангиоспазма в М2-сегменте правой средней мозговой артерии. Скоростные показатели кровотока по левой средней мозговой артерии в М2-сегменте не снижены. Асимметрия и увеличение индексов, характеризующих уровень мозгового сосудистого сопротивления в исследованных бассейнах по сравнению с возрастной нормой, что, очевидно, обусловлено наличием сосудистой дистонии с нарушением регуляции тонуса артерий по гипертоническому типу. Признаков нарушения венозного оттока не выявлено.
Консультация логопеда: легкая дисфункция височно-теменных отделов головного мозга в виде дизритмии, недостаточности пространственного фактора в пробах Хэда и зрительно-инструктивной деятельности. Парез левой голосовой связки, левой половины языка, дисфония - органическая периферическая.
Консультация оториноларинголога: парез левой половины гортани, данных за острый инфекционный процесс нет.
Консультация офтальмолога: левосторонняя амблиопия; частичная атрофия зрительного нерва слева.
Консультация инфекциониста: принимая во внимание данные анамнеза, особенности клинических проявлений заболевания, а также лабораторные показатели, четко указывающие на герпес-вирусную инфекцию, становится понятен генез неврологических симптомов (атрофия левой половины языка с фибрилляциями, парез трапециевидной мышцы слева), следовательно, можно говорить о персистирующей нейроинфекции - вирус герпеса 4-го типа (ВЭБ). В дополнение к лечению: фамвир 500 мг - 2 г в течение 5 дней, затем 1,5 г в течение 3 дней, далее 500 мг (1 таблетка) в течение 1 мес. Кроме того, циклоферон 150 мг (4 таблетки) 1 раз в день - на 1, 2, 4, 6, 8, 11, 14, 17, 20, 23-й дни. В последующем повторить ПЦР (кровь, слюна на ВЭБ).
Лечение: нейромидин 20 мг (½ таблетки) 2 раза в день; глицин по 2 таблетки 3 раза в день; фамвир 500 мг - 2 г в течение 10 дней с продолжением на амбулаторном этапе терапии по схеме, рекомендованной инфекционистом; циклоферон 150 мг (4 таблетки) 1 раз в день по схеме. Внутривенное капельное введение трентала 100 мг в 250 мл физиологического раствора; мексикор 6,0 г в 150 мл физиологического раствора; актовегин 15,0 мл в 10 мл физиологического раствора (внутривенно струйно); внутримышечные инъекции мильгаммы.
Проведенное лечение привело к улучшению состояния пациента: чувство онемения задней трети языка в настоящее время не беспокоит, практически полностью восстановился тембр голоса, однако сохраняются атрофические изменения левой половины языка. Фасцикуляций мышц верхнего плечевого пояса нет.
Приведенное клиническое наблюдение показывает многообразие проявлений поражений нервной системы при герпетической инфекции, вызванной вирусом 4-го типа (ВЭБ).
Диагностическими критериями герпетической инфекции являются наличие факторов риска развития заболевания, результаты исследования иммунологических показателей крови, слюны и ЦСЖ, а также данные нейровизуализационных методов, ЭНМГ, ЭЭГ. Наиболее важным диагностическим тестом является ЭНМГ, которая может выявить фасцикуляции, потенциалы фибрилляции, определить скорость проведения, что подчеркивается асимметричным изолированным поражением ствола нерва или центрального мотонейрона. Из приведенных данных видно, что МРТ головного и спинного мозга позволяет дифференцировать очаговые и/или атрофические структурные изменения от возможного поражения ствола нерва при механической компрессии вследствие базилярной импрессии, расслаивающей аневризме сонной артерии, экстра- и интракраниальных опухолей. При остро текущем герпетическом энцефалите при КТ головного мозга определяются зоны пониженной плотности в лобно-височной области и в инсулярной зоне. При хроническом или рецидивирующем вирусном поражении ЦНС изменения на МСКТ или МРТ могут быть неспецифичными или отсутствовать. На ЭЭГ может наблюдаться диффузное замедление электрической активности с наличием фокальных изменений в передних отделах головного мозга в виде медленных волн или эпилептических знаков [4, 14]. Диагноз заболевания был подтвержден методами лабораторной диагностики, позволяющими обнаружить вирус в клинико-биологическом материале. Важнейшими диагностическими критериями в случае герпетической инфекции, вызванной вирусом герпеса 4-го типа могут быть: 1) обнаружение атипичных мононуклеаров в плазме крови; 2) ПЦР плазмы крови, слюны, цереброспинальной жидкости; 3) серологические тесты - ИФА, иммуноблоттинг.
Прогноз заболевания улучшается при раннем использовании в лечении специфических противовирусных препаратов на фоне приема антиоксидантов, нейропротекторов и антиагрегантов [4, 15]. Основными противогерпетическими препаратами с доказанной эффективностью являются ациклические нуклеозиды - ацикловир, валацикловир, фамцикловир, ганцикловир, валганцикловир, видарбин. Применяются также интерфероны, в частности такие препараты, как интерферон α-2, акридонацетат, тилорон, комплекс дезоксирибонуклеата натрия с железом, которые сдерживают процесс размножения вирионов и снижают концентрацию их в крови и тканях.
Таким образом, основными факторами, определяющими благоприятный исход заболевания, являются молодой возраст пациента и своевременное начало лечения (с момента появления первых клинических проявлений).
Читайте также:
