Рентгенограмма, МРТ при инфаркте кости
Обновлено: 19.04.2024
Сцинтиграфия костей скелета (остеосцинтиграфия) – исследование метаболизма (обмена веществ) костной ткани с помощью радиофармацевтических препаратов (РФП), которые накапливаются в костях скелета. Радиофармпрепарат вводится внутривенно и затем излучение от накопившегося препарата улавливается детекторами регистрирующего прибора (гамма-камеры).
Показания к исследованию
- Подозрение на метастатическое поражение костей скелета
- Оценка результатов химиотерапии, гормональной или лучевой терапии
- Воспалительные заболевания костей и суставов
- Определение нестабильности компонентов протезов, воспалительных изменений в костях при протезировании суставов и позвоночника
- Травматические переломы костей скелета, в том числе стресс-переломы
- Метаболические заболевания костей
Что и как показывает сцинтиграфия костей скелета
С помощью сцинтиграфического обследования врачи выявляют различные патологии, недоступные другим диагностическим методам:
- Причины необъяснимой боли в кости
- Скрытый перелом, который не виден на рентгеновском снимке
- Остеомиелит
- Рак костей
- Метастазирование в костях при раке других органов.
Данный метод позволяет выявлять динамику лечения при онкологии, подтверждать его эффективность или свидетельствовать о смене назначений.

Диагностику заболеваний костей скелета проводят с меченными фосфатными комплексами, которые прочно связываются с кристаллами гидроксиапатита и незрелым коллагеном. В качестве метки используется 99мТс, который имеет короткий период полураспада – всего 6 ч. Гамма-кванты покидают организм и регистрируются детекторами прибора, в результате после компьютерной обработки получается изображение.
Метастазы различных опухолей в кости
Многие опухоли метастазируют в кости. В первую очередь подозрение на метастатическое поражение скелета возникает при раке молочной и предстательной желез, раке легкого и почек. Особую настороженность следует проявлять при увеличении уровня онкомаркеров ПСА (простатспецифический антиген), СА 15-3 и некоторых других. После консервативного лечения или хирургического удаления опухоли рекомендуется динамическое наблюдение за состоянием костной ткани. Сцинтиграфию следует проводить первые 2 раза с промежутком 6-8 месяцев, затем, при нормальном результате исследования - через 1–2 года.
Воспалительные и травматические изменений костной ткани
Метод позволяет определить распространенность процесса, выявив очаги воспаления в костях и суставах во всем скелете даже на ранних стадиях заболевания. На рентгенограммах при остеомиелитах обычно определяется меньшая распространенность, чем есть на самом деле. Сцинтиграфия показывает истинные размеры воспалительного очага.
С помощью этого метода также можно выявлять переломы и оценивать, насколько хорошо происходит их заживление.
Часто переломы костей являются случайной находкой, как например переломы ребер у пациентов с распространенным остеопорозом. В ряде случаев удается выявить нарушение целостности костей на ранних стадиях, когда рентгенологическое исследование не позволяет этого сделать (переломы ладьевидной кости, ребер).
Остеосцинтиграфия в ортопедии и вертебрологии
При протезировании суставов или установке металлоконструкций в позвоночник сцинтиграфия костей скелета позволяет достоверно выявить:
- механическую нестабильность компонентов протеза (расшатывание)
- воспалительный процесс вокруг протеза или металлоконструкции
- интенсивность протекания воспалительного процесса в различных участках кости.
Дополнительное проведение ОФЭКТ/КТ с возможностью посрезового анализа изображения, позволяет более точно локализовать область повреждения, что дает возможность своевременно провести необходимое лечение.
Преимущества ОФЭКТ/КТ по сравнению с планарной сцинтиграфией: отсутствие суммации (посрезовый анализ накопления радиофармпрепарата) и точная локализация благодаря совмещению радионуклидного и КТ-изображений.

Вредна ли сцинтиграфия костей скелета?
Во время обследования пациент получает минимальную дозу облучения. Говоря о том, как часто можно делать сцинтиграфию, большинство специалистов сходятся во мнении – хоть каждый месяц. Абсолютным противопоказанием к проведению является беременность пациентки. Грудное вскармливание необходимо прервать на 48 часов от момента введения препарата.
Особенности проведения сцинтиграфии костей
Внутривенно пациенту вводится радиофармпрепарат. Затем в течение часа необходимо выпить 1 литр питьевой воды для улучшения накопления препарата в костях скелета и снижения лучевой нагрузки. Непосредственно перед исследованием - опорожнить мочевой пузырь.
Исследование начинается через 3 часа после введения препарата. Пациент ложится на кушетку гамма-камеры, которая радиоактивными лучами просвечивает организм человека, выявляя радиофармпрепарат в костях и суставах.
Заключение выдает опытный врач-радиолог в день исследования.
Сразу после диагностики пациент может вернуться к привычному образу жизни. В первые сутки желательно увеличить употребления жидкости.
Специальная подготовка к сцинтиграфии костей скелета не требуется.
Сцинтиграфия костей скелета в ЦКБ РАН
Исследование проводится на современном томографе для однофотонной компьютерной томографии совмещенной с рентгеновской компьютерной томографией ОФЭК/КТ General Electric Infinia Hawkeye 4.
При подготовке заключения используется метод «двойного прочтения»: результаты оцениваются двумя врачами-радиологами. При необходимости возможен сбор врачебной комиссии с привлечением сотрудников кафедры лучевой диагностики и терапии РНИМУ им. Н.И. Пирогова.
Болезнь Альбека: асептический некроз костей
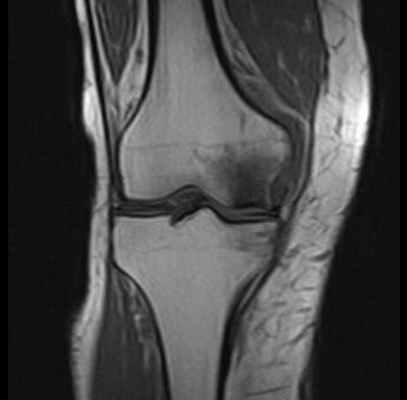
МРТ при некрозе костей колена. Нормальная ширина суставной щели, суставный хрящ ещё не поврежден. Отчетливое изображение некроза внутреннего мыщелка бедренной кости. © Prof. Dr. med. Sven Ostermeier
При недостаточном кровоснабжении костей погибают отдельные костные клетки. Таким образом некроз кости (Болезнь Альбека) означает потерю костного вещества в коленном суставе. Другими словами, остеонекроз — это отмирание костных структур.
Существуют несколько разновидностей остеонекроза. Если патология появляется в колене, то у Вас Болезнь Альбека. Асептический некроз может появиться и в тазобедренном суставе. В таком случае заболевание называется асептический некроз головки бедренной кости.
У многих пациентов ослабление кости проходит без симптомов, а у некоторых приводит к сильным повреждениям коленного сустава. Женщины болеют Болезнью Альбека в три раза чаща чем мужчины. Только в отдельных случаях удается установить однозначную причину заболевания.
Терминология:
- аваскулярный остеонекроз - при нарушениях кровообращения
- асептических остеонекроз - Болезнь Альбека. Отсутствие бактериальной инфекции. Встречается у пациентов среднего возраста в области мыщелка бедренной кости.
- костный инфаркт = костный некроз, отмирание костей
- рассекающий остеохондроз - недостаточное кровоснабжение близких к суставу костных элементов. На прогрессирующей стадии кальциноз тканей.
- Болезнь Осгуд-Шлаттера - остеонекроз большеберцовой кости коленного сустава. Встречается чаща всего у молодых пациентов.
Если Болезнь Альбека протекает тяжело, то у пациента может развиться артроз коленного сустава. Специалисты Геленк Клиники по лечению заболеваний коленного сустава наблюдали разные исходы заболевания - от внезапного излечения до артроза с последующим эндопротезированием.
Кто страдает Болезнью Альбека?
В большинстве случаев причину Болезни Альбека установить невозможно. В более молодом возрасте (от 10 до 20 лет) поврежден может оказаться и суставный хрящ (Болезнь Кёнига). Однако начиная примерно с 40 лет может развиться асептический некроз кости. Возможен различный ход заболевания: от легкой потери костной ткани с незначительными травмами суставного хряща до тяжелого артроза коленного сустава.
Причинами Болезни Альбека могут быть:
- посттравматический остеонекроз - после тяжёлых аварий или силовых воздействий
- септический остеонекроз - после бактериальных инфекций в колене
- гемофилия - нарушение свёртываемости крови может привести как к артрозу так и к некрозу костей
- алкоголь - злоупотребление алкоголем приводит к инфаркту костей
- кессонная болезнь (ДКБ) - чаще у профессиональных водолазов
- бифосфонаты - выписываются для поддержки минерализации костей, напр. при лечении остеопороза. Болезнь Альбека может быть побочным эффектом.
- переломы костей
- лишний вес
- серповидно-клеточная анемия
- нарушения свёртываемости крови
- иммуносупрессивное лечение после трансплантации почек
Механизмы возникновения Болезни Альбека, а также обстоятельства, приводящие к продолжению хронических заболеваний еще не изучены в полном объеме. Поэтому еще не существует общего метода лечения - врачи могут дать только рекомендации. Успех этих методик зависит от обстановки, хода болезни и возраста пациента.
Симптомы остеонекроза (Болезнь Альбека)
- внезапная боль в колене ночью, болезненность при нагрузках
- локализация боли с внутренней или наружной стороны колена
- отечность
- ограниченный диапазон движений
Обращайте внимание на симптомы. Чем раньше диагностируют некроз костных структур в коленном суставе, тем выше успех лечения. Одним из важных сигналов Болезни Альбека является спонтанная боль в колене, причиной которой стало дорожное происшествие или спортивная травма. При более тщательном обследовании выясняется, что боль в коленях появилась по причине скопления жидкости в суставе.
Типичный ход заболевания (Болезнь Альбека)
Как протекает Болезнь Альбека?
- 1-ая стадия: на этом этапе возникают самые сильные боли, которые могут продолжаться от 6 до 8 недель. Рентген без изменений, МРТ или сцинтиграфия костей скелета могут доказать наличие некроза.
Лечение: снижение нагрузки, радиоволновая терапия, кислородная терапия - 2-ая стадия: после нескольких месяцев рентген показывает первые признаки некроза костей. Костные фрагменты пораженные некрозом осветлены.
Лечение: снижение нагрузки, болевая терапия, радиоволновая или кислородная терапия - 3-яя стадия: чёткое изображение некроза костей на рентгене. Появляются первые деформации суставного хряща.
Лечение: хирургия (разгрузочное сверление, трансплантация губчатой кости) - 4-ая стадия: начало разрушения кости, видны повреждения хряща, начинается артроз
Лечение: трансплантация костных структур и суставного хряща, эндопротезирование
Консервативное лечение Болезни Альбека
Во многих случаях врачам Геленк Клинки в Германии удается вылечить Болезнь Альбека консервативными методами. Помочь может такое лечение как радиоволновая терапия, кислородная терапия, а также снятие нагрузок с колена. Если Вы хотите, чтоб Ваши кости были здоровые, обратите внимание на своё питание и двигательную активность. При прогрессирующем некрозе костей частичное эндопротезирование может проводиться и в молодом возрасте. Если для сохранения функций сустава понадобиться хирургическое вмешательство хирурги Геленк Клиники сделают всё возможное, чтобы восстановить костные структуры.
Консервативное лечение Болезни Альбека
- приём болеутоляющих препаратов
- остановка развития воспалительного процесса
- терапия бисфосфонатами
- специальная ортопедическая обувь
- ортезы
- радиоволновая терапия
- гипербарическая оксигенация (ГБО) – лечение кислородом в барокамере
Специалисты по лечению коленного сустава Геленк Клиники выбирают из нескольких методик хирургического лечения Болезни Альбека. Для составления индивидуального плана лечения необходимо определить стадию заболевания. Почти все методики направлены на увеличение витальности и способности к регенерации некротической костной ткани.
Хирургическое лечение остеонекроза коленного сустава (Болезнь Альбека)
Хирургические методы лечения Болезни Альбека направлены на начало восстанавливающих процессов в коленном суставе, которые поспособствуют регенерации костной ткани. Согласно основному правилу, все нижеописанные суставосохраняющие вмешательства рекомендуется проводить до третьей стадии Болезни Альбека. На четвёртой стадии сложно найти живые клетки в кости, которые поддаются реактивации. На четвёртой стадии необходимо эндопротезирование.
- снятие нагрузки с колена путем коррекции оси нижних конечностей: остеотомия коленного сустава
- лечение суставного хряща: высверливание по технике Приди (микрохирургическая техника устранения дефектов хряща) и трансплантация
- декомпрессия медуллярной полости
- спонгиопластика (взятие аутотрансплантата губчатой кости)
- эндопротезирование
Диагностика остеонекроза коленного сустава
Диагностика Болезни Альбека проводится путем исключения других возможных заболеваний коленного сустава, которые связаны с похожими жалобами. Рассказ пациента о своём состоянии здоровья является главным индикатором болезни. Во время обследования врач задаёт вопросы касательно хода заболевания, а также имеющихся повреждений. Наличие дорожных происшествий так же имеет немаловажное значение для постановки диагноза.

Диагностика заболевнаий коленного сустава.© Gelenk-Klinik / Prof. Dr. Sven Ostermeier
Рентген проводится в любом случае. Однако видимые изменения в суставе можно установить лишь на прогрессирующей стадии болезни. Одним из главных сигналов Болезни Альбека на рентгенограмме является склерозирование - болезненное уплотнение костной ткани, которое возникает посредством перенагрузки коленного сустава.
На ранней стадии Болезнь Альбека можно диагностировать при помощи магнитно-резонансной томографии МРТ, которая показывает характерную, болезненную отечность. Измерение плотности костей необходимо для исключения остеопороза всей костной системы человека.
По любым вопросам касательно заболеваний коленного и Болезни Альбека сустава обращайтесь в Геленк Клинику в Германии. Д-р Остермаер, д-р Марквас, д-р Ринио, а также другие специалисты нашего центра являются врачами вышей категории и смогут предложить Вам высококлассное лечение Болезни Альбека по доступным ценам.
Рентгенограмма, МРТ при инфаркте кости
а) Терминология:
1. Синонимы:
• Остеонекроз, аваскулярный некроз, асептический некроз:
о Термины взаимозаменяемы и все относятся к некрозу кости
о Термин «инфаркт кости» принято применять к очагу, расположенному не субхондрально
2. Определение:
• Гибель костной ткани и костного мозга, вторично вследствие потери кровоснабжения
б) Визуализация:
1. Общая характеристика:
• Лучший диагностический критерий:
о Классический не осложненный инфаркт:
- Серпигинозный или бесформенный склероз на рентгено-граммех
- Признак двойной линии на МРТ
о Широкий ряд других визуализационных признаков, зависящих от процесса заживления и стадии инфаркта
• Локализация:
о Трубчатые кости, зоны метафиза и диафиза
о Реже в плоских костях
(Слева) Рентгенография в боковой проекции: патологические изменения метадиафизарной области, включающие усиленный склероз и очаги точечной кальцификации. Можно предположить э нхондрому или костный инфаркт.
(Справа) Фронтальная Т1 МР-И, этот же случай: серпигинозный В очаг инфаркта кости с низким сигналом, с желтым костным мозгом в центре, точечными очагами низкого сигнала, что соответствует данным рентгенографии. Данные визуализации соответствуют диагнозу инфаркта кости. (Слева) Фронтальная Т2 FS МР-И, этот же случай: серпигинозное кольцо высокого сигнала; низкий сигнал, окружающий высокий сигнал плохо определяется, вследствие насыщения сигнала от жира. Однако он присутствует и это говорит о наличии признака двойной линии, характерного для инфаркта кости.
(Справа) Рентгенография в ПЗ проекции: литическое образование в диафизе бедренной костив. Нет склеротического края и дистрофического обызвествления. В то время, как эти признаки могут представлять собой внутрикостную липому, биопсия подтвердила наличие инфаркта кости. Полностью литическое образование - нехарактерная картина для инфаркта. (Слева) Рентгенография в ПЗ проекции: у пациента с серповидноклеточной анемией наблюдаются диффузные неоднородные участки повышения и понижения интенсивности. Хотя диагностика инфарктов костной ткани нередко основана на наличии серпигинозной кальцификации, они часто представлены как диффузный неоднородный склероз.
(Справа) Сагиттальное Т2ВИ FS МР-И: типичный очаг множественных инфарктов кости с признаком двойной линии. У этого пациента пятнистая лихорадка Скалистых гор, которая может привести к некротизирующему васкулиту, что в свою очередь вызовет инфаркт костной ткани.
2. Рентгенография при инфаркте кости:
• Широкий ряд других визуализационных признаков, зависящих от заживления или дегенерации:
о Первоначальная картина нормальная
о При ранней стадии инфаркта костей пальцев может визуализироваться периостит
о Со временем возможно развитие патологического усиления в различных очагах:
- Очаговый или диффузный склероз
- Серпигинозное дистрофическое обызвествление
о Кистозная дегенерация: нехарактерна:
- Умеренное распространение на вовлеченный участок кости
- Кисты могут приводить к развитию тонкого, склеротического кольца
о Редко развивается саркоматозная дегенерация:
- Изменения от характерных для доброкачественного образования, до признаков высоко агрессивного литического образования с разрушением кортикального слоя и распространением на мягкие ткани
- Как правило, переходит в злокачественную фиброзную гистиоцитому
3. МРТ при инфаркте кости:
• Не осложненный инфаркт кости:
о Признак двойной линии в последовательностях чувствительных к жидкости:
- Наружное кольцо низкого сигнала, как правило, серпиги-нозного характера (демаркационная линия между живой и мертвой тканью кости)
- Внутренний край яркой линии (грануляционная ткань/вос-палительный ответ в процессе излечения)
о Внутренний сигнал различный:
- Как правило, жир (высокий сигнал в Т1 ВИ, умеренно низкий в Т2 ВИ, подавление в последовательностях с подавлением сигнала от жировой ткани)
- 2-я фаза геморрагическая и редко встречается (яркий сигнал и в Т1 ВИ, и в Т2 ВИ последовательностях)
- Следующая фаза -сигнал схожий с отеком (низкий сигнал в Т1 ВИ, высокий в Т2 ВИ)
- С фиброзом и склерозом костного мозга, сигнал низкий и в Т1 ВИ, и в Т2 ВИ последовательностях
• Дистрофическое обызвествление → низкий сигнал во всех последовательностях:
о Может быть серпигинозным или очаговым, точечным
• Кистозная дегенерация: нехарактерна:
о Снижение сигнала в Т1 ВИ
о Гетерогенный яркий сигнал в Т2 ВИ
о На постконтрастном изображении визуализируется кольцо усиления с четким контуром, окружающее низкий сигнал от жидкости
• Трансформация в саркому:
о Очаговые изменения в образовании
о Разрушение кортикального слоя и вовлечение мягких тканей
о Гиперинтенсивное в Т2, гетерогенное
о Постконтрастное усиление и очаги некроза
4. Радионуклидные исследования:
• Остеосцинтиграфия:
о «Холодный» очаг в кости на ранней стадии
о По мере излечения, захват неоднородно повышается
в) Дифференциальная диагностика инфаркта кости:
1. Отек костного мозга:
• При ранних стадиях развития инфаркта без дистрофического обызвествления или признака двойной линии
2. Процесс замещения костного мозга, диффузный или очаговый:
• При ранних стадиях развития инфаркта, без дистрофического обызвествления или признака двойной линии
(Слева) Рентгенография в ПЗ проекции: диффузный неоднородный склероз в метадиафи-зах, распространяющийся на субхондральную зону (пациент принимает стероиды). Хотя на этой рентгенограмме серпигинозные очаги не визуализируются, распространенность и интенсивность указывают на инфаркт кости.
(Справа) Рентгенография в боковой проекции, этот же пациент: умеренные диффузные патологические изменения интенсивности сигнала. (Слева) Сагиттальная Т2 FS МР-И, этот же пациент: визуализируется признак двойной линии и серпигинозный очаг, характерный для инфаркта кости. Инфаркты вовлекают субхондральный участок и метадиафизы, хотя на настоящий момент нет колапса суставной поверхности.
(Справа) Фронтальная Т1 МР-И, этот же случай: инфаркты кости, обширно поражающие обадиа-физа бедренной кости. Этиологический фактор удается установить только в трети случаев инфарктов костной ткани, среди которых частой причиной является постоянное применение стероидов. (Слева) Рентгенография в ПЗ проекции: неоднородный склероз в метафизах большеберцовой и бедренной костей. Очаги не серпигинозные, но являются одним участком патологический ин-тенсивности в очаге костного инфаркта. У этого пациента полимиозит, назначено печение стероидами.
(Справа) Рентгенография в ПЗ проекции: серпигинозная кальцификация в метадиафизах, характерная для инфаркта кости. Дистальнее визуализируется более агрессивное литическое образование, развивающееся из костного инфаркта: подтверждена злокачественная фиброзная гистиоцитома, редкое осложнение инфаркта кости.
г) Патология. Общая характеристика:
• Этиология:
о Сниженный приток крови к кости различной этиологии:
- Эмболический феномен: серповидноклеточная анемия, жировая эмболия
- Повышение давления в костном мозге: стероиды, болезнь Гоше
- Уменьшение размеров сосудов: васкулит
о У многих пациентов нет предрасполагающих факторов и инфаркт считается идиопатическим
д) Клинические особенности:
1. Проявления:
• Типичные симптомы/признаки:
о Как правило, случайная находка при рентгенографии или МРТ
о Может иметь место ноющая боль
о У пациентов с серповидноклеточной анемией может быть интенсивная боль в позвоночнике
2. Течение и прогноз:
• Многие метафизарные и диафизарные инфаркты не изменяются и не имеют последствий
• Может развиться кистозная дегенерация, также без последствий
• Редко происходит дегенерация инфаркта в саркому кости:
о Как правило, в злокачественную фиброзную гистиоцитому
о 60% в области колена
о В трети случаев удается идентифицировать этиологию инфаркта
о Выживаемость без рецидивов около 60% в течение двух лет
3. Лечение:
• Нет лечения для не осложненного инфаркта кости
Асептический некроз костей и суставов

На первой стадии болезни структура костной ткани изменена в незначительной степени, тазобедренный сустав сохраняет свои функции, боли отмечаются периодические.
Вторая стадия сопряжена с образованием трещин на поверхности головки тазобедренного сустава. Наблюдаются ограничения в подвижности и постоянные боли.
Третья стадия — вторичный артроз, в патологический процесс вовлечена вертлужная впадина. В значительной степени снижена подвижность сустава. Этой стадии характерны постоянные и сильные боли. Разрушение головки бедренной кости, постоянные боли, атрофия мышц бедра и ягодиц, минимальная подвижность тазобедренного сустава — признаки, свидетельствующие о четвертой, самой тяжелой стадии развития некроза.
Асептический некроз кости
Асептический некроз — тяжелое заболевание, вызванное нарушением структуры костной ткани, её питания и жировой дистрофии костного мозга. Причин омертвения участка костной ткани или всей кости множество. Развитие асептического некроза кости может возникнуть в результате нарушения циркуляции крови, травматических повреждений или тромбоза артерии.
Переломы, применение неквалифицированной лечебной манипуляции, длительное механическое воздействие, заболевания эндокринной системы, интоксикация алкоголем или большими дозами кортикостероидных средств, остеохондропатия, болезнь Кюммеля — могут стать предпосылками к разрушению костной ткани.
Некроз кости приводит к необратимым изменениям, снижается прочность костной ткани, и при минимальной нагрузке на пораженный участок возникает импрессия. При своевременном обращении к доктору процесс патологических изменений кости может прекратиться, и тогда возможно восстановление её структуры.
Асептический некроз головки бедренной кости
Головка бедренной кости относится к проблемным зонам, в которых часто возникает закупорка артерий, накопительные повреждения из-за перегрузок и бытовых травм, сложные травмы тазобедренного сустава (переломом головки бедренной кости). Различные патологические процессы могут привести к асептическому некрозу головки бедренной кости.
Это может быть: токсическое действие после приема гормонов и цитостатиков, антибиотиков, злоупотребление алкоголем, стрессы, врожденный вывих бедра (дисплазия), остеопения и остеопороз, системная красная волчанка, болезнь Бехтерева, ревматоидный артрит. Часто в списке причин оказываются переносимые простудные, воспалительные заболевания, сопровождающиеся замедлением циркуляции крови.
В большинстве случаев ортопедический прогноз неутешителен, наблюдается тяжелый деформирующий артроз тазобедренного сустава, при котором зачастую применяется эндопротезирование, артродез сустава или корригирующие остеотомии. Ранняя диагностика при помощи магнитно-резонансной томографии (МРТ) тазобедренного сустава позволяет вовремя выявить начало заболевания и порой даже консервативное лечение даёт отличные результаты, исключая хирургическое вмешательство.
Асептический некроз тазобедренного и коленного сустава
Тазобедренный сустав состоит из суставной (вертлужной) впадины и головки бедренной кости. Это самый крупный шарообразный сустав человека. Его кровоснабжение осуществляет единственная артерия, которая проходит через шейку бедренной кости.
В случае нарушения циркуляции крови кровоснабжение данной зоны нарушается, прекращается подача кислорода, питательных веществ, ухудшаются свойства костной ткани. Становятся невозможными восстановительные процессы, и возникает дегенеративное заболевание сустава (остеоартроз), сопровождающееся сильными болями.
В дальнейшем это приводит к асептическому некрозу тазобедренного сустава. В данном случае показана замена поврежденного сустава искусственным аналогом (эндопротезирование), способствующего полному восстановлению двигательной активности.
Появлению разрушений в коленном суставе предшествует травма и потеря кровоснабжения, в результате чего возникает асептический некроз мыщелков костей, образующих коленный сустав. Это приводит к утрате функций сочленения и инвалидности. Асептический некроз коленного сустава проявляется болями и уменьшением двигательной способности колена. Магнитно-резонансная томография и сканирование костей показывают ранние изменения в кости и позволяют предотвратить дальнейшую потерю костной массы.
Применение нестероидных противовоспалительных препаратов уменьшает боль и снимает воспаление. При показаниях хирургического вмешательства больным назначается пересадка кости в сочетании с декомпрессией (ослаблением давления в кости) или рассечение кости, которое необходимо при прогрессирующей стадии асептического некроза. Самым распространенным является метод эндопротезирования сустава, замена сустава на искусственный сустав.
Асептический некроз плечевой и таранной кости
Заболевание проявляется болью в области плечевого сустава, ограничением движений, в дальнейшем это приводит к атрофии. Изменения структуры плечевой кости довольно редкое явление. Если болезнь прогрессирует, то прибегают к хирургическому вмешательству — эндопротезирование, что является на сегодняшний день единственным способом восстановления утраченной функции верхней конечности.
Болезнь Муше таково название некроза таранной кости возникающего спонтанно и быстро прогрессирующего. Дегенерация голеностопного сустава приводит к деформирующему артрозу. Современные методы диагностики позволяет выявить изменения в голеностопном суставе на ранней стадии. В этот период развития патологии можно применить мозаичную остеохондропластику блока таранной кости и восстановить анатомию сустава.
Магнито-резонансная томография
МРТ использует магнитные поля и радиоволны для получения изображений тонких срезов тканей (томографические изображения). Как правило, при вращении протонов в тканях создаются крошечные магнитные поля, которые выстраиваются в произвольном порядке. Будучи окруженными сильным магнитным полем МР томографа, магнитные оси выстраиваются вдоль этого поля. При подаче радиоимпульса оси многих протонов на мгновение выстраиваются напротив поля в высокоэнергетическом состоянии. После подачи импульса протоны возвращаются в состояние равновесия и восстанавливают свое исходное расположение в магнитном поле МРТ устройства. Величина и скорость выделения энергии в момент, когда протоны возобновляют это выравнивание (T1 релаксация) и когда раскачиваются (прецессионное движение) во время процесса (релаксация Т2), отражаются в пространственно локализованной напряженности поля на катушке (антенне), встроенной в МРТ устройство. Компьютерные алгоритмы анализируют эти сигналы и производят детализированные анатомические изображения.
Относительная интенсивность сигнала (яркость) тканей на МРТ изображении определяется такими факторами, как:
Для получения изображения используются радиочастотный импульс и градиент сигналов
Внутренние T1 и T2 характеристики различных тканей
Протонная плотность различных тканей
Управляя радиоимпульсом и градиентом сигналов, компьютерные программы производят последовательность импульсов, которые определяют, как получено изображение (взвешенное) и как проявляются различные ткани. Изображения могут быть:
Взвешенными по протонной плотности
Например, жир выглядит ярким (сигнал высокой интенсивности) на Т1-взвешенных изображениях и относительно темным (сигнал низкой интенсивности) на Т2-взвешенных изображениях; вода и жидкости проявляются относительно темными на T1-взвешенных изображениях и яркими на Т2-взвешенных изображениях. T1-взвешенные изображения оптимально показывают анатомию и жир нормальных мягких тканей (например, для подтверждения жиросодержащей массы). Т2-взвешенные изображения оптимально показывают жидкости и аномалии (например, опухоли, воспаления, травмы). На практике, Т1- и Т2-взвешенные изображения дают дополнительную информацию, так что они оба важны для описания нарушений.
Недавно введенные в практику МРТ сканеры высокого разрешения повышают качество изображения и точность диагностики и производить широкий спектр дополнительных последовательностей импульсов для дальнейшего исследования тканей и опухолей.
Использование МРТ
МРТ предпочтительнее КТ, когда необходимо очень четкое контрастное разрешение мягких тканей (например, для оценки внутричерепных или спинальных патологий, воспалений, травмы, подозреваемых опухолей опорно-двигательного аппарата или внутрисуставных нарушений). МРТ также полезна для следующих целей:
Визуализация сосудов: Магнитно-резонансная ангиография (МРА) используется для изображения артерий с хорошей диагностической точностью и является менее инвазивной, чем обычная ангиография. В качестве контрастного вещества иногда используется гадолиний. MРA можно применять для получения изображений грудной и брюшной аорты и артерий головного мозга, шеи, органов брюшной полости, почек и нижних конечностей. Визуализация вен (магнитно-резонансная венография, или МРВ) обеспечивает лучшие изображения венозных патологий, в том числе тромбоза и аномалий.
Заболевания печени и желчных протоков: Магнитно-резонансная холангиопанкреатография (MРCP) особенно ценна в качестве неинвазивного, высокоточного способа визуализации поджелудочной железы и желчных протоков.
Объемные образования в женских половых органах: МРТ дополняет УЗИ, используемое для дальнейшей характеристики объемных образований в придатках и определения стадии опухоли матки. Некоторые переломы:
Переломы: Например, МРТ может дать точное изображение переломов костей тазобедренного сустава у пациентов с остеопенией.
Инфильтрация костного мозга и метастазы в кости
МРТ также может заменить применение КТ с использованием контрастных веществ у пациентов с высоким риском реакции на йодированные рентгеноконтрастные вещества.
Контрастное вещество
В MРТ рентгеноконтрастные вещества часто используются для выделения сосудистых структур и помощи в оценке воспаления и опухолей.
Наиболее часто используемыми веществами являются производные гадолиния, обладающие магнитными свойствами, которые влияют на время релаксации протонов. МРТ внутрисуставных структур может включать инъекции растворимой производной гадолиния в сустав.
Вариации МРТ
Диффузионная (диффузно-взвешенная) МРТ
Интенсивность сигнала связана с диффузией молекул воды в ткани. Этот тип МРТ может использоваться
Для обнаружения ранней церебральной ишемии и инфаркта миокарда,
Для обнаружения болезни белого вещества мозга
Дифференцировать абсцесс от кистозной опухоли
Для определения различных опухолей, таких как немелкоклеточной рак легких
Многокадровая эхо-планарная визуализация
Этот сверхбыстрый метод (изображения получаются в течение чуть меньше 1 секунды) используется для передачи диффузионной, перфузионной и функциональной визуализации мозга и сердца. Его потенциальные преимущества включают отображение мозговой и сердечной активности и уменьшение артефактов движения. Однако его применение ограничено, поскольку он требует применения специальных технических средств и является более чувствительным к различным артефактам по сравнению с обычными МРТ.
Функциональная МРТ
Функциональная МРТ применяется для оценки активности мозга по месту расположения.
В наиболее распространенных типах мозг сканируется при низком разрешении очень часто (например, каждые 2–3 секунды). Изменение уровня оксигенированного гемоглобина можно выделить и использовать для оценки метаболической активности отдельных отделов головного мозга.
Исследователи иногда делают функциональную МРТ, а субъекты решают разные когнитивные задачи (например, решают математические уравнения); метаболически активная часть мозга, как предполагается, будет структурой наиболее задействованной в решении этой конкретной задачи. Корреляция функции и анатомии головного мозга таким образом называется картированием головного мозга.
Функциональную МРТ можно использовать как в научных исследованиях, так и в клинических условиях. Она особенно клинически информативна при картировании моторных или речевых кортикальных областей (т.е. кортикальных областей, которые при их удалении приводят к нарушениям сенсорных, двигательных функций или процессов речевой обработки) у пациентов с внутричерепными аномалиями, такими как опухоли и артериовенозные мальформации, для которых планируется хирургическое вмешательство. Все чаще он используется для планирования хирургического лечения эпилепсии.
Визуализация с градиентным эхо
Градиентное эхо представляет собой последовательность импульсов, которую можно использовать для быстрого изображения движущейся крови и спинномозговой жидкости (например, при MРА). Так как скорость у этой техники большая, она может уменьшить артефакты движения (например, размытие) во время съемки, которая требует от пациентов задержки дыхания (например, во время съемки сердечных, легочных и брюшных структур).
Магнитно-резонансная спектроскопия (MРС)
MРС сочетает в себе информацию, полученную с помощью МРТ (главным образом, на основе содержания воды и жира в тканях) с данными ядерного магнитного резонанса (ЯМР). ЯМР предоставляет информацию о тканевых метаболитах и биохимических патологиях; эта информация может помочь дифференцировать определенные виды опухолей и других патологии.
Магнитно-резонансная энтерография
Магнитно-резонансная энтерография стала популярной, особенно для последующей визуализации детей с известными воспалительными заболеваниями тонкого кишечника.
Она имеет преимущество над КТ энтерографией, потому что магнитно-резонансная энтерография не требует ионизирующего излучения.
Перфузионная МРТ
Перфузионная МРТ является методом оценки относительного мозгового кровотока. Она может быть использован для обнаружения
Области ишемии во время визуализации инсульта
Области повышенной васкуляризации, что может свидетельствовать об опухоли
Эта информация может помочь при прямой биопсии.
ПЭТ МРТ
ПЭТ МРТ сочетает функциональную ПЭТ Позитронная эмиссионная томография (ПЭТ) Позитронно-эмиссионная томография (ПЭТ), тип радиоизотопного сканирования, использует соединения, содержащие радиоизотопы, которые распадаются, высвобождая позитрон (положительно заряженное. Прочитайте дополнительные сведенияНедостатки МРТ
МРТ является относительно дорогой, требующей большего времени для визуализации, чем КТ, процедурой и не может быть повсеместно доступной во всех областях.
Читайте также:
