Синдром Кушинга. Метирапон и кетоконазол
Обновлено: 28.04.2024
Синдром Кушинга возникает, когда организм в течение длительного времени приобретает высокий уровень кортизола. Следовательно, это также известно как гиперкортицизм. Это не одно заболевание, а группа заболеваний. Обычно синдром Кушинга возникает в результате определенных лекарств, которые приводят к повышению уровня кортизола в организме.
Какова роль кортизола в организме?
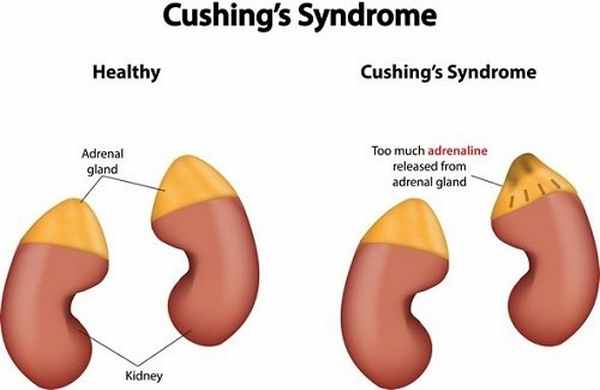
Гормон кортизол вырабатывается внешним слоем надпочечников, известным как кора. Кортизол - это стероидный гормон, который помогает в расщеплении жиров и белков. Он также помогает организму реагировать на физические и эмоциональные нагрузки, регулировать кровяное давление и управлять сердечно-сосудистой функцией. Надпочечники расположены в верхней части каждой почки.
Кортизол также известен как гормон стресса. Он выделяется надпочечниками, треугольными органами, расположенными в верхней части почек. Он играет важную роль в следующих типах процессов, происходящих в организме:
Утилизация углеводов, жиров и белков.
Регуляция артериального давления
Увеличение сахара в крови
Управление циклом сна и биологическими часами организма.
Возможные причины синдрома Кушинга
Болезнь Кушинга - Болезнь Кушинга вызывается гипофизом, который вырабатывает избыточное количество гормона АКТГ, который дает сигналы надпочечникам для выработки кортизола. Это наиболее распространенная причина эндогенного производства кортизола надпочечниками.
Наличие опухоли - Любая опухоль в надпочечниках или гиперплазия надпочечников может привести к перепроизводству кортизола. В дополнение к этому, любая опухоль в любой другой части тела, такой как поджелудочная железа, легкие или щитовидная железа, также может стимулировать выработку АКТГ.
Длительная терапия глюкокортикоидами - Синдром Кушинга также может возникнуть в результате приема глюкокортикоидных гормонов. Эти гормоны химически похожи на природный кортизол. Глюкокортикоидные гормоны включают лекарства, такие как преднизон, которые обычно назначают при астме, ревматоидном артрите, волчанке или других воспалительных заболеваниях. Такие гормоны также принимаются после пересадки органа для подавления иммунного отторжения пересаженного органа.
Кто более подвержен синдрому Кушинга?
Согласно статистике, состояние часто наблюдается у взрослых в возрасте 20-50 лет. Более того, 3 чаще встречается у женщин, чем у мужчин. Люди, которые страдают ожирением и имеют диабет типа 2, также более склонны к синдрому Кушинга. В редких случаях у человека также может быть наследственная генная мутация, такая как множественная эндокринная неоплазия типа 1 (MEN-1). MEN-1 повышает риск развития опухоли во всей эндокринной системе, включая опухоли гипофиза и надпочечников.
10 наиболее распространенные признаки и симптомы, указывающие на синдром Кушинга
Ниже приведены предупреждающие знаки, указывающие на необходимость консультации с эндокринологом.
Круглое или лунное лицо
Дополнительное накопление жира в области шеи и плеч
Визуальные изменения, такие как глаукома или катаракта
Повышенный риск заражения
Ожирение в центральном теле с более тонкими руками и ногами
Повышенная жажда и чрезмерное мочеиспускание
Розовые или фиолетовые полосы, такие как растяжки на животе, бедрах и ягодицах
Тонкая хрупкая кожа, которая легко ушибается
Гирсутизм и нерегулярные менструальные циклы у женщин
Эректильная дисфункция и снижение либидо у мужчин
Некоторые другие симптомы, связанные с синдромом Кушинга:
Повышенное кровяное давление
Повышенный уровень сахара в крови
Медленный рост у детей с синдромом Кушинга
Постепенное заживление порезов, укусов насекомых и инфекций.
Депрессия, беспокойство и раздражительность
Как диагностируется синдром Кушинга?
Если вы заметили один или несколько из вышеупомянутых признаков и симптомов, вы должны проконсультироваться с эндокринологом. Врач возьмет подробную историю болезни, в которой он / она спросит пациента о любых других заболеваниях. Нужно сообщить доктору все детали относительно любого прошлого медицинского заболевания или любой семейной истории. Затем следует медицинский осмотр, при котором врач будет искать лицо в форме луны, жировую ткань вокруг шеи или плеч и кожу с синяками или растяжками. Кроме того, проводятся некоторые лабораторные исследования, такие как,
Анализы мочи и крови - Эти тесты проводятся для измерения уровня гормонов в моче и крови. Моча собирается за 24 часов до теста.
Тест на слюну - Обычно уровень кортизола значительно снижается к вечеру. Следовательно, образцы слюны проверяются поздно ночью. Если уровень кортизола слишком высок, это указывает на положительный результат для синдрома Кушинга.
Тест подавления дексаметазона - Пациента просят принять низкую дозу стероидной пилюли в час дня 11, а утром взять образец крови для измерения количества кортизола, вырабатываемого организмом. Этот тест также отличает синдром Кушинга от синдрома Псевдо-Кушинга.
Радио-визуальные тесты - Такие тесты, как компьютерная томография или МРТ, помогают получить изображения гипофиза и надпочечников для выявления патологий, таких как опухоли.
Выборка из пазухи пазухи - Этот тест проводится в случаях эндогенного синдрома Кушинга, чтобы узнать, является ли источник гипофизом или надпочечником. Образцы крови взяты из пазухи носа, которые дренируют гипофиз.
Узкая трубка вводится через верхнюю часть бедра после седации. Уровни АКТГ измеряются от пазухи. Если уровни в пазухе высокого уровня, источник находится в гипофизе, и если уровни АКТГ между синусом и предплечьем, источник находится вне гипофиза.
Решение
Целью лечения является снижение повышенного уровня кортизола. лучшие эндокринологи в Индии предложили следующие варианты лечения пациента с синдромом Кушинга.
Снижение использования кортикостероидов - В случаях, когда причиной является длительное применение кортикостероидных препаратов, врач может попросить вас уменьшить дозировку, а иногда и заменить ее некортикостероидными препаратами. Кортикостероидные препараты постепенно снижаются, а не прекращаются внезапно.
Хирургия - Хирургия - это выбор лечения, когда причиной является опухоль. Опухоль, присутствующая в гипофизе, удалена нейрохирургом. Процедура проводится через нос. Если опухоль присутствует в надпочечнике, легких или поджелудочной железе, стандартные методы могут сопровождаться минимальной инвазией с использованием небольших разрезов. Пациентам дают лекарства замены кортизола, чтобы обеспечить правильное количество кортизола. Весь процесс может занять до года или дольше.
Радиационная терапия - Это также используется в случаях опухолей в дополнение к хирургическому удалению. Радиация дается в малых дозах в течение 6 недель. Это известно как стереотаксическая радиохирургия.
Лекарства - Наркотики, такие как кетоконазол, митотан и метирапон, используются для контроля выработки кортизола надпочечниками. Кроме того, мифепристон используется для тех, у кого в анамнезе был диабет типа 2 или непереносимость глюкозы.

Имя автора
Доктор Каврин Арора
Дата публикации
: 27-Mar-2019
Доктор Каврин Арора
Доктор Каврин изучала медицину и несколько лет активно практиковала, прежде чем решила поделиться своими знаниями через медицинские блоги и статьи. С тех пор доктор Каврин написал несколько статей о последних достижениях в области лечения различных заболеваний, ожидаемой продолжительности жизни, а также о лучших больницах и врачах по всей стране.
Она увлеченный наблюдатель и любит быть в курсе новых технологий. Она заядлый читатель и серьезный писатель в области медицины.
Синдром Кушинга. Метирапон и кетоконазол
Синдром Кушинга. Метирапон и кетоконазол
Синдром Кушинга — результат избытка глюкокортикостероидов. Роль глюкокортикостероидов проявляется наиболее наглядно при сильном стрессе, но кортизол вырабатывается в биологически активном количестве также и в нестрессовых условиях. Выброс и синтез кортизола соответствует дневному ритму, увеличиваясь в предрассветные часы из-за активации системы ГГН. Таким образом, выработка кортизола максимальна рано утром, а к ночному периоду она может уменьшиться до очень низкого уровня.
Избыточный уровень глюкокортикостероидов приводит к развитию синдрома Кушинга, характеризующегося мышечной слабостью, перераспределением отложения жира в подкожной клетчатке, луновидным лицом, пурпурными стриями на коже брюшной стенки, атрофией кожи, ломкостью капилляров, гипертензией, непереносимостью глюкозы и психоневрологическими нарушениями. Синдром Кушинга развивается на фоне множества причин, но обычно он возникает из-за АСТН-синтезирующей аденомы гипофиза (синдром Кушинга), кортизол-вырабатывающей опухоли надпочечников или атопического синтеза АСТН в других новообразованиях (например, нейроэндокринными опухолями легких и кишечника).
Основное лечение синдрома Кушинга — хирургическое удаление гормонсинтезирующей опухоли. Если хирургическое вмешательство не эффективно, для коррекции избытка глюкокортикостероидов применяют лекарственную терапию. Самые эффективные препараты — ингибиторы надпочечникового синтеза глюкокортикостероидов (кетоконазол, метирапон, аминоглутетимид и митотан). Лекарств, уменьшающих выработку АСТН аденомой гипофиза, не существует, а эффективность антагониста глюкокортикостероидных рецепторов мифепристона при хроническом синдроме Кушинга не подтверждена.
Ингибиторы биосинтеза стероидов действуют на различные этапы синтеза кортизола, поэтому для них характерно сопутствующее влияние на другие стероиды надпочечников.

Метирапон. Этот препарат в основном подавляет терминальный этап синтеза кортизола (11-гидроксилирование), приводя к увеличению содержания его предшественника 11-деоксикортизола. Накопление таких предшественников, как 17-гидроксипрогестерон, может привести к увеличению синтеза андрогенов надпочечниками (как и стероидов) и гирсутизму у женщин. Метирапон влияет на синтез альдостерона, однако предшественник кортизола 11-деоксикортизол обладает минералокортикостероидной активностью, что может привести к задержке электролитов и гипертензии.
Кетоконазол, антимикотическое производное имидазола, и аминоглутетимид, противоэпилептический препарат, подавляют различные этапы стероидогенеза, включая точку входа разветвления боковой цепи холестерина, а также другие важные этапы биосинтеза кортизола и андрогена. Механизм действия кетоконазола при лечении избытка глюкокортикостероидов состоит в подавлении активности ферментов цитохрома Р-450, вовлеченного в биосинтез стероидов, ингибирующих биосинтеза эргостероида в мембранах грибов, что обусловливает антимикотический эффект препарата.
Побочные эффекты метирапона, кетоконазола. Все ферменты, участвующие в биосинтезе стероидов, подавляемом кетоконазолом, аминоглутетимидом и метирапо-ном, принадлежат к большому семейству ферментов цитохрома Р-450, которые катализируют реакцию монооксигенации. Ферменты цитохрома Р-450 вовлечены во многие биосинтетические реакции лекарственного метаболизма, что обусловливает некоторые побочные эффекты препаратов. Поскольку выработка стероидов ограничена и многие участки выработки энзимов ингибированы, биологически активные молекулы предшественников стероидов не накапливаются. Однако эти препараты подавляют также синтез половых стероидов, что может привести к атрофии половой системы у мужчин.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Синдром Кушинга

Синдром Кушинга – это сочетание клинических симптомов, вызванных хроническим повышением уровня кортизола или родственных ему кортикостероидов в крови. Болезнь Кушинга – это синдром Кушинга, причиной которого служит избыточная гипофизарная продукция адренокортикотропного гормона (АКТГ), как правило, обусловленная аденомой гипофиза. Типичные симптомы и признаки включают лунообразное лицо и центральный типожирения, тонкие конечности и легко образующиеся синяки. Диагноз устанавливают на основании анамнестических данных о применении кортикостероидов или повышенного уровня и/или относительно автономного кортизола в сыворотке. Лечение зависит от этиологии заболевания.
Этиология синдрома Кушинга
Гиперфункция коры надпочечников бывает как зависимой от адренокортикотропного гомона (АКТГ-зависимой), так и АКТГ-независимой.
Причиной АКТГ-зависимого гиперкортицизма может быть:
Гиперсекреция АКТГ гипофизом (болезнь Кушинга)
Секреция АКТГ негипофизарной опухолью, такой как мелкоклеточный рак легкого Классификация Рак легких является основной причиной смерти от рака во всем мире. В 85% случаев причиной заболевания становится курение. К симптомам рака легкого относится кашель, дискомфорт или боль в грудной. Прочитайте дополнительные сведенияВведение экзогенного АКТГ
АКТГ-независимая гиперфункция обычно появляется из-за
Терапевтическое применение кортикостероидов
Надпочечниковые аденомы или карциномы
Редкие причины АКТГ-независимой гиперфункции включают первичную пигментированную узловую дисплазию надпочечников (обычно у подростков) и двустороннюю макронодулярную гиперплазию (у пожилых пациентов).
Симптомы и признаки синдрома Кушинга
Клинические проявления синдрома Кушинга включают:
Лунообразное лицо с плеторической внешностью
Центральный тип ожирения с видными надключичным и надшейными скоплениями жировой ткани (бычий горб)
Обычно очень тонкие конечности и пальцы

На этой фотографии изображен пациент с лунообразным лицом, характерным для синдрома Кушинга.
© Springer Science+Business Media

Этот пациент с синдромом Кушинга имеет характерный бычий горб и красные стрии.
© Springer Science+Business Media
Пурпурные линейные растяжки (стрии) видны на животе данного пациента с синдромом Кушинга.
SCIENCE PHOTO LIBRARY
У данного пациента с синдромом Кушинга наблюдаются следующие признаки: округление лица, большие щеки, надключичные жировые отложения и стрии.
с разрешения издателя. Из Biller B. В Atlas of Clinical Endocrinology: Neuroendocrinology and Pituitary Disease . Edited by SG Korenman (series editor) and ME Molitch. Philadelphia, Current Medicine, 2000.
Характерна атрофия мышц и слабость. Кожа атрофирована, раны заживают плохо и легко образуются кровоподтеки. На животе можно обнаружить багровые стрии. Часто отмечаются артериальная гипертония, нефрокалькулез, остеопороз, нарушение толерантности к глюкозе, снижение сопротивляемости инфекциям, а также психические отклонения. Дети обычно отстают в росте.
У женщин возможны нарушения менструального цикла. Повышенная продукция андрогенов опухолями надпочечников может приводить у женщин к гирсутизму, височному облысению и другим проявлениям вирилизации.
Диагностика синдрома Кушинга
Определение уровня свободного кортизола в моче
Супрессивный тест с дексаметазоном
Уровни кортизола в сыворотке или в слюне в середине ночи
Определение уровня АКТГ плазмы; если он поддается определению – проведение провокационной пробы
Диагноз обычно предполагают на основании характерных симптомов и признаков. Подтверждение диагноза (и выяснение причины), как правило, требует гормональных исследований и применения визуализирующих методов.
Определение уровня свободного кортизола в моче
В некоторых центрах исследование начинается с 24-часового измерения свободного кортизола в моче, которое повышено > 120 мк /24 часа ( > 331 нмоль/24 ч) почти у всех пациентов с синдромом Кушинга. У многих пациентов с уровнем свободного кортизола суточной мочи между 100 и 150 мкг/24 часа (276 и 414 нмоль/24 часа) имеется ожирение, депрессия или синдром поликистозных яичников, но не синдром Кушинга. Пределы нормы могут варьироваться в зависимости от анализа.
У пациента с подозрением на синдром Кушинга с сильно повышенным уровнем свободного кортизола в моче (в 4 раза > верхней границы нормы) данный диагноз почти наверняка подтвердится. Два-три нормальных показателя исключают диагноз. Несколько повышенные уровни, как правило требуют дальнейшего иccледования, как и в случае нормальных уровней, если при этом, согласно клиническим данным, высока вероятность заболевания.
Определяют также утренний базальный уровень кортизола в сыворотке крови (например, в 9 часов утра).
Супрессивный тест с дексаметазоном
Альтернативный подход к исследованию заключается в супрессивном тесте с дексаметазоном, при котором назначается 1, 1,5 или 2 мг дексаметазона перорально с 11 до 12 часов вечера, а уровень кортизола в сыворотке крови измеряется на следующий день с 8 до 9 часов утра. У большинства здоровых лиц его уровень составляет < 1,8 мкг/дл ( < 50 нмоль/дл), тогда как при синдроме Кушинга этот показатель практически всегда выше. Более специфичным и равно чувствительным является тест с приемом 0,5 мг перорально дексаметазона каждые 6 часов в течение 2 дней (низкодозовый тест). Отсутствие снижения уровня кортизола в следствие введения небольших доз дексаметазона , как правило, подтверждает диагноз, если нет оснований подозревать аномальную абсорбцию или метаболизм дексаметазона.
Определение уровня кортизола в ночное время
При неоднозначных результатах теста для определения свободного кортизола в суточной моче и теста на подавление дексаметазона , пациента госпитализируют для определения уровня кортизола в сыворотке ночью, что дает больше оснований для определенного вывода. Можно также собирать пробы слюны для определения кортизола, сохраняя их дома в холодильнике. В норме уровень кортизола в сыворотке в ранние утренние часы (6.00–8.00) колеблется от 5 до 25 мкг/дл (138–690 нмоль/л), а к середине ночи постепенно снижается до < 1,8 мкг/дл ( < 50 нмоль/л). При синдроме Кушинга содержание сывороточного кортизола в утренние часы иногда остается нормальным, но отсутствует обычное снижение его продукции в течение суток, так что в середине ночи концентрация кортизола в сыворотке превышает норму и его общая суточная продукция может быть повышена.
Ложная трактовка возможна при обнаружении повышенного уровня кортизола в сыворотке крови у пациентов с врожденно увеличенным содержанием кортикостероид-связывающего глобулина или у получающих эстрогены , но в этих случаях суточные изменения уровня кортизола остаются в пределах нормы.
Определение уровня АКТГ в плазме крови
Для выяснения причины синдрома Кушинга определяют уровень АКТГ. Если он остается неопределимым, как в базальных условиях, так и особенно после введения кортикотропин -рилизинг гормона (КРГ), то это указывает на первичное поражение надпочечников. Высокий уровень АКТГ свидетельствует о гипофизарной причине или эктопическом начале. Если уровень АКТГ поддается определению, то с помощью провокационных проб можно отличить болезнь Кушинга от более редкого эктопического АКТГ-синдрома. В большинстве случаев болезни Кушинга введение большой дозы дексаметазона (2 мг перорально каждые 6 часов в течение 48 часов) снижает утренний (9:00) уровень кортизола > 50%, тогда как при эктопическом АКТГ-синдроме столь значительное снижение наблюдается редко. Наоборот, у большинства пациентов с болезнью Кушинга в ответ на введение человеческого или овечьего КРГ (внутривенно 100 мкг или 1 мкг/кг) уровень АКТГ возрастает на > 50%, а содержание кортизола – на 20%, тогда как при эктопическом АКТГ-синдроме такая реакция наблюдается очень редко (см. таблицу Диагностическое обследование при синдроме Кушинга Диагностическое обследование при синдроме Кушинга ).
Альтернативный способ выяснения локализации причины повышенного уровня АКТГ (более точный, но и более инвазивный) заключается в катетеризации обеих каменистых вен (по которым идет отток крови от гипофиза) с определением уровня АКТГ в пробах из этих вен, полученных через 5 минут после болюсного введения КРГ в дозе 100 мкг или 1 мкг/кг (человеческого или овечьего). Отношение уровня АКТГ в крови синусов к его уровню в периферической крови > 3 практически исключает диагноз эктопического АКТГ-синдрома; отношение < 3 требует продолжения поисков источника гиперсекреции АКТГ.
Визуализация
Если уровень АКТГ и провокационные тесты указывают на гипофизарную причину гиперкортицизма, применяют методы визуализации гипофиза; самые точные результаты дает МРТ с контрастным усилением, но некоторые микроаденомы визуализируются и с помощью КТ. Если же результаты обследования предполагают причину негипофизарного происхождения, используют КТ с высоким разрешением для исследования грудной клетки, области поджелудочной железы и надпочечников, сцинтиграфическое исследование или ПЭТ-сканирование с радиоактивным октреотидом или, желательно, с галлием-68, а иногда и ПЭТ-сканирование с фтордезоксиглюкозой (ФДГ-ПЭТ-сканирование). Может потребоваться отбор проб из каменистого синуса для дифференциации гипофизарной продукции АКТГ от эктопической.
У детей с болезнью Кушинга опухоли гипофиза крайне малы и не визуализируются при МРТ. В этой ситуации особенно полезным оказывается забор проб крови из каменистых синусов. У беременных женщин во избежание облучения плода вместо КТ проводят МРТ.
Лечение синдрома Кушинга
Диета с большим содержанием белка и прием калийсодержащих препаратов (или калийсберегающих препаратов, таких как спиронолактон)
Ингибиторы надпочечников, такие как метирапон или кетоконазол и реже митотан
Хирургическая операция или лучевая терапия при гипофизарных, надпочечниковых или эктопических АКГТ-продуцирующих опухолях
Иногда аналоги соматостатина, дофамин агонисты или антагонист глюкокортикоидных рецепторов мифепристон
АКТГ-продуцирующие опухоли гипофиза подлежат хирургическому удалению или разрушению с помощью лучевой терапии. Если опухоль не визуализируется, но имеются веские причины считать источником избытка АКТГ именно гипофиз, предпринимают попытку тотальной гипофизэктомии, особенно у пожилых пациентов. У более молодых пациентов можно применять высокоинтенсивное облучение гипофиза с дозой 45 Гр (Грей). Однако у детей облучение гипофиза может снижать секрецию гормона роста и иногда вызывает преждевременное половое созревание. В специализированных центрах с успехом применяют однократное облучение протонным пучком, обеспечивающее поглощение гипофизом 100 Гр, или используют радиохирургию. В качестве альтернативы можно использовать протонную терапию, если она доступна. Реакция на облучение иногда проявляется через несколько лет; у детей эффект наступает быстрее.
Исследования показывают, что легкие случаи сохраняющегося или рецидивирующего заболевания поддаются терапии аналогом соматостатина – пасиреотидом. Тем не менее, гипергликемия является существенной нежелательной побочной реакцией. Иногда также можно использовать агонист дофамина каберголин. Альтернативный подход заключается в применении блокатора рецепторов кортикостероидов мифепристона. Антагонист рецептора глюкозы мифепристон увеличивает содержание кортизола в сыворотке, но блокирует эффекты кортикостероидов и может вызвать гипокалиемию.
В случаях, когда радиотерапия противопоказана, а также при отсутствии эффекта операции, облучения или исследования гипофиза (с возможной аденомэктомией) у больных с гиперкортицизмом гипофизарного происхождения производят двустороннюю адреналэктомию. После такой операции необходима пожизненная заместительная терапия кортикостероидами.
Опухоли коры надпочечников удаляют хирургически. Во время и после операции пациенту нужно вводить гидрокортизон, так как неопухолевая ткань коры за время болезни атрофируется и не функционирует. При доброкачественных аденомах можно выполнять лапароскопическую операцию. Многоузловая гиперплазия надпочечников может требовать двусторонней адреналэктомии. Даже при тотальной (предположительно) адреналэктомии у некоторых пациентов возникает функциональный рецидив.
При эктопическом АКТГ-синдроме удаляют негипофизарную опухоль, продуцирующую АКТГ. Тем не менее, в некоторых случаях, опухоль является диссеминированной и не может быть удалена. Тяжелые метаболические нарушения (например, гипокалиемия Гипокалиемия Гипокалиемия – снижение концентрации калия в сыворотке 3,5 мЭкв/л ( 3,5 ммоль/л), обусловленное уменьшением его общих запасов в организме или патологическим его перемещением в клетки. Наиболее. Прочитайте дополнительные сведения ) обычно контролируются с помощью применения ингибиторов гормонов надпочечников, таких как метирапон в дозах 500 мг перорально 3 раза в день (и больше, до максимальной суточной дозы – 6 г/день) или митотан – 0,5 г 1 раз в день (максимально 3-4 г/день). При применении митотана возникает необходимость в приеме больших доз гидрокортизона или дексаметазона, иногда делает измерение продукции кортизола ненадежным. Также может развиться гиперхолестеринемия Кетоконазол (в дозах 400-1200 мг перорально 1 раз в день) также блокирует синтез кортикостероидов, но этот препарат обладает гепатотоксичностью, и его прием может сопровождаться проявлениями аддисоновой болезни. Мифепристон также может быть полезен для лечения синдрома эктопической продукции АКТГ; однако, поскольку он блокирует действие кортизола, но не снижает его уровни в сыворотке, мониторинг его использования может быть проблемным. В экстренной ситуации парентеральное введение этомидата может вызвать быстрое снижение уровня кортизола в сыворотке, поэтому его применение требует тщательного мониторинга состояния пациента.
Иногда АКТГ-секретирующие опухоли реагируют на длительно действующие аналоги соматостатина (например, октреотид и/или другие), но их применение на протяжении > 2 лет требует тщательного клинического наблюдения за больными, поскольку могут развиться такие осложнения, как гастрит в легкой форме, желчекаменная болезнь, холангит, а также мельабсорбция.
синдром Нельсона
Синдром Нельсона обусловлен разрастанием гипофиза после двусторонней адреналэктомии, что сопровождается повышенной секрецией АКТГ и его предшественников и приводит к выраженной гиперпигментации. Этот синдром развивается почти у ( ≤ ) 50% больных, перенесших адреналэктомию. Облучение гипофиза, по-видимому, снижает риск возникновения синдрома.
Хотя облучение может приостановить продолженный рост гипофиза, многим пациенты также показана гипофизэктомия. Показания к гипофизэктомии те же, что и при любой гипофизарной опухоли: увеличение размеров со сдавлением соседних структур (нарушения полей зрения, давление на гипоталамус и другие осложнения).
После гипофизэктомии обычно проводят его облучение (если это не сделано предварительно), особенно при явном наличии опухоли. В отсутствие явной патологии лучевую терапию можно отложить. Если стандартное наружное облучение уже проводилось, используют метод радиохирургии – разовое облучение гипофиза сфокусированным пучком нейтронов (при локализации процесса в достаточном отдалении от зрительных нервов и их перекреста).
Основные положения
Основанием для диагноза обычно служит повышенный уровень кортизола в сыворотке или слюне в ночные часы или уровень свободного кортизола в суточной моче, а также результаты супрессивного теста с дексаметазоном , в которых нет подавления кортизола.
Гипофизарную причину от негипофизарной отличают по уровню адренокортикотропного гормона (АКТГ).
Для обнаружения возможной опухоли используют визуализирующие методы.
Опухоли обычно лечат хирургическим путем или лучевой терапией.
До радикального лечения можно подавить секрецию кортизола метирапоном или кетоконазолом.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Синдром Иценко-Кушинга
Это тяжелое расстройство здоровья с загадочным названием связано с выделением надпочечниками слишком большого объема гормона кортизола. Именно по этой причине пациенты с синдромом и болезнью Иценко-Кушинга напоминают «колоссов на глиняных ногах» — из-за гормонального сбоя у них образуются значительные скопления жира в теле, шее и на лице. Кроме того, больные страдают из-за атрофии мышц, в том числе и сердечной, и истончения костей, что повышает риск переломов даже в простых ситуациях. Разумеется, такие серьезные нарушения в работе организма требуют соответствующей терапии. Тем более, что отсутствие лечения приводит к развитию хронической формы патологии и к множеству опасных осложнений, представляющих реальную угрозу для жизни. Расскажем, как не пропустить первые тревожные симптомы и как лечат синдром Иценко-Кушинга.
Что представляет собой синдром Иценко-Кушинга?
Патология названа в честь двух ученых, которые в 1920-30-е годы занимались ее изучением — советского невролога Николая Иценко и американского хирурга Харви Кушинга. Нарушение возникает, когда в коре надпочечников образуется избыток гормона кортизола.
Заболевание может развиться в любом возрасте, но чаще всего это происходит в 20-40 лет. Патология может быть врожденной или приобретенной. Женщины заболевают в 10 раз чаще мужчин.
Как выделяется кортизол и зачем он нужен
Кортизол называют гормоном стресса, так как он отвечает за реакцию организма на стресс. Вырабатывается корой надпочечников при стрессовых ситуациях и помогает человеку адаптироваться к ним.
Кроме коры надпочечников, в выработке кортизола участвуют гипофиз и гипоталамус. Для того чтобы надпочечники выделяли кортизол, на них воздействует гормон АКТГ, который выделяет гипофиз. Это железа, расположенная у основания головного мозга. А выделение адренокортикотропного гормона (АКТГ) контролирует гипоталамус, выделяющий для этого свой собственный гормон кортиколиберин.
Синдром Иценко-Кушинга относят к тяжелым эндокринным патологиям. У пациентов постепенно нарушается обмен белков, углеводов, липидов (жиров). В организме происходят опасные изменения, которые приводят к инвалидности, а при отсутствии лечения возрастает риск летального исхода. В ряде случаев патология переходит в тяжелую форму всего лишь за 1-2 года. Если своевременно не обратиться за медицинской помощью, лечение проходит с трудом, многие изменения в организме становятся необратимыми. В результате качество жизни пациента значительно снижается⁶.
У людей с этим заболеванием развивается особая форма ожирения, о которой мы расскажем ниже. От этого страдает самооценка, психическое здоровье. Появляются проблемы, связанные с центральной нервной системой. Многие пациенты страдают депрессивными расстройствами, психозами, заторможены или, напротив, пребывают в состоянии эйфории.
Норма выработки кортизола
В спокойном состоянии, когда в течение дня человек не испытывает стрессов, вырабатывается 15-30 мг кортизола. Пик работы надпочечников приходится на утро и вечер. Для мужчин и женщин утренняя норма (с 6 до 8 утра) этого гормона — 101,2-535,7 наномоль на литр, вечерняя (с 20 до 21 часа) — 79,0-477,8 наномоль на литр. При стрессе объем гормона в крови резко повышается на 85 мг. При шоке его объем увеличивается до 175 мг.
Симптомы
У 90% пациентов происходит отложение жира в определенных участках тела. Оно приобретает настолько характерные для данного синдрома черты, что этот тип ожирения называют кушингоидным. Изменения затрагивают:
Лицо пациента по форме начинает напоминать полную луну (в медицине такую форму называют лунообразной). Пока жиры откладываются в этих участках тела, конечности остаются прежнего объема, поэтому фигура выглядит непропорциональной, нелепой. Дополнительно на эстетику тела влияет еще одна характерная особенность — «бизоний горб». Это скопление жира в районе 7-го шейного позвонка.
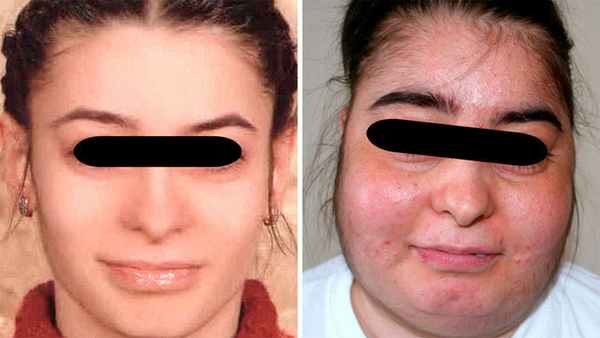
Слева — пациентка, поступившая на лечение с астмой. Справа — лунообразное лицо этой же девушки на фоне приема кортикостероидов. Источник: Multidisciplinary respiratory medicine / Open-i (CC BY 2.0)
Атрофия мышц
Пациентов с синдромом Иценко-Кушинга называют «колоссами на глиняных ногах». Это фигуральное выражение, которое обозначает нечто с виду мощное, но на самом деле слабое. Оно точно отражает суть проблемы. Больной выглядит массивным, однако при этом сила и тонус мышц у него снижены. Он часто ощущает мышечную слабость, ему трудно встать на ноги, удержать в руке тяжелый предмет.
Постепенно мышцы атрофируются. Происходит это также не равномерно, а в следующих участках тела:
Мышечная атрофия, как и ожирение, влияет на фигуру пациента — у него формируются выпирающий «лягушачий живот» и «скошенные ягодицы». Одним из частых осложнений становится грыжа белой линии живота — выпячивание посередине живота выше или ниже пупка.
Наиболее опасно то, что такие же проявления атрофии происходят и в сердечной мышце. Это выражается в нарушениях сердечного ритма, развитии сердечной недостаточности, артериальной гипертензии. Эти проблемы связаны с высоким риском для жизни пациентов, и прогноз в таких случаях неутешительный.
Изменения кожи
Щеки, подбородок, лоб пациента практически постоянно отмечены покраснением. При физической нагрузке или эмоциональном переживании оттенок кожи становится багрово-красным.
Кожа на туловище, напротив, бледная, с рисунком, похожим на мрамор. На тыльной части ладони кожа еще и истончается настолько, что кажется, будто она прозрачная. На теле есть отдельные участки, где отчетливо проступает рисунок сосудов. Заметны сосудистые звездочки, возможны небольшие подкожные кровоизлияния. Человека беспокоит сухость, шелушение кожи, а также высыпания и повышенная потливость на отдельных участках тела.
Характерный признак — вертикальные полосы растяжения кожи красного цвета (стрии). Их длина может достигать 10 см, а ширина — 2 см. «Растяжки» явно выделяются на животе, плечах, ягодицах, бедрах, у женщин — на молочных железах.
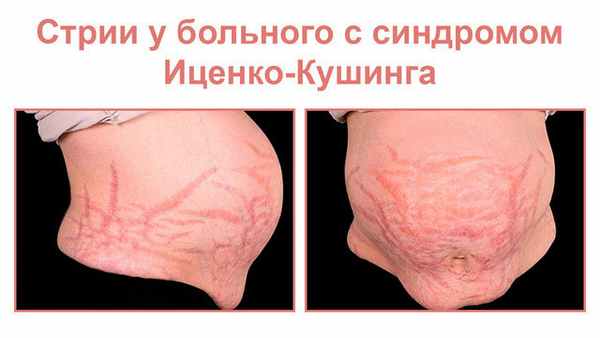
Растяжки при синдроме Иценко-Кушинга. Источник: Agata Juszczak, Damian Morris, Ashley Grossman, Endotext / NCBI (CC BY-NC-ND 2.0)
Расстройства половой системы
У женщин нарушается менструальный цикл, развивается бесплодие. У мужчин снижается либидо, потенция, могут атрофироваться яички. Кроме того, синдром известен тем, что у мужчин начинают развиваться женские вторичные половые признаки (увеличение молочных желез), а у женщин — мужские (волосы на теле).
Беременность
Планировать беременность в активной стадии болезни не рекомендуется. Более чем в половине случаев происходят преждевременные роды. На перинатальную смерть приходится около 25% случаев. Летальность плода крайне высокая и обусловлена гиперкортицизмом у матери⁴.
Изменения в костях
Для синдрома Иценко-Кушинга характерно развитие сколиоза, кифосколиоза, остеопороза. С течением болезни проблемы с костями только усугубляются:
- костная ткань становится более тонкой;
- происходит компрессия позвонков;
- кости в области поясницы и груди могут деформироваться;
- пациенты жалуются на значительные боли в костях, суставах, у них заметно портится осанка, появляется сутулость.
Можно заметить, что человек, страдающий этим заболеванием, старается меньше двигаться, так как риск сломать кость или повредить сустав очень велик.
6 типичных симптомов синдрома Иценко-Кушинга
- Жировые отложения на лице, шее, туловище при относительно худых конечностях, жировой горбик на спине.
- Мышечная слабость, атрофия мышц на ягодицах, бедрах, животе.
- Постоянно красная кожа на лице и бледно-мраморная на остальных участках тела.
- Широкие и длинные растяжки красноватого цвета на животе, груди, бедрах.
- Боли в костях, суставах.
- Нарушения менструального цикла у женщин, снижение потенции у мужчин⁶.
Лечение
Лечение болезни Иценко-Кушинга направлено на подавление выработки АКТГ. В том случае, если причиной повышенной секреции АКТГ является гормон-продуцирующая опухоль гипофиза - показано хирургическое вмешательство. При его невозможности проводится лекарственная и/или лучевая терапия.
Операция
В федеральных клинических рекомендациях основным методом лечения БИК названа нейрохирургическия. Пациентам показана операция, которая называется «эндоскопическая трансназальная аденомэктомия»⁴. Доступ к опухоли врач получает через носовые ходы и небольшие разрезы в слизистых, отверстия в кости. Манипуляции проводятся с помощью микрохирургических инструментов, поэтому травматичность минимальная. Пациент находится под общим наркозом. Метод давно опробован на практике, и при правильных действиях хирурга осложнений не возникает.
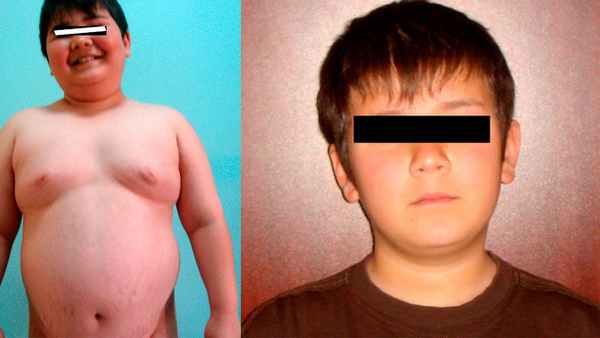
10-летний пациент с синдромом Иценко-Кушинга до (слева) и после (справа) медикаментозного лечения и операции по удалению микроаденомы гипофиза. Фото: Journal of clinical research in pediatric endocrinology / Open-i (CC BY 2.5)
Медикаментозные препараты
Для контроля симптомов БИК подходят и блокаторы стероидогенеза, в их состав могут входить кетоконазол, метирапон, митотан, этомидат.
Лучевая терапия
Методы радиотерапии, брахитерапии или радиохирургии применяют в клинических случаях, когда нейрохирургическая операция невозможна, опухоль удалена не полностью или возник рецидив. С помощью микрооборудования источник облучения подводят к самой опухоли и воздействуют непосредственно на нее. При этом окружающие ткани практически не страдают.
Двусторонняя адреналэктомия
Это операция по радикальному удалению обоих надпочечников проводится, когда все остальные методы лечения оказались неэффективны. Или если жизнь пациента находится под угрозой (уровень кортизола в моче более чем в 10 раз превышает верхнюю границу нормы) и требуется немедленное вмешательство. Операция сопряжена с развитием некоторых осложнений, которые затем требуют отдельной коррекции.
Диагностика синдрома Иценко-Кушинга
С проблемой нужно обратиться к врачу-эндокринологу. Для постановки диагноза используются гормональные исследования. Проводится забор крови и определение уровня АКТГ, кортизола в плазме крови. Распространен также метод определения этих гормонов в моче, собранной в течение 24 часов. Это необходимо, чтобы изучить суточный цикл циркуляции гормонов в организме, так как в разное время суток их объем различается⁵.
Далее необходимо выяснить, чем обуславливается повышенное выделение кортизола или АКТГ. Если пациент принимает глюкокортикоиды, их отменяют и затем снова проводят гормональные исследования, чтобы удостовериться, что причина в них.
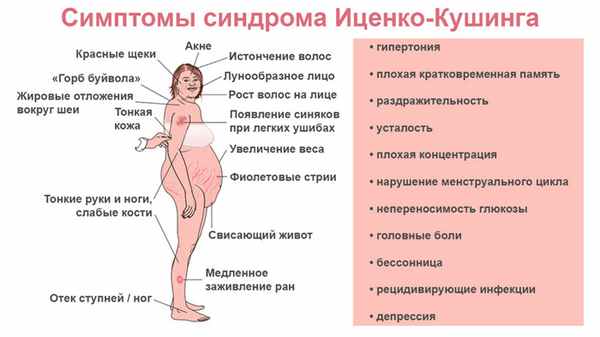
Рисунок 1. Типичные проявления синдрома Иценко-Кушинга. Источник: Thierry Brue, Frederic Castinetti, Orphanet Journal of Rare Diseases / ResearchGate (CC BY 4.0)
Главные методы аппаратной диагностики — КТ и МРТ гипофиза и надпочечников. У основной массы пациентов они выявляют гипофизарную аденому или двустороннюю гиперплазию (разрастание тканей) надпочечников. Метод МРТ гораздо информативнее — он позволяет выявлять микроопухоли диаметром меньше 1 см.
Для выявления причин необходимо обследовать все железы, включая щитовидную, так как баланс в эндокринной системе может нарушиться из-за любого сбоя в ней. Основной метод обследования – УЗИ.
Осложнения синдрома Иценко-Кушинга
При отсутствии лечения заболевание приводит к серьезным осложнениям:
- Инсульт.
- Хроническая почечная недостаточность.
- Сердечная недостаточность.
- Остеопороз и переломы позвоночника.
- Надпочечниковый криз.
- Тяжелые болезни кожи (нагноения, фурункулез, поражения грибками).
- Мочекаменная болезнь.
- Сахарный диабет.
- Психические расстройства.
- У женщин — выкидыши при беременности.
Прогноз и профилактика
При нейрохирургической операции стойкая ремиссия заболевания достигается в 84-95% случаев⁵. При лучевой терапии показатель 10-летней выживаемости без рецидивов — более 90%. Это сравнимо с результатом полного удаления опухоли⁴. Первые результаты лечения можно оценить только спустя 6-12 месяцев.
В качестве профилактических мер пациентам после курса лечения пожизненно назначают заместительную терапию минерало- и глюкокортикоидами.
Клинические рекомендации
Пациенту с синдромом Иценко-Кушинга нужно обратиться к эндокринологу, сдать кровь на определение уровня кортизола, пройти КТ и МРТ гипофиза и надпочечников, УЗИ желез внутренней секреции.
Лечение проводится нейрохирургическим путем — необходимо удаление опухоли, которая вызывает патологическое повышение кортизола. Если операция невозможна, назначается лучевая терапия или лекарственная (препарат пасиреотид). При неэффективности операции — каберголин или мифепристон. В дополнение к операции или перечисленным препаратам прописывают блокаторы стероидогенеза — кетоконазол, метирапон, митотан, этомидат.
Всем пациентам с синдромом Иценко-Кушинга рекомендуется раз в год сдавать кровь на основные гормоны, в том числе кортизол.
Что входит в синдром? Классификация
Существует несколько классификаций. Все ученые сходятся во мнении, что 80-85% клинических случаев приходится на болезнь Иценко-Кушинга (БИК). Это заболевание возникает как следствие доброкачественной аденомы гипофиза. В отношении остальных патологий, входящих в данный синдром, есть расхождения. Чаще всего выделяют медикаментозный синдром — формирующийся из-за приема препаратов с глюкокортикоидами. А также эктопический АКТГ-синдром — вызываемый опухолями систем, которые выделяют адренокортикотропный гормон (АКТГ)³.
Причины синдрома Иценко-Кушинга
Основной причиной развития БИК ученые и врачи признают аденому гипофиза, участвующего в выработке кортизола в организме. Опухоль может быть размером около 1 см (при этом размер самого гипофиза — около 1,5 см). Почему она образуется? Считается, что это результат мутации, которая приводит к разрастанию кортикотрофов. Эти клетки непосредственно отвечают за гипофизарную секрецию гормона АКТГ⁶. Образование аденомы приводит к чрезмерному его выделению.
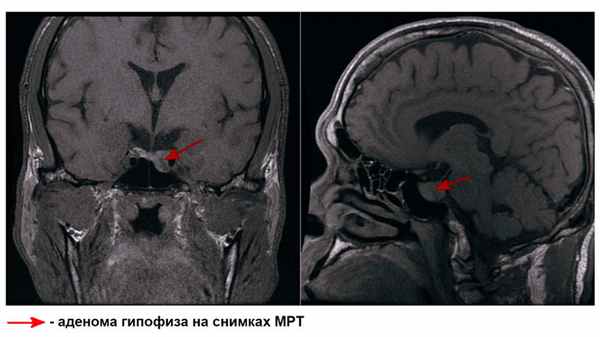
Аденома гипофиза. Источник: Journal of Geriatric Cardiology / ResearchGate (CC BY-NC-SA 3.0)
Кора надпочечников в ответ на повышенную выработку АКТГ реагирует разрастанием собственных тканей. Так как их становится больше, кортизола они также вырабатывают в чрезмерном объеме.
В других случаях причиной становятся добро- и злокачественные новообразования надпочечников (аденомы и карциномы). Разрастание тканей их коры опять же провоцирует большее продуцирование кортизола.
Еще одна причина — относительно редкая — это прием экзогенных глюкокортикоидов для лечения аутоиммунных патологий, воспалений, например, ревматоидного артрита или бронхиальной астмы⁵.
Видео 1. Причины развития синдрома Иценко-Кушинга.
Патогенез синдрома Иценко-Кушинга
Гиперкортизолемия приводит к распаду белковых структур костей, мышц, кожи, внутренних органов, включая сердце. Со временем в них развивается дистрофия и атрофия. Нарушается углеводный обмен, из-за чего повышается уровень глюкозы в крови и возникает гипергликемия.
Проблемы с обменом жиров заключаются в неравномерном их распределении. Именно поэтому в одних участках тела они скапливаются, а в других жировая клетчатка атрофируется.
Избыток кортизола негативно влияет и на почки, из-за чего происходят электролитные сдвиги, которые выражаются в артериальной гипертензии, сердечной недостаточности, аритмии. Кроме того, кортизол в большом количестве способен подавлять иммунитет, поэтому пациент оказывается подвержен инфекциям.
Заключение
Синдром Иценко-Кушинга — тяжелое и опасное эндокринное нарушение, которое значительно ухудшает качество жизни человека и, к сожалению, грозит летальным исходом от развивающихся осложнений. Поэтому при первых признаках болезни нужно обратиться к врачу-эндокринологу, чтобы поставить диагноз и получить своевременное лечение. Чем быстрее это будет сделано, тем больше у пациента будет шансов вернуться к нормальной жизни.
Синдром Иценко – Кушинга (лекция)
Для цитирования: Древаль А.В. Синдром Иценко – Кушинга (лекция). РМЖ. Медицинское обозрение. 2016;24(1):2-5.
Лекция посвящена внегипофизарным болезням, вызывающим гиперсекрецию глюкокортикоидов надпочечниками
Для цитирования. Древаль А.В. Синдром Иценко – Кушинга (лекция) // РМЖ. 2016. No 1. С. 2–5.
Клинический синдром, который развивается вследствие повышенного содержания глюкокортикоидов в крови, называют синдромом Иценко – Кушинга.
Эндогенный синдром Иценко – Кушинга развивается при аденоме или карциноме коры надпочечников, а также на фоне гиперпродукции адренокортикотропного гормона (АКТГ) опухолью гипофиза или АКТГ-секретирующей опухолью, локализованной вне гипофиза (эктопический АКТГ-синдром), и очень редко при эктопической секреции опухолью кортикотропин-рилизинг-гормона (КРГ).
Ятрогенный (экзогенный) синдром Иценко – Кушинга — частое осложнение терапии глюкокортикоидами, когда их используют как противовоспалительные или иммуносупрессивные средства.
Перечень патологических состояний, при которых продукция глюкокортикоидов повышена, представлен в таблице 1. Следует заметить, что кроме указанных в таблице болезней описан и ряд очень редких генетически детерминированных заболеваний, при которых развивается синдром Иценко – Кушинга.
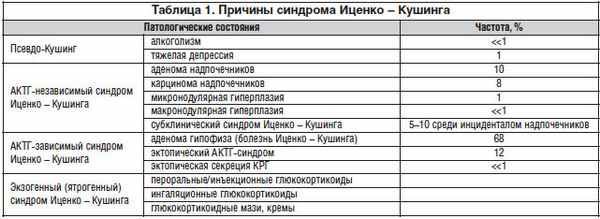
В данной лекции рассмотрим внегипофизарные болезни, вызывающие гиперсекрецию глюкокортикоидов надпочечниками.
Доброкачественная адренокортикальная аденома
Доброкачественная адренокортикальная аденома обычно инкапсулирована, ее размер – менее 4 см в диаметре. Чаще всего она секретирует только глюкокортикоиды.
Лечение хирургическое — односторонняя адренал-эктомия, которую обычно выполняют лапароскопически. В послеоперационном периоде может развиваться надпочечниковая недостаточность. Это следствие атрофии неудаленного надпочечника из-за подавленной секреции АКТГ на фоне гиперпродукции кортизола аденомой. Длительность заместительной терапии глюкокортикоидами может составлять 2 года.
Прогноз после операции благоприятный, вероятность рецидива низкая.
Адренокортикальная карцинома
Адренокортикальная карцинома обычно более 6 см в диаметре, хотя бывают опухоли и меньшего размера. Нередко на момент выявления обнаруживают локальную инвазию опухоли, возможны метастазы. Чаще всего злокачественная опухоль продуцирует несколько гормонов. Наиболее типичная комбинация — кортизол и андрогены (предшественники), реже – минералокортикоиды или эстрогены.
Лечение карциномы надпочечников необходимо проводить в специализированных центрах, где есть хирурги, онкологи и эндокринологи, имеющие достаточный опыт лечения такого рода больных.
Главным методом лечения служит хирургическое удаление опухоли. После операции может понадобиться заместительная терапия. В случае неполного удаления опухоли и/или метастазов назначают препараты, подавляющие секрецию глюкокортикоидов (метирапон, кетоконазол и др.).
Прогноз неблагоприятный. Несмотря на оперативное лечение, 5-летняя выживаемость составляет 22%, а медиана выживаемости — 14 мес. Если больной получает лечение в специализированных центрах, показатели выживаемости оказываются лучше вследствие комплексного лечения, назначаемого онкологами и эндокринологами.
Синдром Иценко – Кушинга, вызванный эктопическим синтезом АКТГ (эктопический АКТГ-синдром)
Эктопический АКТГ-синдром вызывается в 50% случаев злокачественной мелкоклеточной опухолью легкого. Этот синдром может быть и проявлением нейроэндокринных опухолей, которые локализованы в тимусе (15%), поджелудочной железе (10%) или бронхе (10%). Эктопическая продукция КРГ встречается крайне редко.
Отличительные особенности эктопического АКТГ-синдрома:
•Очень высокий уровень кортизола.
•Доминируют клинические проявления артериальной гипертензии, гипокалиемии и метаболического алкалоза, что обусловлено стимуляцией минералокортикоидных рецепторов высоким уровнем кортизола.
•Нет абдоминального ожирения, если злокачественная опухоль быстро прогрессирует, вызывая кахексию.
•Наблюдаются другие симптомы гиперкортизолизма, в частности нарушение толерантности к глюкозе, склонность к инфекциям, тонкая кожа, плохое заживление ран, психические нарушения и др.
•Возможна выраженная гиперпигментация вследствие совместной с АКТГ гиперпродукции проопиомеланокортина, обладающего биологической активностью меланоцит-стимулирующего гормона.
•Уровень АКТГ может быть очень высоким (обычно более 100 пг/мл).
•В 90% случаев в большом дексаметазоновом тесте (2 мг 4 р./сут) содержание кортизола не снижается более чем на 50% от базального уровня, т. к. в опухоли нарушен механизм саморегуляции секреции АКТГ.
•В случае нейроэндокринной опухоли клиническая картина и результаты диагностических тестов могут быть неотличимы от таковых при болезни Иценко – Кушинга (гиперпродукции АКТГ гипофизом), что требует для дифференциальной диагностики проведения селективного забора крови на АКТГ, оттекающей от гипофиза.
•У некоторых больных, несмотря на выраженную клиническую картину гиперкортизолизма, опухоль может быть очень небольших размеров (несколько миллиметров в диаметре), что делает невозможной ее локализацию. В этом случае назначают консервативное лечение гиперкортизолизма, а при очень выраженной клинической картине проводят двустороннюю адренал-эктомию. После устранения симптомов гиперкортизолизма у больного регулярно исследуют потенциально наиболее вероятные зоны локализации опухоли до тех пор, пока она не станет очевидной — тогда ее удаляют.
Лечение заключается в удалении АКТГ-продуцирующей опухоли, где это возможно. В противном случае назначаются препараты, блокирующие продукцию глюкокортикоидов (кетоконазол, например). Если удалить опухоль по тем или иным причинам невозможно, а общее тяжелое состояние больного определяется только гиперкортизолизмом, который трудно контролируется, удаляют надпочечники.
АКТГ-независимая двусторонняя макронодулярная гиперплазия надпочечников
Это редкий эктопический синдром Иценко – Кушинга, который чаще бывает спорадическим, реже – семейным. Наиболее частая причина — эктопический синтез в надпочечниках рецепторов гастроинтестинального полипептида. Секреция этого полипептида клетками желудочно-кишечного тракта повышается после приема пищи, что стимулирует секрецию глюкокортикоидов в надпочечниках, т. е. развивается связанный с приемом пищи гиперкортизолизм. Могут эктопически синтезироваться в надпочечниках и другие рецепторы — к лютеинизирующему гормону или β-адренергические.
Комплекс Карнея
Диагноз «комплекс Карнея» (генетически детерминированная болезнь, аутосомно-доминантная) устанавливают в том случае, когда обнаруживают не менее 2 из нижеперечисленных клинических признаков:
– участки пигментации кожи;
– миксомы сердца, кожи или мукозные;
– чаще всего первичная пигментная узловая гиперплазия надпочечников (может быть как микро-, так и макроузловая), сопровождаемая гиперпродукцией глюкокортикоидов (синдром Иценко – Кушинга);
– СТГ/пролактин-секретирующая опухоль гипофиза, а также гиперплазия соматотрофов/пролактотрофов;
– аденома щитовидной железы;
– псаммоматозная меланотическая шваннома.
Синдром Мак-Кьюна – Олбрайта
Редкая болезнь (частота от 1:100 000 до 1:1000000), генетически обусловленная, но не наследственная, т. к. возникает вследствие постзиготной соматической мутации, что проявляется мозаицизмом. Возможна генетическая диагностика мутации, выявляемой в пораженных тканях или клетках крови.
Диагноз устанавливают, если присутствуют 2 из 3нижеперечисленных признаков.
– появление кист в костях нижних и верхних конечностей, таза, грудной клетки, с чем связаны самопроизвольные переломы с вовлечением нервных стволов и появлением на месте перелома очагов гипертрофии костей;
– чаще всего страдают бедренная кость и кости таза, и эту особенность можно использовать для скрининговой диагностики болезни;
– остеосаркома возникает редко;
– поражение костей проявляется обычно до 10-летнего возраста.
•Пигментация отдельных участков кожи:
– появляются бурые пятна на задней поверхности шеи, спине, в области поясницы и бедер величиной от маленькой родинки до больших пятен;
– контуры пигментации неровные, не пересекают средней линии тела;
– локализованы обычно на стороне поражения костей;
– степень пигментации часто соответствует величине поражения скелета.
– синдром Иценко – Кушинга (гиперплазия надпочечников или аденома);
– преждевременное половое созревание;
– узлы в щитовидной железе;
– СТГ-секретирующая опухоль гипофиза и пролактинома;
Кроме указанных выше диагностически значимых поражений, также возможны:
– кардиомегалия, тахиаритмия, внезапная кардиальная смерть;
– поражение гепатобилиарной системы;
– микроцефалия, задержка психического развития.
Субклинический синдром Иценко – Кушинга
Дать определение субклинического синдрома Иценко – Кушинга несложно: патологическое состояние, при котором, несмотря на повышенную секрецию кортизола, нет характерного (специфического) симптомокомплекса (стрии, центрипетальное ожирение, лунообразное лицо, плетора и др.). Однако это определение не годится для реальной практической работы клинициста-эндокринолога, т. к. оно неконструктивно, т. е. нет явных указаний, в каких клинических ситуациях следует использовать это понятие как диагноз. В связи с этим уточним определение. Сначала ответим на вопрос, который возникает в первую очередь: какие диагностические тесты и алгоритмы следует использовать для диагностики субклинического гиперкортицизма? Ответ: те же, что и для диагностики манифестного гиперкортицизма! При этом эти тесты обычно разбиваются на 2группы: скрининговые (предварительные) и верифицирующие (позволяющие с более высокой надежностью установить диагноз гиперкортизолизма, чем скрининговые).
К скрининговым (стартовым) диагностическим тестам чаще всего относят следующие:
– исследование кортизола в суточной моче (проводится двукратно для верификации гиперкортизолизма, если не сочетается с другим тестом);
– малый ночной (1 мг) дексаметазоновый тест (проводится однократно);
– кортизол слюны в полночь (проводится двукратно, если не сочетается с другим тестом);
Ключевым моментом в диагностике субклинического гиперкортизолизма является существенное ограничение группы обследования только больными, у которых выявлена инциденталома надпочечников. То есть поводом для обследования с целью выявления субклинического гиперкортизолизма может быть только выявленная у больного опухоль надпочечника, причем абсолютно случайно, а не в связи с симптомами гиперкортизолизма. Следовательно, в клинической практике диагноз «субклинический гиперкортизолизм» может быть установлен только у больного с инциденталомой. В результате спектр больных с субклиническим синдромом Иценко – Кушинга сужается до АКТГ-независимых случаев, а фактически ограничивается только аденомой надпочеников. Этот подход позволяет существенно повысить выявляемость субклинического гиперкортицизма, что сохраняет финансовые ресурсы здравоохранения или больного. Однако вместе с тем из поля зрения клиницистов выпадают пациенты с субклиническим течением болезни Иценко – Кушинга, например.
Другие исследователи указанный комплекс результатов обследования (инциденталома + скрининговые тесты) полагают недостаточным, чтобы быть абсолютно уверенным в диагнозе «субклинический синдром Иценко – Кушинга», и тогда больному назначают более надежные с точки зрения клинициста-исследователя верифицирующие тесты диагностики гиперкортизолизма.
В этом случае диагноз субклинического гиперкортизолизма сохраняется до тех пор, пока не будут получены результаты верифицирующих тестов. Если и с их помощью диагноз эндогенного гиперкортизолизма подтверждается, тогда диагноз субклинического синдрома Иценко – Кушинга считают доказанным.
В результате дополнительного обследования у части больных в этих тестах диагноз гиперкортизолизма может не подтвердиться, тогда диагноз субклинического гиперкортизолизма пересматривают, и скрининговые (стартовые) тесты интерпретируют с точки зрения неэндокринной патологии. К примеру, лабораторная ошибка, связанная с недостаточной надежностью скрининговых тестов, или наличие у больного депрессии, при которой секреция кортизола в дексаметазоновом тесте часто не подавляется, и т. п. Очевидно, что в этих случаях ранее поставленный предположительный диагноз субклинического гиперкортизолизма снимают.
Выше был представлен алгоритм обследования больного на субклинический гиперкортизолизм в клинической практике, где ключевым или стартовым поводом для обследования была выявленная инциденталома надпочечника.
Вместе с тем в научных исследованиях может быть поставлена задача выявления субклинического гиперкортицизма в других, кроме пациентов с инциденталомой, группах риска, например среди больных сахарным диабетом, который с высокой частотой сопровождает гиперкортизолизм. В этом случае именно сахарный диабет становится поводом для начала обследования на гиперкортизолизм, и точно так же, как в случае инциденталом, стартовый набор тестов, в котором дифференцируется истинный гиперкортизолизм от функционального, остается тем же. Следует заметить, что при таком подходе появляется возможность выявления не только АКТГ-независимого варианта субклинического синдрома Иценко – Кушинга, но и АКТГ-зависимого, т. е. спектр субклинических синдромов Иценко – Кушинга расширяется. Следовательно, в отличие от случая инциденталом, после подтверждения истинного гиперкортизолизма далее следует уточнять локализацию процесса путем визуализации надпочечников (синдром Иценко – Кушинга) и исследования АКТГ в крови (дифференциальная диагностика АКТГ-зависимого и АКТГ-независимого синдрома Иценко – Кушинга).
Дифференциальная диагностика синдрома Иценко – Кушинга
Первый этап диагностического поиска
Заключается в диагностировании эндогенного гиперкортизолизма. Однако следует заметить, что до сих пор общепринятого набора тестов для диагностики гипекортизолизма нет, и в разных клинических центрах он может существенно различаться. В таблице 2 приведены перечень тестов, которые используют для скрининга при подозрении на синдром Иценко – Кушинга, и их диагностическая значимость.
Второй этап диагностического поиска
К нему приступают после того, как диагностирован эндогенный гиперкортизолизм (синдром Иценко – Кушинга). Этот этап заключается в поиске причины гиперпродукции кортизола надпочечниками, а фактически в определении локализации патологического процесса, с которым связана гиперсекреция кортизола. С одной стороны, очевидно, что только надпочечник может продуцировать кортизол. С другой стороны, синтез кортизола надпочечниками управляется АКТГ, который может вырабатываться как в гипофизе, так и вне его (эктопически). В итоге получаем три точки возможной локализации: надпочечник (опухоль и/или гиперплазия), гипофиз (аденома) или эктопическая секреция опухолью (обычно легкие), что и составляет предмет дифференциальной диагностики второго этапа. Тесты для определения АКТГ-зависимого гиперкортизолизма представлены в таблице 3.
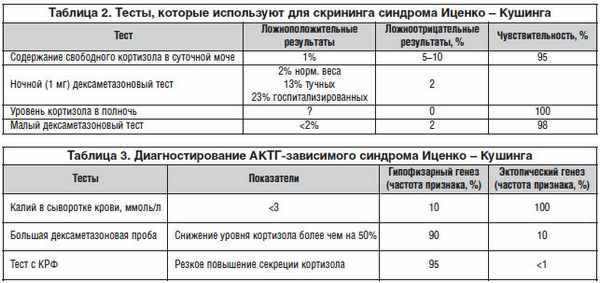
•У больных с подтвержденным на первом этапе диагностики синдромом Иценко – Кушинга определяют базальный уровень АКТГ в сыворотке крови, чтобы с помощью этого исследования дифференцировать АКТГ-зависимый синдром Иценко – Кушинга (уровень АКТГ повышен) от АКТГ-независимого (содержание АКТГ снижено). Уровень АКТГ >4 пмоль/л — показатель АКТГ-зависимого синдрома Иценко – Кушинга.
•По уровню АКТГ дифференцировать гипофизарную гиперсекрецию АКТГ от эктопической практически невозможно, хотя при эктопической секреции содержание АКТГ несколько выше.
•Большую дексаметазоновую пробу проводят по такой же схеме, как и малую, но доза гораздо выше.
◊ 2 мг дексаметазона принимаются каждые 6 ч (120мкг/кг/сут) в течение 2 дней, начиная с 9:00.
◊ Уровень кортизола исследуют натощак в день начала пробы до приема дексаметазона и затем через 48ч.
◊ При болезни Иценко – Кушинга уровень кортизола через 48 ч снижается более чем на 50% по сравнению с исходом, в меньшей степени — при эктопическом синдроме Иценко – Кушинга. Однако следует заметить, что у 10% пациентов с болезнью Иценко – Кушинга уровень кортизола не снижается более чем на 50%.
◊ Внутривенно вводят 100 мкг КРГ.
◊ Кровь на кортизол берут натощак за 15 мин и 0мин до введения КРГ, а затем каждые 15 мин в течение 2ч.
◊ У больных с гипофизарной секрецией АКТГ уровень кортизола уже повышается через 15 мин и достигает максимума на 30-й мин теста (повышение на 14–20%), снижаясь до исходого уровня через 60 мин. Аналогично повышается и концентрация АКТГ (на 35–50%).
◊ У больных с эктопической продукцией АКТГ уровни кортизола и АКТГ не реагируют на введение КРГ.
•Забор крови из нижнего каменистого (петрозного) синуса.
◊ Этот тест желательно проводить со стимуляторами секреции АКТГ (например, с кортикотропин-рилизинг-фактором (КРФ)).
◊ Уровень АКТГ в оттекающей от гипофиза крови по сравнению с периферическим в 2 раза выше, если именно в гипофизе продукция АКТГ повышена, и такой разницы нет в случае АКТГ-эктопического синдрома.
◊ При МРТ в сочетании с контрастированием гипофиза (гадолиний) аденома выявляется в 80% случаев.
◊ Однако следует иметь в виду, что аденома гипофиза выявляется у 10% лиц без нарушения функции гипофиза, поэтому биохимические исследования гормонов имеют решающее значение.
◊ В случае подозрения на АКТГ-независимый синдром Иценко – Кушинга при МРТ/КТ в надпочечниках можно выявить характерные морфологические изменения.
Третий этап диагностического поиска
После того как локализован первичный патологический процесс, вызвавший гиперпродукцию кортизола, исследуют его природу, что и представляет собой третий, завершающий этап диагностического поиска. Обычно окончательно диагноз уточняют при морфологическом изучении операционного материала, а в некоторых случаях необходимо также и генетическое обследование больного и его родственников.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
