Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды
Обновлено: 19.04.2024
В свете появляющихся новых данных взгляд на систему гипоталамус-гипофиз-надпочечники-органы-мишени претерпевает значительные изменения, и наряду с механизмом отрицательной обратной связи, возникают предположения о существовании других регуляторных механизмов синтеза, активации и дезактивации ГКС. Тем не менее, в настоящее время имеется сравнительно небольшой объем данных о взаимосвязи между системной и местной продукцией кортизола в тканях. Неуклонный рост числа пациентов с сахарным диабетом (преимущественно 2 типа) и ожирением ставит новые задачи по разработке эффективных лекарственных средств и форм их доставки, методов своевременного выявления и профилактики развития заболевания. Понимание этих процессов позволит создать необходимую научную базу для поиска и разработки новых мишеней для фармакотерапии заболеваний, ассоциированных с нарушением синтеза, активации и действия ГКС.
Ключевые слова
Для цитирования:
For citation:
Введение
В основе любого научного открытия лежит накопление большого количества клинических наблюдений, литературных данных с последующей суммацией и систематизацией знаний и выдвижением новой гипотезы. В настоящее время имеется достаточное количество информации о механизмах действия кортизола и его клеточных мишенях, локального и системного действия, однако продолжающиеся экспериментальные исследования открывают все больше новых данных о биологической роли гормона. Исходным субстратом в стероидогенезе служит холестерин, либо получаемый с пищей, либо синтезируемый эндогенно из ацетата. Три основных пути биосинтеза в корковом веществе надпочечников приводят к образованию глюкокортикоидов, минералокортикоидов и надпочечниковых андрогенов. Наружная (клубочковая) зона участвует преимущественно в биосинтезе альдостерона, а внутренние (пучковая и сетчатая) служат местом биосинтеза глюкокортикоидов и андрогенов. Основным глюкокортикоидным гормоном у человека является гидрокортизон (кортизол). Суточная секреция кортизола составляет 15–30 мг и обладает выраженным суточным ритмом. Кортизол в плазме присутствует в трех видах: свободном, связанном с белком и в виде метаболитов. В норме на долю свободного, биологически активного кортизола приходится около 5% его количества, присутствующего в крови. Приблизительно 90% кортизола связывается специфическим белком (а2-глобулином) – транскортином, обладающим высоким средством к гормону. Менее 5% кортизола связывается белком с низким сродством – альбумином. Необходимо отметить, что именно от количества свободного кортизола зависит его биологическая активность, проявляющаяся в непосредственном воздействии на ткани. В норме глюкокортикостероиды (ГКС) участвуют во всех видах обмена (в метаболизме белков, углеводов, липидов), в связи с чем патофизиологические и клинические изменения при гиперкортицизме колеблются в широких пределах. Гиперпродукция глюкокортикоидов может быть следствием повышения уровня адренокортикотропного гормона при опухолях гипофиза (болезнь Иценко-Кушинга), опухолях, происходящих из других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола корой надпочечников (синдром Иценко-Кушинга). На примере этих орфанных заболеваний изучены различные эффекты избытка кортизола на органы и ткани. При гиперкортицизме наблюдаются нарушение толерантности к глюкозе или сахарный диабет, обусловленные стимуляцией глюконеогенеза и развитием инсулинорезистентности, усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани, своеобразное перераспределение и изменения морфологического состава жировой ткани. Как известно, глюкокортикоиды моделируют физиологию жировой ткани, изменяя секрецию адипокинов непосредственно или в связи с развивающейся инсулинорезистентностью, стимулируют дифференцировку адипоцитов, способствуя образованию новых клеток жировой ткани посредством активации транскрипции ряда ключевых генов [1, 2]. Гипернатриемия, гипокалиемия и, как следствие, артериальная гипертензия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.
Кортизол и метаболический синдром
Хорошо известно, что ГКС оказывают влияние на распределение жировой ткани. Ряд исследований показал, что пациенты с ожирением имеют гиперактивацию фермента 11β-HSD1 в жировой ткани [4, 5] и гепатоцитах, ключевого фермента, стимулирующего конверсию метаболически неактивного кортизона в активный кортизол (рис. 1). Напротив, 11β-гидроксистероид дегидрогеназа 2 (11β-HSD2), катализирующая превращение кортизона в кортизол, имела низкую экспрессию.
Рис.1 Конверсия кортизола в кортизон
Как упоминалось ранее, было выдвинуто предположение, что активность 11β-HSD1 может быть одним из патогенетических механизмов, лежащих в основе развития метаболического синдрома. Данные экспериментальных исследований на животных показали, что селективная 11β-HSD1 гиперэкспрессия в жировой ткани (аналогично тому, что наблюдается у пациентов с ожирением) приводила к развитию метаболического синдрома, и, в частности, дислипидемии, ожирению, гипертензии, связанной с активацией системы ренин-ангиотензин-альдостерон, инсулинорезистентности и нарушению углеводного обмена. Кроме того, адипоциты имели больший размер (рис. 2), чем обычно, основной эффект наблюдался в висцеральной жировой ткани, возможно, из-за более высокой плотности рецепторов к ГКС [6, 7, 8].
Рис. 2 Электронная микрофотография адипоцитов
Полученные данные позволили рассматривать 11b-HSD1 в качестве новой мишени для фармакотерапии. II фаза рандомизированного двойного слепого плацебо-контролируемого исследования эффективности селективного ингибитора 11b-HSD1 (INCB013739) у пациентов с избыточной массой тела/ожирением и СД 2 типа показали статистически значимое увеличение печеночной и периферической чувствительности к инсулину, снижению глюкозы в плазме натощак, общего холестерина и липопротеинов низкой плотности (ЛПНП), триглицеридов плазмы и уровня АД [9]. Открытым остается вопрос: каким образом локальная гиперпродукция ГКС влияет на системный уровень кортизола и нарушается ли при этом механизм отрицательной обратной связи?
Кортизол и кардиоваскулярные риски
По данным Colao A. и соавт., в течение пяти лет после наступления ремиссии болезни Иценко-Кушинга концентрации холестерина, ЛПНП, индекс атерогенности, уровень инсулина остаются выше референсных значений, что определяет этих пациентов в группу высокого риска по сердечно-сосудистым осложнениям даже после достижения ремиссии заболевания [10–12].
Помимо перечисленных метаболических факторов, лежащих в основе кардиоваскулярных нарушений, кортизол оказывает ингибирующее действие на ангиогенез. Под ангиогенезом стоит понимать процесс роста новых кровеносных сосудов, который является необходимым в репарации тканей и при иных заболеваниях, протекающих с развитием ишемии ткани, таких как ишемическая болезнь сердца, хроническая артериальная недостаточность нижних конечностей и тд.
Регулирование ангиогенеза гипоксией является важным компонентом гомеостаза. В норме в ответ на снижение содержания кислорода в тканях, гипо ксие индуцируемый фактор Ia (HIF-1) стимулирует рост новых сосудов. Тот же механизм срабатывает и в ишемизированных тканях [13].
HIF-1 контролируемое производство фактора роста эндотелия сосудов (VEGF) приводит к аутокринной передаче сигнала, что имеет решающее значение для ангиогенеза. Многие из биологических процессов в ангиогенезе, инвазия внеклеточного матрикса и формирование трубки эндотелиальными клетками стимулируются в условиях гипоксии через HIF-1, который активирует транскрипцию десятков генов, чьи белковые продукты играют решающую роль в этих процессах [14].
Как показывают данные исследований, в процессе патологической перестройки миокарда, его гипертрофии, а затем дилятации с развитием сердечной недостаточности, одну из ключевых ролей играет HIF-1. HIF-1 стимулирует выработку VEGF, который, в свою очередь, связывается с рецептором на поверхности эндотелиальных клеток. После чего происходит активация сигнального пути ERK (Ras-ERK и MAPK/ERK), стимулирующего пролиферацию и миграцию эндотелиоцитов [15, 16, 17].
Глюкокортикоид-опосредованное ингибирование ангиогенеза играет важную роль в физиологии, патофизиологии и терапевтических подходах к некоторым заболеваниям. Тем не менее, механизмы, посредством которых глюкокортикоиды ингибируют рост новых кровеносных сосудов, до конца не изучены. В экспериментальном исследовании James J. Logie и соавт. продемонстрировано, что даже физиологические уровни глюкокортикоидов подавляют ангиогенез, непосредственно предотвращая формирование сосудистой трубки эндотелиальными клетками. В процессе ангиогенеза эндотелиальные клетки начинают активно пролиферировать, запускается процесс трансформации их морфологической структуры, что приводит к формированию высокоупорядоченных клеточных линий, составляющих внутренний слой новообразованных сосудов.
Воздействие кортизола снижает образование межклеточных контактов, не ухудшая при этом пролиферации, миграции или жизнеспособности эндотелиальных клеток. Предыдущие исследования показывают, что глюкокортикоиды подавляют ангиогенез путем ингибирования синтеза VEGF [18, 19, 20], что доказывает ингибирующее действие кортизола на сигнальные пути, который инициирует образование тубул.
Таким образом, в условиях гиперсекреции кортизола VEGF-опосредованный ангиогенез нарушается, что быстрее приводит к дезадаптации процессов компенсации сердечной деятельности и развитию тяжелой сердечной недостаточности, что и обуславливает неблагоприятный прогноз у пациентов с гиперкортицизмом любой этиологии.
Синтез кортизола в коже. Регуляция репарации
Ожирение и ассоциированные с ожирением состояния сопровождаются нарушениями физиологической репарации, что увеличивает вероятность замедленного заживления ран. Люди с ожирением имеют высокий риск развития венозных язв, различных кожных заболеваний (например, кандидоза, эритразмы) или более серьезных кожных инфекций (например, целлюлита, некротизирующего фасцита), гнойных осложнений после хирургических вмешательств. Однако роль ГКС в регуляции репарации ран в настоящее время достаточно плохо изучена.
Наряду с тканью надпочечников, синтезирующей глюкокортикоиды, все больше данных стало появляться о местах вненадпочечниковой продукции кортизола, к ним относятся мозг, легкие, сердце, тимус, клети иммунной системы и кожа [21, 22].
Несмотря на основную функцию кожи служить барьером для защиты внутренней среды организма от агрессивных воздействий, последние исследования в дерматологии были посвящены изучению способности клеток эпидермиса секретировать гормоны. Способность взаимодействовать с центральной нервной системой посредством локальной продукции в системный кровоток гормонов, нейропептидов, нейротрансмиттеров и других регуляторных факторов позволяет рассматривать кожу как нейроэндокринный орган [23].
Кератиноциты – первые клетки, которые реагируют на повреждение целостности кожного покрова, запускающего каскад реакций, что способствует изменению фенотипа кератиноцитов, приводит к их миграции и пролиферации, изменению способности кератиноцитов к адгезии и конфигурации цитоскелета [24] (рис. 3).
Рис. 3 Иммунофлюоресцентная микрофотография кератиноцитов
Кератиноциты обладают способностью синтезировать холестерин, который является предшественником всех стероидных гормонов. Кроме того, как показывает ряд исследований, клетки кожи способны секретировать гипоталамо-гипофизарные гормоны: проопиомеланокортин, адренокортикотропный гормон, тиреотропный гормон и соматотропный гормон [25, 26, 27, 28].
Экспрессия ключевых ферментов стероидогенеза в коже подтверждает предположение о том, что эпидермис может быть основным местом вненадпочечникового синтеза кортизола. Как и ожидалось, ферменты, которые контролируют активность кортизола, а именно конверсию в неактивный кортизон 11b-HSD1 и 11b-HSD2, также экспрессируются множеством подтипов кератиноцитов. Экспрессия CYP11B1 преимущественно выражена в базальных и супрабазальных слоях эпидермиса. Эти слои эпидермиса имеют наибольшую способность к пролиферации и являются основными источниками для регенерации тканей [29].
Экспрессия CYP11B1, ключевого фермента синтеза кортизола, повышается в ответ на воздействие АКТГ или провоспалительных цитокинов IL-1, что свидетельствует о прямом стимулирующем действии провоспалительных цитокинов [30] и снижается в ответ на метирапон. По всей видимости, секреция кортизола в ответ на повреждение ткани сначала повышается и достигает пика спустя 48 ч после воздействия повреждающего агента, а затем, при переходе раны в стадию пролиферации, постепенно снижается к исходному уровню спустя 96 ч, что подтверждают данные исследований на культуре человеческих кератиноцитов. Спустя 96 ч увеличивается экспрессия 11-HSD2 – фермента, конвертирующего преобразование активного кортизола в неактивный кортизон. Чтобы подтвердить предположение о существовании отрицательной обратной связи кортизол/IL-1, в культуру клеток добавляли ингибитор синтеза кортизола – метирапон. По сравнению с контролем, в группе метирапона отмечалось повышение экспрессии IL-1, что подтверждает наличие петли обратной связи, которая регулирует первоначальный ответ на повреждение ткани, предотвращая избыточное воспаление, которое может привести к дальнейшему повреждению тканей.
По данным последних исследований, глюкортикоиды действуют через Wnt-сигнальный путь, тем самым влияя на клеточный цикл кератиноцитов, ингибируя пролиферацию, миграцию, и индуцируя клеточную дифференцировку. Кроме того, ГКС ингибируют влияние эпидермального фактора роста (EGF), который непосредственно стимулирует миграцию и пролиферацию клеток [31, 32].
Таким образом, даже при функциональном гиперкортицизме за счет описанных механизмов нарушается нормальная репарация ткани. Эпидермис ран теряет способность к пролиферации и миграции, что может приводить к длительной персистенции раневых де фектов.
Заключение
В свете появляющихся новых данных, взгляд на систему гипоталамус-гипофиз-надпочечники-органы-мишени претерпевает значительные изменения, и наряду с механизмом отрицательной обратной связи возникают предположения о существовании других регуляторных механизмов синтеза, активации и дезактивации ГКС. Тем не менее, в настоящее время имеется сравнительно небольшой объем данных о взаимосвязи между системной и местной продукцией кортизола в тканях. Понимание этих процессов позволит создать необходимую научную базу для поиска и разработки новых мишеней для фармакотерапии заболеваний, ассоциированых с нарушением синтеза, активации и действия ГКС.
Андрогены, глюкокортикоиды, минералокортикоиды, эстрогены, прогестагены, их предшественники и метаболиты (16 показателей) в крови
Андрогены, глюкокортикоиды, минералокортикоиды, эстрогены, прогестагены, их предшественники и метаболиты (16 показателей): 17-ОН-прегненолон, тестостерон, дегидроэпиандростерон, дегидроэпиандростерон-сульфат (ДГЭА-SO4), андростендион, кортизол, кортизон, 11-дезоксикортизол, 21-дезоксикортизол, дезоксикортикостерон (21-гидроксипрогестерон, 11-деоксикортикостерон), кортикостерон, эстрадиол, эстрон, эстриол, прогестерон, 17-гидроксипрогестерон в крови Андрогены – стероидные половые гормоны, производимые половыми железами: яичками у мужчин и яичниками у женщин. У обоих полов синтез андрогенов может происходить в клетках сетчатого слоя коры надпочечников. Отвечают за развитие мужских вторичных половых признаков и вирилизацию при их избытке у женщин либо при нарушении их превращения в эстрогены. Глюкокортикоиды – стероидные гормоны, продуцируемые пучковым слоем коры надпочечников из прогестерона и 17-ОН-прогестерона. Обладают мощным противовоспалительным действием, усиливают катаболизм белков, влияют на углеводный обмен, способствуя повышению уровня глюкозы в крови, через стимуляцию процесса глюконеогенеза. Стимулируют процессы липолиза и перераспределение жировой массы, способствуя развитию абдоминального ожирения на фоне хронического стресса. Обладают мощным противовоспалительным действием. Минералокортикоиды – гормоны, синтезируемые в клубочковой зоне коры надпочечников. Ключевые промежуточные минералокортикоиды – предшественники альдостерона: дезоксикортикостерон и кортикостерон, обладающие меньшей минералокортикоидной активностью образуются при участии фермента альдостеронсинтазы и под контролем ангиотензина II. Регулируют электролитный и водный баланс, увеличивая реабсорбцию натрия в дистальных канальцах почек и повышая экскрецию калия с мочой. Эстрогены – стероидные половые гормоны, преобладающие в женском организме. Синтез эстрогенов у женщин осуществляется фолликулярным аппаратом яичников, а у мужчин - в основном яичками (до 20%). У женщин эстрогены обеспечивают нормальное развитие и функционирование репродуктивной системы, а у мужчин участвуют в регуляции функций простаты и яичек. Эстрогены представлены тремя формами: эстроном (фолликулин) - Е1, эстрадиолом - Е2 и эстриолом - Е3, имеющими разную физиологическую активность. Прогестагены – стероидные половые гормоны, производимые у женщин желтым телом яичников, плацентой и частично корой надпочечников. Прогестагены у женщин обеспечивают возможность наступления и поддержания беременности, регулируя переход слизистой оболочки матки из фазы пролиферации в секреторную фазу и способствуя образованию нормального секреторного эндометрия у женщин. Обладают антиэстрогенными, антианрогенными и антигонадотропными свойствами. У мужчин прогестерон вырабатывается в небольших количествах корой надпочечников и яичками как промежуточный продукт синтеза тестостерона и кортизола, а самостоятельно он принимает участие в работе центральной нервной системы.
Показания к исследованию
Выявление врожденной и приобретенной дисфункции коры надпочечников. – Дифференциальная диагностика яичниковой и надпочечниковой гиперандрогении. – Нарушение сперматогенеза и фертильности у мужчин. – Гипогонадизм. – Задержка или ускорение полового развития. – Привычное невынашивание. – Бесплодие у женщин. – Миомы. – Эндометриоз. – Синдром поликистозных яичников. – Гормон продуцирующие опухоли коры надпочечников, яичников и яичек. – Остеопороз. – Ожирение. – Жировая дистрофия печени. – Бесплодие.
Подготовка
Оптимальное время для процедуры взятия крови – с 8:00 до 11:00. За сутки до исследования придерживаться сложившегося повседневного рациона питания. Не рекомендуется излишнее потребление продуктов одного типа: только мясо, только овощи и .т.д. За 24 часа до взятия крови исключить: - физические и эмоциональные перегрузки; авиаперелеты; температурные воздействия (посещение бань и саун, переохлаждение и т. д.); нарушение режима «сон-бодрствование»; - употребление алкоголя; - прием БАД; - инструментальные медицинские обследования (УЗИ, рентген и др.) или процедуры (физиотерапия, массаж и др.). Не менее, чем за 8 часов (но не более 14 часов) до взятия крови отказаться от приема пищи и напитков, за исключением питьевой воды. Последний перед взятием крови прием пищи – легкий. За 1 час до взятия крови не курить. Перед взятием крови необходимо пребывание в состоянии покоя не менее 20 минут. При подготовке к взятию крови на фоне медикаментозной терапии прием или отмену лекарственных препаратов следует согласовывать с лечащим врачом.
Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды
Синтез стероидов коры надпочечников. Минералокортикоиды и глюкокортикоиды
а) Пути синтеза стероидов коры надпочечников. На рисунке ниже представлены основные этапы образования важнейших адреналовых стероидов: альдостерона, кортизола и андрогенов.

Пути синтеза стероидных гормонов коры надпочечников. Ферменты выделены серым фоном
Главными органоидами клетки, где осуществляются процессы стероидогенеза, являются митохондрии и эндоплазматический ретикулум. Изменение в схеме даже одного фермента приводит к громадным вариациям как количества синтезируемого гормона определенного типа, так и относительной представленности разных видов гормонов. Так, изменение активности единственного фермента ведет к продукции огромного количества половых гормонов и маскулинизации организма наряду с появлением стероидов, в норме отсутствующих в крови.
На рисунке выше сопоставлены химические формулы альдостерона и кортизола — двух важнейших минерало- и глюкокортикоидов. Кортизол имеет кетогруппу у углерода в третьем положении, гидроксилированный углерод — в одиннадцатом и двадцать первом. У альдостерона восемнадцатый по счету углерод связан с кислородом.
В норме дополнительно к альдостерону и кортизолу корой надпочечников синтезируются и другие стероиды с минерало- и глюкокортикоидной активностью. Созданы препараты, которые в норме не продуцируются надпочечниками, но обладают активностью стероидных гормонов и используются в терапии различных состояний. Сведения о некоторых наиболее важных кортикостероидах, включая синтетические, систематизированы в таблице ниже.

Минералокортикоиды:
- Альдостерон (очень активен, обеспечивает почти 90% всей минералокортикоидной активности).
- Дезоксикортикостерон (активность соответствует 1/30 активности альдостерона, секретируется в очень малом количестве). Кортикостерон (обладает слабой минералокортикоидной активностью). - 9-флюорокортизол (синтетический, немного более активен, чем альдостерон). - Кортизол (обладает чрезвычайно слабой минералокортикоидной активностью, но синтезируется в большом количестве). - Кортизон (синтетический, слабая минералокортикоидная активность).
Глюкокортикоиды:
- Кортизол (очень активен, обеспечивает почти 95% общей глюкокортикоидной активности). - Кортикостерон (обеспечивает около 4% общей глюкокортикоидной активности, существенно менее активен, чем кортизол). - Кортизон (синтетический, почти так же активен, как и кортизол).
- Преднизон (синтетический, в 4 раза активнее кортизола).
- Метилпреднизон (синтетический, в 5 раз активнее преднизона).
- Дексаметазон (синтетический, в 30 раз активнее кортизона).
Очевидно, что некоторые из вышеприведенных гормонов обладают как глюко-, так и минералокортикоидной активностью. Особенно важно: кортизол, обладающий слабой минералокортикоидной активностью, ввиду громадной его продукции при некоторых синдромах может вызывать минералокортикоидные ответы наряду с более выраженными глюкокортикоидными влияниями.
Видео физиология гормонов надпочечника - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Надпочечники
Надпочечники – парные органы, относимые к эндокринной системе. Благодаря синтезу гормонов надпочечники играют важнейшую роль в регуляции множества функций организма, в том числе, в адаптационно-приспособительных реакциях, направленных на сохранение нормальной жизнедеятельности организма собаки и кошки в меняющихся условиях внешней среды и под воздействием различных неблагоприятных патогенных факторов.

Расположение надпочечников
Анатомически в надпочечниках (правом и левом) выделяют капсулу органа и рабочую ткань – паренхиму, формируемую корковым и мозговым веществом надпочечников, причем в этих двух слоях синтезируются гормоны разных групп и действия, по причине чего возможно рассмотрение коры и мозгового вещества надпочечника как двух разных эндокринных образований.
В корковом веществе надпочечников, состоящем из трех функционально различных слоев, происходит синтез стероидных гормонов нескольких групп – минералокортикоидов, глюкокортикоидов, а также половых гормонов. Минералокортикоиды образуются в клубочковом слое коры надпочечников. Основными минералокортикоидами, названными так по причине воздействия на минеральный и водный обмены, являются альдостерон и 1-дезоксикортикостерон. В результате попадания их в кровоток и воздействия на чувствительные к ним ткани возникает эффект, прямо противоположный эффекту антидиуретического гормона, а именно – увеличение потерь жидкости с мочой. Последнее обусловлено тем, что минералокортикоиды вызывают задержку натрия (и увеличение выведения калия) в организме собак и кошек, по причине чего происходит перемещение жидкости из внутриклеточного и внеклеточного пространства в кровеносное русло и увеличение скорости клубочковой фильтрации за счет повышения кровяного давления.
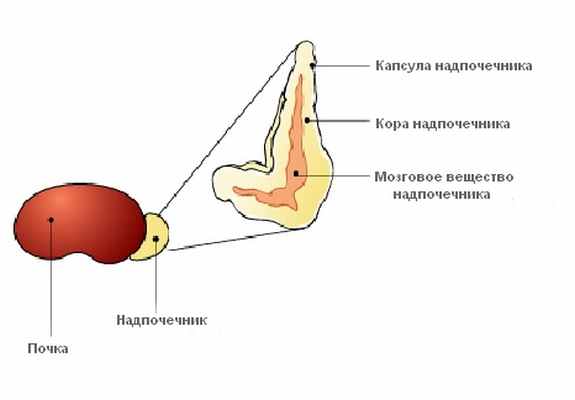
Строение надпочечника
Образование минералокортикоидов в клубочковом слое коры надпочечников находится под влиянием синтезируемого в почках ренина, выделение которого увеличивает функциональную активность верхнего слоя коркового вещества, ответственного за выработку и выведение минералокортикоидов. Снижение уровня их секреции обусловливается повышенным уровнем натрия в кровеносном русле и приводимым в действие механизмом отрицательной обратной связи.
Синтез глюкокортикоидов протекает в среднем слое коры надпочечников, именуемом пучковой зоной. К этому типу гормонов относят кортизол, кортикостерон и кортизон, причем первые два являются превалирующим видом вырабатываемых в коре надпочечников глюкокортикоидов. Эти гормоны являются важнейшими регуляторами углеводного обмена, неся функцию увеличения уровня трансформации белков (усиление процессов белкового распада) в углеводы и отложения последних в печени в виде запасов гликогена.
После выхода в кровеносное русло глюкокортикоиды связываются в крови с молекулами белков. Это необходимо для того, чтобы функциональная активность гормонов проявилась только после достижения ими с током крови органов-мишеней, в которых они освобождаются от белка-переносчика (для кортизола таковым служит транскортин, относимый к классу альфа-глюкопротеинов). Активизация белково-углеводного обмена ведет к повышению уровня глюкозы в крови и, в некоторых случаях (при сильном увеличении количества эндогенных (синтезируемых надпочечниками) или экзогенных (вводимых в организм собаки в составе лекарственных препаратов) глюкокортикоидов), к развитию глюкозурии – выведения глюкозы с мочой, что является отклонением от нормы.
Помимо активизации белкового распада под действием глюкокортикоидов увеличивается и интенсивность распада жиров, что происходит, как правило, в том случае, если снижается уровень глюкозы в крови собаки. Одним же из наиболее явных эффектов глюкокортикоидов является противовоспалительный. Он обеспечивается путем снижения проницаемости стенок сосудов и, как следствие, экссудации выпота во внесосудистое пространство. Угнетается активность лейкоцитов, снижается их количество. Последнее обусловлено значительным уменьшением активности всей лимфоидной системы – так, при чрезмерной стимуляции коры надпочечников или же длительном экзогенном введении кортикостероидов фиксируется преждевременная инволюция тимуса (у молодых животных, тимус которых еще находится на пике своей активности), уменьшение в размерах селезенки и лимфатических узлов.
Глюкокортикоиды производят и множество других эффектов, изменяя функционирование многих органов и тканей организма, в которых имеются рецепторы к ним. Синтез же их регулируется адренокортикотропным гормоном, продуцируемым передним отделом гипофиза – аденогипофизом – под влиянием нейросекреторных ядер гипоталамуса, в которых синтезируются вещества, получившие название либеринов и статинов, первые из которых повышают активность гипофиза и, как следствие, периферических желез внутренней секреции, в том числе – надпочечников, в то время как вторые – напротив, снижают. Повышенный уровень глюкокортикоидов в крови собаки или кошки служит ограничивающим для секреции адренокортикотропного гормона фактором, что обеспечивает естественную регуляцию их синтеза в зависимости от потребностей организма.
В третьем слое коры надпочечников, называемом сетчатой зоной и граничащим с мозговым веществом органа, происходит синтез половых гормонов, действие которых аналогично производимому половыми гормонами, выделяемым парными половыми железами (семенниками – у кобелей и котов и яичниками – у сук и кошек), однако, намного менее сильное по причине низкой активности половых стероидов коры надпочечников. К мужским половым гормонам, производимым в сетчатой зоне, относятся андростендион и его производные, в то время как к женским – эстрадиол, эстрон и другие эстрогены.
Также в коре надпочечников осуществляется синтез прогестерона, аналогичного прогестерону желтого тела – гормону, необходимому для нормального протекания беременности. Выработка половых стероидов, также как и глюкокортикоидов, осуществляется под контролем гормонов гипофиза, а именно – фолликулостимулирующего и лютеинизирующего гормонов, синтез которых контролируется гипоталамусом (подобная система контроля получила название гипоталамо-гипофизарно-надпочечниковой, так как активность надпочечников зависит от выделения тропных гормонов гипофизом, что, в свою очередь, напрямую регулируется синтезом либеринов или статинов в нейросекреторных ядрах гипоталамуса).
В мозговом же веществе надпочечников осуществляется выработка норадреналина и адреналина – гормонов, именуемых катехоламинами. Они также играют огромную роль в ответе организма на воздействие неблагоприятных факторов внешней среды, обеспечивая перестройку организма и повышение активности всех жизненно-важных систем организма с целью обеспечения наиболее быстрого адаптационного ответа при влиянии чрезмерных раздражителей. В целом, катехоламины вызывают снижение притока крови к коже и большинству внутренних органов, не являющихся жизненно важными, и увеличение уровня кровоснабжения головного мозга, сердца (сердечной мышцы) и скелетной мускулатуры.
За счет сужения сосудов второстепенных органов происходит выход депонированной в них крови (основную роль депо играют кожа, селезенка, печень; кровоснабжение последней, однако, под действием катехоламинов сильно увеличивается). Число сердечных сокращений и их сила, интенсивность дыхательных движений также увеличиваются, обеспечивая более высокий уровень оксигенации (насыщения кислородом) крови. Влияние норадреналина и адреналина обеспечивается путем взаимодействия этих биологически активных веществ с альфа- и бета-рецепторами, расположенными в различных органах и тканях. Синтез катехоламинов в мозговом веществе надпочечников регулируется как гуморальными механизмами (зависит от уровня глюкозы в крови – усиливается при гипогликемии), так и нервной системой, а именно – симпатической ее частью (нервами, окончания которых находятся в стенках сосудов и влияют на их тонус).
В целом же, оба слоя паренхимы надпочечников – как корковый, так и мозговой, обеспечивают путем выделения соответствующих гормонов в кровь приспособление организма собаки и кошки к неблагоприятным условиям внешней среды, необходимое для повышения уровня выживаемости отдельно взятых индивидов.
Адреногенитальный синдром
Адреногенитальный синдром (АГС) также известен как врожденная дисфункция коры надпочечников (ВДКН) или врожденная гиперплазия коры надпочечников (ВГКН). Синдром объединяет заболевания с аутосомно-рецессивным типом наследования, в основе которых лежит дефект одного из ферментов метаболического пути синтеза стероидов.
Заболевание вызвано наследственным дефицитом ферментов, которые локализованы в коре надпочечников. Гормоны коры надпочечников включают минералокортикоиды (альдостерон), глюкокортикоиды (кортизол) и половые стероиды (тестостерон и эстроген). Синдром возникает, когда дефицит фермента приводит к снижению надпочечникового синтеза глюкокортикоидов. Происходит снижение ингибирующего влияния гормонов коры надпочечников на гипофиз, поэтому синтез и секреция адренокортикотропного гормона (АКТГ) увеличивается по механизму отрицательной обратной связи. АКТГ стимулирует увеличение размеров надпочечников и выработку ими промежуточных субстратов. Включаясь в другие пути синтеза, метаболиты вызывают повышение уровней других гормонов коры надпочечников — минералокортикоидов или андрогенов. Измененные уровни минералокортикоидов и половых гормонов приводят к аномалиям электролитного соотношения, проблемам с дифференциацией пола и другим признакам, и симптомам, в зависимости от дефицита фермента и его степени.
Частота встречаемости заболевания от 1:5000 до 1:67000.
Характеристика заболевания
ВГКН является одним из самых распространенных наследственных моногенных заболеваний, одновременно представляет собой вариант хронической первичной надпочечниковой недостаточности и группу патологии полового развития, а также половой дифференцировки. АГС включен в программу «Национальные приоритетные проекты» и введен в неонатальный скрининг. АГС в стертой (неклассической) форме является одной из причин нарушения репродуктивного здоровья (бесплодие, невынашивание беременности).
Дефект 21-гидроксилазы: классификация и клинические проявления
Ген CYP21, кодирующий фермент 21-гидроксилазу, локализован на коротком плече 6-й хромосомы. Описано более пятидесяти мутаций этого гена, приводящих к синтезу фермента со степенью активности от 0 до 60 %.
Патогенетической сущностью синдрома является нарушение процесса перехода 17-гидроксипрогестерона и 11-дезоксикортикостерона в 11-дезоксикортизол (рис 1). Развивается гормональная дисфункция, которая сводится к снижению синтеза кортизола альдостерона и избыточному накоплению предшественников кортизола. Избыток прегненолона, прогестерона, 17-гидроксипрогестерона конвертируется в надпочечениковые андрогены.
Рис.1. Недостаточность 21-гидроксилазы. Штриховкой выделены стероиды, синтез которых заблокирован.
Так происходит угнетение выработки одних кортикостероидов при одновременном увеличении выработки других, вследствие дефицита того или иного фермента, обеспечивающего один из этапов стероидогенеза.
- дефицит 21-гидроксилазы с сольтеряющим синдромом;
- простая вирильная форма (неполный дефицит 21-гидроксилазы);
- неклассическая форма (постпубертатная).
Симптомы недостаточности 21-гидроксилазы
При классической вирильной форме адреногенитального синдрома, наружные половые органы у девочек сформированы по гетеросексуальному типу — гипертрофирован клитор, большие половые губы напоминают мошонку, вагина и уретра представлены урогенитальным синусом. У новорождённых мальчиков явных нарушений выявить не удаётся. С 2–4 лет у детей обоего пола появляются другие симптомы адреногенитального синдрома, то есть андрогенизации: формируется подмышечное и лобковое оволосение, развивается скелетная мускулатура, грубеет голос, маскулинизируется фигура, появляются юношеские угри на лице и туловище. В пубертатном периоде у девочек не растут молочные железы, не появляются менструации. При этом ускоряется дифференцировка скелета, и зоны роста закрываются преждевременно, это обусловливает низкорослость.
При сольтеряющей форме 21-гидроксилазной недостаточности, помимо вышеописанных симптомов, у детей с первых дней жизни отмечают признаки надпочечниковой недостаточности. Появляются вначале срыгивания, затем рвоты, возможен жидкий стул. Ребёнок быстро теряет массу тела, развиваются симптомы дегидратации, нарушения микроциркуляции, снижается артериальное давление, начинается тахикардия, возможна остановка сердца вследствие гиперкалиемии.
Неклассическая форма адреногенитального синдрома характеризуется ранним появлением вторичного оволосения, ускорением роста и дифференцировки скелета. У девочек пубертатного возраста возможны умеренные признаки гирсутизма, нарушения менструального цикла (первый цикл может запаздывать или начаться раньше времени). В позднем возрасте при небольших дефектах гена на адреногенитальный синдром может указывать наличие бесплодия в анамнезе. Менструальный цикл может быть нерегулярным и иметь тенденцию к задержке. Невынашивание беременности при адреногенитальном синдроме встречается у четверти женщин с дефектным геном.
- женщинам с диагнозом «замершая эмбриональная беременность»;
- женщинам с привычным невынашиванием беременности;
- женщинам с диагнозом СПКЯ неустановленной этиологии;
- девушкам пубертатного возраста с проявлениями неклассической формы ВДКН: олигоменореей, гирсутизмом, акне и интерсексуальным типом телосложения;
- девочкам младшего возраста с вирилизацией наружных гениталий для дифференциальной диагностики ВДКН с идиопатической врожденной вирилизацией наружных гениталий;
- детям младшего возраста (2–4 года) с признаками преждевременного полового созревания по мужскому типу для дифференциальной диагностики вирильной формы ВДКН с надпочечниковой недостаточностью, гермафродитизмом другого генеза, различными вариантами преждевременного полового созревания и андрогенпродуцирующей опухолью надпочечников.
40.131 Анализ полиморфизмов гена стероид-21-гидролаза (CYP21,9 точек) (адреногенитальный синдром)
Читайте также:
