Ямка диска зрительного нерва
Обновлено: 18.04.2024
Ямки диска зрительного нерва (ДЗН) представляют собой моно- или билатеральную врожденную аномалию в виде углублений различного размера в ДЗН, которые в половине случаев сопровождаются развитием таких осложнений, как отек, центральная отслойка сетчатки и ретиношизис, и вызывают снижение зрительных функций. При этом уменьшение остроты зрения может быть как незначительным, так и выраженным. Несмотря на многочисленные исследования ямок ДЗН в течение последних полутора веков, их этиология до сих пор изучена слабо. Однако в настоящее время развитие цифровых технологий сканирования и обработки данных, а также появление неинвазивных высокоинформативных методов диагностики дали возможность выявления не только гистологических изменений ДЗН на кадаверных глазах, но и его структурно-функциональных изменений in vivo.
Ключевые слова
Об авторах
Иркутский филиал ФГАУ НМИЦ «МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова» Минздрава России
Россия
Елена Викторовна Мускатина — врач-офтальмолог диагностического отделения
ул. Лермонтова, д. 337, Иркутск, 664033
Иркутский филиал ФГАУ НМИЦ «МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова» Минздрава России; ФГБОУ ВО «Иркутский государственный медицинcкий университет» Минздрава России
Россия
Дмитрий Юрьевич Самсонов — канд. мед. наук, врач-офтальмолог диагностического отделения, врач-офтальмолог
ул. Лермонтова, д. 337, Иркутск, 664033
ул. Красного Восстания, д. 1, Иркутск, 664003
Иркутский филиал ФГАУ НМИЦ «МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова» Минздрава России
Россия
Светлана Ивановна Жукова — канд. мед. наук, заведующая диагностическим отделением
ул. Лермонтова, д. 337, Иркутск, 664033
Иркутский филиал ФГАУ НМИЦ «МНТК "Микрохирургия глаза" им. акад. С.Н. Федорова» Минздрава России; Иркутская государственная академия постдипломного образования — филиал ФГБОУ ДПО РНМАПО Минздрава России; ФГБОУ ВО «Иркутский государственный медицинcкий университет» Минздрава России
Россия
Андрей Геннадьевич Щуко — д-р мед. наук, профессор, директор, зав. кафедрой офтальмологии, зав. кафедрой глазных болезней
ул. Лермонтова, д. 337, Иркутск, 664033
мкр-н Юбилейный, д. 100, Иркутск, 664049
ул. Красного Восстания, д. 1, Иркутск, 664003
Список литературы
1. Wiethe T. Ein Fall von Angeborener Difformitat der Sehnervenpapille. Arch. F. Augenh. 1882; 11: 14–9.
2. Petersen H.P. Pits or crater-like holes in the optic disc. Acta Ophthalmol. 1958; 36 (3): 435–43. doi: 10.1111/j.1755-3768.1958.tb00817.x
3. Edmund C. Two rare cases of neuroretinitis albuminurica. Acta Ophthalm. Copenh. 1930; 8: 56. doi: 10.1111/j.1755-3768.1930.tb06183.x
6. Apple D.J., Rabb M.F., Walsh P.M. Congenital anomalies of the optic disc. Surv. Ophthalmol. 1982; 27 (1): 3–41. doi: 10.1016/0039-6257(82)90111-4
8. Kranenburg E.W. Crater-like holes in the optic disc and central serous retinopathy. Arch. Ophthalmol. 1960; 64: 912–24. doi: 10.1001/ archopht.1960.01840010914013
9. Meyer C.H., Rodrigues E.B. Optic disc pit maculopathy after blunt ocular trauma. Eur. J. Ophthalmol. 2004; 14 (1): 71–3. doi: 10.1177/112067210401400114
11. Meyer C.H., Rodrigues E.B., Schmidt J.C. Congenital optic nerve head pit associated with reduced retinal nerve fibre thickness at the papillomacular bundle. Br. J. Ophthalmol. 2003; 87 (10): 1300–1. doi:10.1136/bjo.87.10.1300-a
12. Sugar H.S. An explanation for the acquired macular pathology associated with congenital pits of the optic disc. Am. J. Ophthalmol. 1964 May; 57: 833–5. PMID:14167198
13. Sugar H.S. Congenital pits of the optic disc. Am. J. Ophthalmol. 1967 Feb; 63: 298–9. PMID: 4959901
15. Ohno-Matsui K., Akiba M., Moriyama M., et al. Imaging the retrobulbar subarachnoid space around the optic nerve by swept source optical coherence tomography in eyes with pathologic myopia. Invest. Ophthalmol. Vis. Sci. 2011; 52: 9644–6. doi: 10.1167/iovs.11-8597
16. Ohno-Matsui K., Hirakata A., Inoue M., Akiba M., Ishibashi T. Evaluation of congenital optic disc pits and optic disc colobomas by swept-source optical coherence tomography. Invest. Ophthalmol. Vis. Sci. 2013; 54 (12): 7769–78. doi: 10.1167/iovs.13-12901
17. Vedantham V. Double optic discs, optic disc coloboma, and pit: spectrum of hybrid disc anomalies in a single eye. Arch. Ophthalmol. 2005; 123: 1450–2. doi:10.1001/archopht.123.10.1450
18. Michalewski J., Michalewska Z., Nawrocki J. Spectral domain optical coherence tomography morphology in optic disc pit associated maculopathy. Indian J. Ophthalmol. 2014; 62 (7): 777–81. doi: 10.4103/0301-4738.138184
19. Skaat A., Moroz I., Moisseiev J. Macular detachment associated with an optic pit: Optical coherence tomography patterns and surgical outcomes. Eur. J. Ophthalmol. 2013; 23: 385–93. doi: 10.5301/ejo.5000230
20. Ishikawa K., Terasaki H., Mori M., Sugita K., Miyake Y. Optical coherence tomography before and after vitrectomy with internal limiting membrane removal in a child with optic disc pit maculopathy. Jpn. J. Ophthalmol. 2005; 49: 411–3. doi: 10.1007/s10384-004-0225-1
21. Krivoy D., Gentile R., Liebmann J.M., et al. Imaging congenital optic disc pits and associated maculopathy using optical coherence tomography. Arch. Ophthalmol. 1996; 114 (2): 165–70. doi: 10.1001/archopht.1996.01100130159008
23. Chatziralli I., Theodossiadis P., Theodossiadis G. Optic disk pit maculopathy: current management strategies. Clinical Ophthalmology. 2018; 12: 1417–5. doi:10.2147/opth.s153711
24. Rapizzi E., Gallon P., Ponzin D., Ferrari S., Zemella N.A Conservative surgical approach to the treatment of optic disc pit maculopathy: four case reports. Case Reports in Ophthalmology. 2020; 196–204. doi:10.1159/000507880
25. Kalogeropoulos D., Ch'ng S.W., Lee R., et al. Optic disc pit maculopathy: a review. Asia-pacific Journal of Ophthalmology (Philadelphia, Pa.). 2019; 8 (3): 247–8. doi: 10.22608/apo.2018473
26. Zheng A, Singh R.P., Lavine J.A. Surgical options and outcomes in the treatment of optic pit maculopathy: a meta-analysis and systematic review. Ophthalmol. Retina. 2020; 4 (3): 289–10. doi: 10.1016/j.oret.2019.10.011
27. Kuhn F., Kover F., Szabo I., Mester V. Intracranial migration of silicone oil from an eye with optic pit. Graefes Arch. Clin. Exp. Ophthalmol. 2006; 244 (10): 1360–2. doi: 10.1007/s00417-006-0267-9
28. Lincoff H., Lopez R., Kreissig I., Yannuzzi L., Cox M., Burton T. Retinoschisis associated with optic nerve pits. Arch. Ophthalmol. 1988; 106 (1): 61–7. doi: 10.1001/archopht.1988.01060130067030
29. Ferry A.P. Macula detachment associated with congenital pit of the optic nerve head. Arch. Ophthalmol. 1963; 70: 346–11.
30. Gass J.D.M. Serous detachment of the macula secondary to congenital pit of the optic nerve head. Am. J. Ophthalmol. 1969; Jun; 67 (6): 821–41. doi: 10.1016/0002-9394(69)90075-0
31. Greear J.N. Pits, or crater-like holes in the optic disc. 1942; 28 (3): 467–83. doi:10.1001/archopht.1942.00880090099006
33. Brockhurst R.J. Optic pits and posterior retinal detachment. Trans. Am. Ophthalmol. Soc. 1975; 73: 264–27. PMID:1246808
34. Gass J. Stereoscopic atlas of macular disease. 4th ed. St Louis: Mosby; 1997.
37. Akiba J., Kakehashi A., Hikichi T., Trempe C.L. Vitreous findings in cases of optic nerve pits and serous macular detachment. Am. J. Ophthalmol. 1993 Jul 15; 116 (1): 38–41. doi: 10.1016/s0002-9394(14)71741-6
38. Skaat A., Moroz I., Moisseiev J. Macular detachment associated with an optic pit: optical coherence tomography patterns and surgical outcomes. Eur. J. Ophthalmol. 2013; 23 (3): 385–93. doi: 10.5301/ejo.5000230
39. Tzu J.H., Flynn H.W.Jr., Berrocal A.M., Smiddy W.E., et al. Clinical manifestations of optic pit maculopathy as demonstrated by spectral domain optical coherence tomography. Clin. Ophthalmol. 2013; 7: 167–172. doi:10.2147/OPTH.S37157
40. Ohno-Matsui K., Akiba M., Moriyama M., et al. Acquired optic nerve and peripapillary pits in pathologic myopia. Ophthalmology. 2012; 119 (8): 1685–92. doi: 10.1016/j.ophtha.2012.01.047
41. Curtin B.J. The posterior staphyloma of pathologic myopia. Trans. Am. Ophthalmol. Soc. 1977; 75: 67–86. PMID: 613534
42. Cashwell L.F., Ford J.G. Central visual field changes associated with acquired pits of the optic nerve. Ophthalmology. 1995 Sep; 102 (9): 1270–8. PMID: 9097763
43. Healey P.R., Mitchell P. The prevalence of optic disc pits and their relationship to glaucoma. Journal of Glaucoma. 2008; 17 (1): 11–3. doi: 10.1097/ijg.0b013e318133fc34
44. Hsiang H.W., Ohno-Matsui K., Shimada N., et al. Clinical characteristics of posterior staphyloma in eyes with pathologic myopia. Am. J. Ophthalmol. 2008; 146 (1): 102–8. doi: 10.1016/j.ajo.2008.03.010
46. Xu L., Li Y., Wang S., et al. Characteristics of highly myopic eyes: the Beijing Eye Study. Ophthalmology. 2007; 114 (1): 121–6. doi: 10.1016/j.ophtha.2006.05.071
47. Choi Y.J., Lee E.J., Kim B.H., Kim T.W. Microstructure of the optic disc pit in open-angle glaucoma. Ophthalmology. 2014; 121 (11): 2098–8. doi:10.1016/j.ophtha.2014.06.005
48. Lee S.H., Lee E.J., Kim T.W. Structural characteristics of the acquired optic disc pit and the rate of progressive retinal nerve fiber layer thinning in primary openangle glaucoma. JAMA Ophthalmol. 2015; 133 (10): 1151–8. doi: 10.1001/jamaophthalmol.2015.2453
49. Healey P., Mitchell P. The prevalence of optic disc pits and their relationship to glaucoma. Journal of glaucoma. 2008; 17 (1): 11–4. doi: 10.1097/IJG.0b013e318133fc34
50. Nduaguba C., Ugurlu S., Caprioli J. Acquired pits of the optic nerve in glaucoma: prevalence and associated visual field loss. Acta Ophthalmol. Scand. 1998; 76 (3): 273–4.
52. Faridi O.S., Park S.C., Kabadi R., et al. Effect of focal lamina cribrosa defect on glaucomatous visual field progression. Ophthalmology. 2014; 121 (8): 1524–30. doi: 10.1016/j.ophtha.2014.02.017
53. Oh J.Y., Park K.H. Analysis of optic disc change using the Heidelberg Retina Tomograph in an acquired pit of the optic nerve. Ophthalmic Surg. Lasers Imaging. 2004 Jul-Aug; 35 (4): 325–7. PMID: 15305557
54. Simpson D.E. Optic nerve pit. J. Am. Optom. Assoc. 1987 Feb; 58: 118–2. PMID: 3819294
Оптическая когерентная томография в диагностике ямки диска зрительного нерва

Ямка диска зрительного нерва — врождённая аномалия, представляющая собой круглый или овальный участок углубления в диске зрительного нерва (ДЗН) размером 0,1–0,7 диаметра ДЗН, расположенный преимущественно по его нижне-темпоральному краю. Приблизительно в 45–75 % глаз с врождённой ямкой ДЗН развивается серозная отслойка нейроэпителия в макулярной зоне, что может стать причиной ошибочной постановки диагноза внутриглазного новообразования. В статье представлен клинический случай ямки ДЗН, потребовавший проведения дифференциальной диагностики с внутриглазной опухолью. Показано, что ОКТ-признаками ямки ДЗН являются связь структур ДЗН с субретинальным пространством, а также наличие признаков инвагинации слоя нервных волокон сетчатки в структуре ДЗН.
Ключевые слова
Полный текст
Ямка диска зрительного нерва — врождённая аномалия, представляющая собой ограниченное углубление в диске зрительного нерва (ДЗН), встречается с частотой 1 : 11 000 населения, одинаково часто выявляется у мужчин и женщин преимущественно на третьей-четвёртой декаде жизни [1, 2].
Впервые подобное состояние описал T. Wiethe в 1882 г. Как правило, ямки ДЗН бывают односторонними, однако в 15 % случаев патология носит билатеральный характер [1–3].
Офтальмоскопически ямка ДЗН выглядит как круглый или овальный участок углубления размером 0,1–0,7 диаметра ДЗН, расположенный преимущественно по его нижне-темпоральному краю. В 1 /3 случаев ямка локализуется в центре ДЗН. В большинстве случаев (60 %) ямки имеют серый цвет, реже — жёлтый (30 %) или чёрный (10 %) [1–5]. Вопрос патогенеза формирования ямки ДЗН до сих пор остаётся открытым. Большинство авторов считает, что ямка ДЗН формируется вследствие неполного закрытия эмбриональной щели зрительного нерва и чаще всего развивается в первом триместре беременности. Формирование её объясняют внедрением рудиментарной сетчатки в межоболочечное пространство зрительного нерва [3, 4, 6].
Гистологически ямка ДЗН представляет собой грыжевидное выпячивание элементов нейросенсорной сетчатки в области дефекта решётчатой пластинки склеры. Ретинальные волокна опускаются внутрь ямки, затем возвращаются и выходят перед входящим зрительным нервом. Показано, что ямки сообщаются с субарахноидальным пространством [1, 2, 7].
Заболевание может протекать как бессимптомно, так и с изменениями в полях зрения (расширение слепого пятна, формирование парацентральной аркуатной скотомы) [2].
Приблизительно в 45–75 % глаз с врождённой ямкой ДЗН развивается серозная отслойка нейроэпителия (ОНЭ) в макулярной зоне, получившая название «макулопатия, ассоциированная с ямкой ДЗН» [1, 2, 4].
Существует несколько теорий происхождения суб- или интраретинальной жидкости. Её возможными источниками могут быть жидкость из стекловидного тела, цереброспинальная жидкость из субарахноидального пространства, а также жидкая фракция крови, просачивающаяся из сосудов у основания ямки или из сосудов хориоидеи [1, 2, 8]. Существует теория, что при ямках ДЗН имеется взаимосвязь между полостью стекловидного тела, субретинальным и субарахноидальным пространствами и орбитой за счёт порозной структуры и неполной дифференцировки тканей грыжевидного выпячивания [7].
Я.В. Байбородовым и А.С. Измайловым описан клапанно-диафрагмальный механизм формирования ОНЭ при ямках ДЗН. По данным авторов, полученным при проведении витрэктомии по поводу данного заболевания, дно ямки ДЗН представляет собой клапан, который раскрывается при создании искусственной гипотонии и закрывается, углубляясь внутрь ямки ДЗН, при создании гипертензии. Клапан открывался и закрывался синхронно с пульсом: открытие — в период систолы, закрытие — в период диастолы [9].
Для диагностики ямки ДЗН помимо офтальмоскопии применяют флюоресцентную ангиографию (ФАГ) и оптическую когерентную томографию (ОКТ), в том числе в режиме исследования с увеличенной глубиной сканирования (EDI — enhanced depth imaging (Heidelber Engeneering) или DRI — deep range imaging (Topcon)).
В артериальной и артериовенозной фазах ФАГ определяют постепенно нарастающее просачивание флюоресцеина в зоне отслойки нейроэпителия по направлению к макуле. В ранней фазе ФАГ или индоцианиновой ангиографии ямка диска обычно не пропускает контрастное вещество. В поздней фазе ФАГ или индоцианиновой ангиографии происходит гиперфлюоресценция ямки диска и области макулопатии [1].
При ОКТ-исследовании можно выявить связь между периневральным и суб- и/или интраретинальным пространством, наличие мембраны на дне экскавации ДЗН [4, 10]. Могут быть обнаружены также гипорефлективные полости под ДЗН, которые представляют собой скопление периневральной жидкости, которая не перешла в суб- и/или интраретинальное пространство, или скопление жидкости ниже мембраны Эльшнига [10].
Дифференцировать макулопатию, ассоциированную с ямкой ДЗН, следует с другими серозными отслойками макулы, в первую очередь с центральной серозной хориопатией. В некоторых случаях возникает необходимость в дифференциации ямки с перипапиллярными новообразованиями хориоидеи. В литературе даже описаны случаи энуклеации глаза в связи с ошибочной постановкой диагноза беспигментной меланомы хориоидеи [11].
Мы имели возможность наблюдать пациентку с ямкой ДЗН, которая была направлена на консультацию с подозрением на новообразование хориоидеи.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка Б., 39 лет, обратилась в ФГБНУ НИИГБ с жалобами на снижение зрения правого глаза в течение 20 лет. Диагноза, установленного ранее, пациентка не знала, выписки отсутствовали.
Острота зрения правого глаза — 0,02 н/к; левого — 1,0. Офтальмоскопически юкстапапиллярно по меридианам 4.30–9.00 часов выявлен слабопигментированный, пятнистый, слегка проминирующий очаг с чёткими границами, 3,5 ДД. Темпоральный край ДЗН слегка уплощён с участками пигментации (рис. 1).

Рис. 1. Фотография глазного дна пациентки Б. (границы отслойки нейроэпителия указаны стрелками)
Fig. 1. Fundus photo (arrows — neuroepithelium detachment borders)
При проведении ОКТ в макулярной зоне выявлена высокая протяжённая ОНЭ (рис. 2).

Рис. 2. Исходные результаты ОКТ пациентки Б. Горизонтальный и вертикальный срезы через макулярную зону
Fig. 2. Baseline OCT results of patient B. Horizontal and vertical scans through the macular area
С целью уточнения этиологии ОНЭ и проведения дифференциальной диагностики с внутриглазным новообразованием пациенте была проведена ФАГ.
В раннюю фазу исследования в зоне интереса визуализированы неизменённые хориоидальные сосуды, что свидетельствует об атрофии ретинального пигментного эпителия. Темпоральный край ДЗН в раннюю и среднюю фазы ФАГ оставался гипофлюоресцирующим. К поздним фазам, наряду с нарастанием гиперфлюоресценции в зоне интереса (за счёт накопления красителя под ОНЭ), появлялось просачивание красителя по нижне-темпоральному краю ДЗН (рис. 3).

Рис. 3. ФАГ пациентки Б. Ранняя (a), средняя (b) и поздняя (c) фазы (синие стрелки — граница зоны отслойки нейроэпителия, зелёная стрелка — участок просачивания красителя по краю диска зрительного нерва)
Fig. 3. Fluorescein angiography of patient B. Early phase (a), mid-phase (b) and late phase (c) (blue arrows – neuroepithelium detachment borders, green arrow – fluorescein leakage point at the optic disc margin)
Выявленные по ФАГ изменения позволили заподозрить у пациентки ямку ДЗН, осложнённую макулопатей. При повторной ОКТ, в том числе в режиме EDI (OCT Spectrais, Heidelberg Engineering, Германия), обнаружены высокая ОНЭ в центральной зоне и атрофия ретинального пигментного эпителия. Толщина хориоидеи в центральной зоне не изменена, однако было отмечено увеличение калибра крупных сосудов хориоидеи и уменьшение калибра хориокапилляров (рис. 4).

Рис. 4. ОКТ пациентки Б. Вертикальный срез через центр фовеолы
Fig. 4. OCT of patient B. Vertical scan across the foveolar center
В зоне наибольшей высоты ОНЭ также не было выявлено увеличения толщины хориоидеи, однако имело место аналогичное изменение её структуры (рис. 5).

Рис. 5. ОКТ пациентки Б. Горизонтальный срез через зону максимальной высоты отслойки нейроэпителия
Fig. 5. OCT of patient B. Horizontal scan across the area of neuroepithelium detachment’s maximal height
При исследовании области ДЗН с темпоральной стороны обнаружена связь ОНЭ со структурами ДЗН, в той же зоне наблюдалась инвагинация слоя нервных волокон сетчатки (СНВС) в структуры ДЗН, что позволило подтвердить диагноз ямки ДЗН (рис. 6).
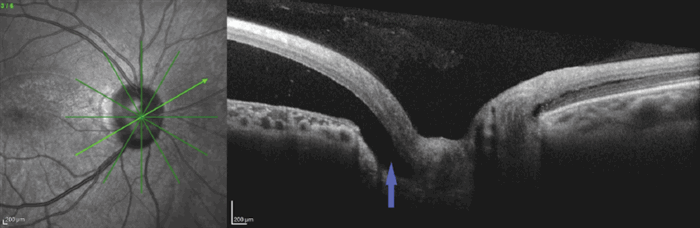
Рис. 6. ОКТ пациентки Б. Радиальный срез через центр экскавации диска зрительного нерва (стрелка — связь отслойки нейроэпителия со структурами диска зрительного нерва)
Fig. 6. OCT of patient B. Radial scan across the optic disc cup center (arrow – connection of neuroepithelium detachment with optic disc structures)
В зоне, соответствующей участку гиперфлюоресценции по данным ФАГ, также был выявлен дефект СНВС на дне экскавации (рис. 7).

Рис. 7. ОКТ пациентки Б. Вертикальный срез через центр экскавации диска зрительного нерва (стрелка — зона дефекта слоя нервных волокон сетчатки на дне экскавации)
Fig. 7. OCT of patient B. Vertical scan across the optic disc cup center (arrow – area of the retinal nerve fiber layer defect at the cup bottom)
ЗАКЛЮЧЕНИЕ
Ямка ДЗН — врождённая патология, сопровождающаяся развитием серозной ОНЭ в центральной зоне сетчатки, что требует проведения дифференциальной диагностики с другими макулопатиями. Даже при типичной офтальмоскопической картине в ряде случаев может возникнуть необходимость проведения дифференциального диагноза с внутриглазными новообразованиями юкстапапиллярной локализации. Это связано в первую очередь с наличием высокой ОНЭ, создающей впечатление слабопигментированного проминирующего очага на глазном дне, что в сочетании с неравномерной пигментацией и наличием гиперфлюоресценции в поздние фазы ФАГ может привести к ошибочной постановке диагноза внутриглазного новообразования.
В данной ситуации основным методом диагностики является ОКТ, желательно с использованием режимов глубокого сканирования, которая даёт возможность оценить не только состояние сетчатки, но и хориоидального комплекса, а также структур ДЗН, расположенных за решётчатой пластинкой.
ОКТ-признаками ямки ДЗН являются связь структур ДЗН с субретинальным пространством, а также инвагинация слоя нервных волокон сетчатки в структуры ДЗН.
Таким образом, всем пациентам с ОНЭ в макулярной и/или юкстапапиллярной зоне и с подозрением на новообразование данной зоны необходимо проводить ОКТ ДЗН с целью исключения ямки ДЗН.
Конфликты интересов и финансовая заинтересованность авторов отсутствуют.
Ямка диска зрительного нерва
Ямка диска зрительного нерва
Ямка зрительного нерва представляет собой овальное серое, белое или желтоватое углубление диска зрительного нерва. Обычно ямки зрительного нерва локализуются в его височной части, но могут локализоваться в любом секторе. Располагающиеся в височной части диска ямки часто сопровождаются изменениями прилегающего перипапиллярного пигментного эпителия. Более чем в 50% случаев со дна или из края ямки ДЗН выходят одна или две цилиоретинальные артерии. Хотя чаще всего ямки диска зрительного нерва односторонние, в 15% случаев наблюдаются двусторонние аномалии.
Ямки диска зрительного нерва представляют собой выпячивания диспластической сетчатки в выстланный коллагеном карман, ориентированный назад и часто через дефект в решетчатой пластинке проникающий в субарахноидальное пространство. В описаниях семейных случаев ямки диска зрительного нерва предполагается аутосомно-доминантное наследование.
В случаях односторонней аномалии диск немного крупнее, чем в норме. При отсутствии скопления субретинальной жидкости острота зрения нормальная. Дефекты полей зрения вариабельны и часто не соответствуют локализации ямки ДЗН. Наиболее часто наблюдается парацентральная дугообразная скотома, тянущаяся от увеличенного слепого пятна. Ямки диска зрительного нерва редко являются симптомом сопутствующих мальформаций ЦНС. При глаукоме нормального давления описаны приобретенные углубления диска зрительного нерва, неотличимые от ямки ДЗН.
Серозная макулярная отслойка развивается в 25-75% глаз с ямками диска зрительного нерва, обычно она проявляется в третьем и четвертом десятилетии жизни. Витреальные тракции краев и тракционные изменения «крыши» ямки могут вызывать позднюю макулярную отслойку.
Конечной стадией процесса в глазах с ямками диска зрительного нерва, вероятно, являются изменения, соответствующие гистологической картине отслойки сенсорной сетчатки макулярной области, но остается неясным, является ли этот механизм универсальным для всех макулярных отслоек при ямках диска зрительного нерва (ДЗН).
Риск развития макулярной отслойки выше в глазах с крупными ямками, локализованными в височных квадрантах. Возможно, вследствие возрастных особенностей витреопапиллярных тракций серозные макулопатии у детей с ямками диска зрительного нерва (ДЗН) могут разрешаться самостоятельно. Спонтанное прилегание наблюдается приблизительно в 25% случаев. Большинство макулярных отслоек при ямках диска зрительного нерва (ДЗН) при отсутствии лечения приводят к перманентному снижению зрения, даже при спонтанном прилегании.
У некоторых пациентов постельный режим и двусторонние окклюзионные повязки позволяют добиться прилегания сетчатки, предположительно вследствие уменьшения витреальных тракций. Попытки блокировать ток жидкости из ямки диска зрительного нерва (ДЗН) в макулу с помощью лазеркоагуляции в основном оказались безуспешными, вероятно, вследствие невозможности блокировать полость ретиношизиса. Витрэктомия с газовой тампонадой и лазеркоагуляцией обеспечивает длительное повышение остроты зрения. Источник интраретинальной жидкости в глазах с ямками диска зрительного нерва остается неустановленным. Возможные источники включают в себя:
1. Стекловидная полость через ямку.
2. Субарахноидальное пространство.
3. Кровеносные сосуды не дне ямки.
4. Пространство глазницы, окружающее твердую мозговую оболочку зрительного нерва.
Хотя при флюоресцентной ангиографии наблюдается ранняя гипофлюоресценция ямки диска зрительного нерва с последующей поздней гиперфлюоресценцией, просачивания флюоресцеина через ямку обычно не отмечается, также не происходит проникновения флюоресцеина в субретинальное пространство макулы. Поздняя гиперфлюоресценция строго коррелирует с наличием начинающихся в ямке цилиоретинальных артерий. При биомикроскопии на щелевой лампе часто выявляется тонкая мембрана, закрывающая ямку или персистирующий канал Cloquet, заканчивающийся у края ямки. У собак был продемонстрирован активный ток жидкости из стекловидной полости через ямку в субретинальное пространство. У людей этот механизм обнаружить не удалось.
Патогенез ямок диска зрительного нерва (ДЗН) не выяснен. Большинство авторов рассматривают ямки как вариант колобом диска зрительного нерва. Однако:
1. Ямки диска зрительного нерва (ДЗН) обычно односторонние, спорадические и не сопровождаются системными аномалиями. Колобомы часто двусторонние, обычно аутосомно-доминантные и могут сопутствовать мультисистемным расстройствам.
2. Ямки диска зрительного нерва (ДЗН) редко сопровождаются колобомами радужки или сетчатки и сосудистой оболочки.
3. Ямки диска зрительного нерва (ДЗН) обычно локализуются в зонах, не имеющих отношения к эмбриональной щели.

У этого пациента имеется ямка диска зрительного нерва правого глаза на восьми часах.
Белой стрелкой показана зона, где ранее имелось скопление субретинальной жидкости, красной стрелкой показана центральная ямка.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Ямка диска зрительного нерва

Заболевание встречается в популяции с частотой 1 ; 10 000—11 000 [Трон Е.Ж., 1968]; впервые описано Т. Wiethe (1882).
I І:ікж.’іцч. Патогенез ямки диска зрительного нерва неясен. Некоторые авторы предполагают, что я зрительного нерв'1 ИМНСІСН легкой формой колобомы! зрительного нерва, т.е. тоже обусловлена неполным закрытием глазной щели [Apple D.J. et al., 1982]. Аргументами, подтверждающими эту точку зрения, ее сторонники называют достаточно редкие случаи сочетания колобомы и ямки диска зрительного нерва. Существуют факты, не согласующиеся с этой гипотезой: во-первых, ямки диска часто рас- по.шшиисм в местах, нс имеющих отношения к эмбриональной щели; во-вторых, ямки диска обычно односторонние, спорадические и не сочетаются с другими аномалиями развития; в-третьих, ямки диска не сочетаются с колобомами радужки или сетчатки. Несмотря на то что колобома зрительного нерва может иногда представлять собой кратер о образную деформацию, напоминающую ямку диска зрительного нерва, и бывает трудно отличить локализующуюся в нижнем сегменте ямку от маленькой колобомы, изложенные выше факты кажутся достаточными для доказательства очевидной разницы в патогенезе колобом и ямок зрительного нерва. Наличие одного или нескольких цилиорети- нальных сосудов, выходящих из большинства ямок зрительного нерва, позволяет предполагать, что этот факт тоже как-то связан с патогенезом аномалии.
Гистологические исследования. В области ямки имеется дефект решетчатой пластинки. Ретинальные волокна опускаются внутрь ямки, затем возвращаются и выходят перед входящим зрительным нервом. Некоторые ямки сообщаются с субарахноидальным пространством.

лой или овальной формы, имеющее белый, серый или желтый цвет (рис. 13.27). Диаметр ямок диска зрительного нерва варьирует от до РД. Обычно ямка локализуется в височной половине диска, но может располагаться и в других секторах. Заболевание чаще одностороннее. Билатеральные ямки диска зрительного нерва встречаются в 15 % случаев [Трон Е.Ж., 1968; Theodossiadis G.P. et al., 1992; Jonas J.В., Freisler K.A., 1997]. При одностороннем поражении аномальный диск кажется слегка увеличенным по сравнению с нормальным.
При значительных размерах ямки диска можно получить ее сагиттальный срез, используя В-эхографию; при небольших размерах — оптическую когерентную томографию.
Приблизительно в 45—75 % глаз с врожденной ямкой диска зрительного нерва развивается серозная отслойка макулы [Ганиченко И.Н., 1986;
Schartz Н., McDonald H.R., 1988;
Theodossiadis G.P. et al., 1992]. LincoffH соавт. (1988) исследовали ход развития макулярных осложнений: 1) формируется ретиношизис внутренних слоев сетчатки, полость которого сообщает-


Рис. 13.29. Результаты оптической когерентной томографии у больного с ямкой диска зрительного нерва, осложнившейся развитием ретиношизиса и разрывом наружных слоев сетчатки.
ся непосредственно с ямкой диска (рис. 13.28); 2) образуется разрыв наружных слоев сетчатки ниже границ полости ретиношизиса; 3) отслойка наружных слоев развивается вокруг макулярного разрыва (рис. 13. 29), что связано с притоком жидкости из полости ретиношизиса (отслойка наружных слоев сетчатки при офтальмоскопии может имитировать отслойку пигментного эпителия, но при ФАГ не отмечается характерной для последней гиперфлюоресценции); 4) отслойка наружных слоев в конечном итоге увеличивается и облитерирует полость ретиношизиса (см.
рис. 13.28). На этой стадии осложнение клинически неотличимо от первичной серозной макулярной отслойки.
Путь интраретинальной жидкости до настоящего момента точно не установлен. В литературе указываются воз-
полость через ямку; 2) кровеносные сосуды в основании ямки; 3) субарахноидальное пространство; 4) альные сосуды [LincoffH. et al., 1988].
Обусловленные ямкой диска макулярные ретиношизис и отслойка сетчатки развиваются в возрасте 10— 40 лет. Риск развития макулярных осложнений выше в случаях, когда ямка диска зрительного нерва имеет большие размеры и локализуется в височной половине диска [Brown G.C. et al., 1980]. В тех случаях, когда макулярная отслойка существует длительное время (в течение 6 лет и более), по краю диска и/или вдоль границы отслойки откладывается пигмент. Отложения пигмента обусловлены нарушениями слоя пигментного эпителия сетчатки, в котором с течением времени формируются обширные окончатые дефекты.
G. Theodossiadis и соавт. (1992) обнаружили, что при существовании макулярной отслойки в течение 10 лет и более увеличиваются размеры ямки диска, а цвет ее становится серым, что, вероятно, связано с потерей или перестройкой глиальной ткани в пределах ямки.
Флюоресцентная ангиография. В артериальной и артериовенозной фазах определяется постепенно нарастающее просачивание флюоресцеина в зоне отслойки нейроэпителия по направлению к макуле. В ранних фазах ФАГ или индоцианиновой ангиографии ямка диска обычно не пропускает контрастное вещество. В поздней фазе ФАГ или индоцианиновой ангиографии происходит гиперфлюоресценция ямки диска и области макулярной отслойки [Cohen S.Y., Quentel G., 1998; Thcodossiadis G.P. ctal., 1999].
Психофизические исследования. Острота зрения у пациентов с ямкой диска зрительного нерва сохраняется нормальной до момента появления макулярных осложнений. К 16-летнему возрасту из-за развития макулярной отслойки нейроэпителия остроту зрения 0,1 и ниже отмечают у 80 % пациентов. Дефекты поля зрения разнообразны и часто не коррелируют с локализацией ямки. При персистирующих макулярных изменениях дефекты в поле зрения прогрессируют. Выявляемые в ноле зрения скотомы соответствуют обнаруживаемым при офтальмоскопии или ФАГ дефектам пигментного эпителия сетчатки.
Отслойка сетчатки, вызванная ямкой диска зрительного нерва, и её хирургическое лечение
Ямка диска зрительного нерва (ДЗН) – врожденная аномалия, представляющая собой ограниченное углубление в ДЗН [29]. Этиология заболевания не установлена. Частота заболевания в популяции 1:10000-1:11000 [9]. Приблизительно в 45-75% глаз с врожденной ямкой ДЗН развивается серозная отслойка нейроэпителия [5, 27]. При флюоресцентной и индоцианиновой ангиографии в поздней фазе выявляется четко ограниченная гиперфлюоресценция в области макулярной отслойки [28].
Описаны единичные случаи заболевания с дискуссией вокруг вопросов патогенеза и лечения [6, 7, 14, 15]. Считают, что ямка ДЗН может быть или легкой формой его колобомы [11], или результатом частичной задержки врастания нервных волокон в канал зрительного нерва [1]. Единой и точной картины этиологии и патогенеза заболевания, механизмов его развития в литературе не представлено.
Нет единого мнения и по поводу методов лечения ямки ДЗН и её осложнений.
Лазерная коагуляция в качестве монотерапии дает эффект только у 30% пациентов; комбинация лазерного лечения и интравитреального введения газа обладает более выраженным лечебным эффектом – до 70% успеха [26].
Барьерная аргон-лазерная коагуляция сетчатки по границе субретинальной полости и одномоментно YAG-лазерная ретинопунктура по нижней границе этой полости приводит к уменьшению высоты отслойки нейроэпителия (ОНЭ), улучшению остроты зрения. Однако при этом может сохраняться ток жидкости под нейроэпителием, образоваться парамакулярный разрыв [8].
Не нашло широкого распространения баллонирование заднего полюса глаза в сочетании с барьерной лазерной коагуляцией [10]. Консервативное лечение также неэффективно [28].
Впервые методика витрэктомии для лечения данной патологии была предложена Lee K.J. и Peyman G.A. в 1993 г. [22].
Витрэктомия с удалением только задней гиалоидной мембраны (ЗГМ), введением газа и горизонтальным положением лицом вниз на 7 дней привела к положительному результату у 8 из 10 чел. [19]. Витрэктомия с удалением внутренней пограничной мембраны (ВПМ) (2 операции) привела к полному прилеганию отслоенной сетчатки по ОКТ [17].
С 1993 г. и по настоящий момент общепринятой техникой является витрэктомия с отделением ЗГМ, пилингом ВПМ, эндолазеркоагуляцией и тампонадой газо-воздушной смесью с небольшими авторскими различиями [16, 18, 20].
Описан один случай закрытия ДЗН лоскутом аутологичной ВПМ с удалением ВПМ с области фовеолы и применением газо-воздушной смеси [24].
Ранее нами уже была показана перспективность лечения отслойки нейроэпителия, вызванной ямкой ДЗН, с помощью локальной витрэктомии в центре и удаления ЗГМ и ВПМ [2-4, 13].
Описать этиологию, патогенез и оценить эффективность предложенного нами метода хирургического лечения отслойки сетчатки при ямке ДЗН.
Материал и методы
Всего было прооперировано 15 пациентов (16 глаз) с ямкой диска зрительного нерва, осложненной отслойкой нейроэпителия.
Всем пациентам были выполнены следующие исследования: компьютерная томография головного мозга, визометрия, периметрия, оптическая когерентная томография (ОКТ) и фотоконтроль.
Данные о возрасте пациентов, остроте зрения и высоте отслойки нейроэпителия представлены в табл. 1.
При отборе пациентов на оперативное лечение мы придерживались следующей классификационной схемы: стадия 1 – неосложнённая ямка ДЗН, стадия 2 – осложненная серозной отслойкой сетчатки (плоской у ДЗН), стадия 3 – осложненная серозной отслойкой сетчатки (высокой у ДЗН), стадия 4 – осложненная серозной отслойкой сетчатки со вторичными изменениями ПЭ в центре макулы, стадия 5 – исход: отсутствие отека сетчатки, вторичные изменения ПЭ в макуле.
На оперативное лечение (витрэктомию с удалением ВПМ) выбирали пациентов с 3-4 стадией.
Техника операции: выполнялся трехпортовый доступ к полости стекловидного тела с использованием разового набора инструментов калибра 25G. Для освещения витреальной полости использовался желто-зелёный ртутный свет.
Вторым этапом выполнялась локальная задняя витрэктомия, отделение и удаление ЗГМ после предварительного контрастирования кеналогом. ВПМ предварительно окрашивалась введением в полость глаза трипанового голубого красителя в концентрации 0,075%. Следующим этапом выполнялось подковообразное дозированное удаление ВПМ (рис. 1). В заключение производилась тампонада воздухом и рекомендовалось положение лицом вниз на 1 день.
У 11 из 15 пациентов (73% случаев), в том числе и у детей, по данным компьютерной томографии головного мозга, была обнаружена гидроцефалия, у двух пациентов были отмечены незначительные признаки гидроцефалии и только у одного пациента признаков гидроцефалии не обнаружено.
У 15 пациентов (16 глаз) с ямкой диска зрительного нерва осложнений в ходе операций не наблюдалось.
У одного пациента на 3-й день после операции образовался макулярный разрыв (рис. 2). Через год произошло полное самостоятельное закрытие макулярного разрыва с восстановлением остроты зрения с 0,2 до 0,5 (рис. 3).
По данным динамического ОКТ высокого разрешения через год после операции у всех пациентов произошла полная резорбция субретинальной жидкости и фовеолярных кист.
У этих пациентов наблюдалось полное восстановление линии IS-OS в фовеоле (по данным ОКТ) при отсутствии признаков атрофии ПЭ (рис. 4).
У пяти пациентов острота зрения через год после операции восстановилась только до 0,6 вследствие присутствовавшей ещё до операции атрофии пигментного эпителия, спровоцированной предварительным лазерным вмешательством, что показано на ОКТ глазного дна (рис. 5).
Только у одной пациентки был обнаружен рецидив отслойки нейроэпителия через 6 мес. после почти полного его прилегания. Пациентка была направлена на повторную компьютерную томографию головного мозга, результаты которой выявили признаки внутричерепной гипертензии. В настоящее время эта пациентка находится на лечении у невролога и проводится её динамическое наблюдение у офтальмолога с ОКТ-контролем.
В ходе одного из ранних оперативных вмешательств в 2008 г. нами было замечено, что дно ямки ДЗН на самом деле представляет собой клапан, который раскрывается при создании искусственной гипотонии и закрывается, углубляясь внутрь ямки ДЗН, при создании гипертензии. В дальнейшем у всех пациентов, прооперированных нами, был обнаружен клапанно-диафрагмальный механизм ямки ДЗН, что подтверждается фотографиями и видеоматериалами, отснятыми в процессе хирургии (рис. 6).
В 2012 г. нам удалось провести видеосъёмку работы клапана центрально расположенной ямки ДЗН в естественных условиях. Было видно, что клапан открывался и закрывался синхронно с пульсом: открытие в период систолы, закрытие в период диастолы (рис. 7).
Таким образом, нами установлена роль анатомических особенностей в патогенезе развития отслойки сетчатки при ямке ДЗН: если ямка расположена на краю ДЗН, ток жидкости идёт под нейроэпителий, а если ямка находится ближе к центру ДЗН, жидкость поступает в полость стекловидного тела, и отслойка сетчатки не развивается.
Данная находка подтолкнула нас к более детальному изучению этого заболевания. Наследственные болезни и врождённые заболевания представляют собой два частично перекрывающихся множества. Часть врожденных заболеваний могут быть генетически обусловлены.
Из анализа публикаций, посвященных данной тематике, стало известно, что ямка ДЗН может быть обусловлена мутациями в гене PAX6, расположенном на коротком плече 11-й хромосомы [12, 21]. Безусловно, требуется проведение специальных генетических тестов у данных пациентов, что будет являться предметом дальнейших исследований. В доступной литературе была обнаружена публикация, подтверждающая связь мутаций гена PAX6 с развитием нейродегенеративных состояний, в том числе таких, как гидроцефалия [23].
Начиная со второго пациента, всем последующим мы назначали компьютерную томографию головного мозга на предмет выявления признаков гидроцефалии – расширения желудочков головного мозга и других патогомоничных признаков повышения давления внутри головного мозга.
В результате явная гидроцефалия была обнаружена у 11 из 15 пациентов (73% случаев), и только у двух пациентов были незначительные признаки гидроцефалии. Только у одного пациента признаков гидроцефалии не было обнаружено.
Сопоставляя данные КТ головного мозга с высотой и объёмом ОНЭ у данных больных, мы обнаружили одну особенность: у пацентов с гидроцефалией и выраженным гипертензионным синдромом была самая большая площадь отслойки сетчатки и её высота более 4000 мкм. По назначению невропатолога перед операцией для лечения гипертензионного синдрома назначался диакарб. При отсутствии положительной динамики по данным ОКТ через 3-4 недели проводилась операция по описанной выше технологии.
Таким образом, мы можем утверждать, что стартовым механизмом развития отслойки сетчатки при ямке ДЗН является повышенное внутричерепное давление.
Повышение внутричерепного давления направляет ток жидкости по зрительному нерву в витреальную полость глаза и, если ямка расположена на краю ДЗН, ток жидкости идёт под сетчатку, вызывая отслойку сетчатки.
Механизм действия локального удаления ВПМ заключается в гиперфильтрации жидкости сквозь сетчатку в зоне удалённой мембраны – эффект решета, сетчатка медленно оседает на пигментный эпителий.
Преимущества данной техники заключаются в том, что происходит полная анатомическая реконструкция фовеолы, резорбция субретинальной жидкости и фовеолярных кист, вследствие чего острота зрения восстанавливается полностью, при этом уменьшается количество осложнений, связанных с обширным пилингом ВПМ.
Локальное удаление ВПМ без захвата зоны фовеолы позволяет избежать образования сквозного макулярного разрыва. Отсутствует необходимость в проведении лазеркоагуляции, ретинопунктуры, пребывания в положении лицом вниз; нет необходимости в применении газовой или любой другой тампонады.
Причиной рецидивов заболевания после хирургического лечения ямок ДЗН, осложненных отслойкой нейросенсорной ретины, является повышение внутричерепного давления и гидроцефалия, оставленные без специфического лечения.
Для профилактики рецидива заболевания необходимо выполнять компьютерную томографию головного мозга и прибегать к консультации невропатолога до операции.
1. Установлена причинно-следственная связь между ямкой ДЗН, развитием отслойки сетчатки, повышенным внутричерепным давлением, гидроцефалией.
2. Причиной развития отслойки сетчатки при ямке ДЗН является повышение внутричерепного давления различной этиологии, которая определяется с помощью КТ головного мозга.
3. Впервые установлен патогенез данного заболевания: ямка ДЗН прикрыта клапаном, который приподнимается в момент систолы и пропускает определённую порцию ликвора внутрь глаза. При расположении ямки в центре ДЗН жидкость поступает в стекловидное тело. В случае же её расположения у края ДЗН жидкость поступает под нейроэпителий сетчатки и вызывает её отслойку.
4. Разработан новый патогенетический способ хирургического лечения осложненной ямки ДЗН, приводящий к полной функциональной реабилитации пациентов.
5. Локальное удаление ВПМ самодостаточно, не требуется никаких других воздействий типа блокировки непосредственно ямки ДЗН каким-либо материалом, ретинопунктуры, дренажа СРЖ, газовой или силиконовой тампонады и эндолазеркоагуляции; оно приводит к гиперфильтрации жидкости сквозь сетчатку, что нивелирует градиент между внутричерепным и субретинальным давлением, обусловливая полное прилегание нейроэпителия.
6. Полное восстановление остроты зрения у пациентов с осложненной отслойкой сетчатки ямкой ДЗН происходит через 12-15 мес. после операции.
Читайте также:
