Структура инсулина. Синтез инсулина
Обновлено: 27.04.2024
В истории химии случались события, по своему драматизму напоминавшие штурм неприступной вершины, на которую одновременно по различным маршрутам пытаются взойти независимые группы альпинистов. Речь пойдет о получении инсулина. Синтез этого соединения был хорошо подготовлен (это напоминает базовые, промежуточные лагеря альпинистов), но не теми, кто вышел на покорение вершины, а основательными работами исследователей-предшественников. Развитие химии инсулина получило в наши дни продолжение, которое совершенно не могли предугадать те, кто его создавал.
С этой популярнейшей молекулой ХХ столетия связаны имена семи нобелевских лауреатов.
Белок, спасающий жизнь
В середине ХХ столетия инсулин изучали очень интенсивно. Оказалось, что именно этого гормона не хватает при сахарном диабете. Инсулин запускает процессы, обеспечивающие проникновение глюкозы в клетки, а также стимулирует внутриклеточные механизмы, ответственные за усвоение глюкозы. Когда инсулина не хватает, глюкоза не расходуется клетками, а значит, накапливается в крови и через почки выводится мочой. Больной худеет, у него выделяется слишком много мочи, он постоянно хочет пить и есть. Организм старается компенсировать дефицит калорий, которые он теряет в виде глюкозы с мочой, и начинает использовать жировые запасы и тканевые белки (главным образом мышечные). Возникают утомление, сонливость, тошнота. Если диабет не лечить, то больной погибает.
Сахарным диабетом болеют во всех странах, представители всех рас. Самое раннее его описание сделали примерно 3000 лет назад в Древней Индии, но более подробно симптомы болезни описали в I веке н.э., назвав ее от греческого diabatas — истечение. Это заболевание планомерно изучали не одно столетие. В XVII веке английский врач Томас Уиллис обнаружил, что моча у пациентов с такими симптомами сладковатая (он был настоящий ученый). Картина начала проясняться после опытов французского физиолога Клода Бернара (1813–1878) и немецких физиологов Йозефа фон Меринга и Оскара Минковского (1889), которые наблюдали собак с удаленной поджелудочной железой. Тогда стала очевидной связь между поджелудочной железой и сахарным диабетом.
Физиологи предположили, что поджелудочная железа вырабатывает вещество, которое ответственно за усвоение в организме глюкозы, а в 1916 году немецкий физиолог Шарпи-Шафер назвал это гипотетическое вещество «инсулином» (от латинского инсула – «островок», поскольку в поджелудочной железе группы клеток назвали островками Лангерганса). В 1921 году трое канадских исследователей Джон Маклеод, Фредерик Бантинг и Чарльз Бест смогли выделить инсулин из поджелудочной железы подопытных животных. Первые же опыты показали, что если ввести полученный препарат собакам с удаленной поджелудочной железой, то у них снижается уровень сахара в крови и заметно улучшается состояние. Первым пациентом, получившим инсулин 11 января 1922 года (знаменательная дата в истории мировой медицины), был четырнадцатилетний канадец Леонард Томпсон, страдавший тяжелой формой диабета.
В 1923 году Маклеод и Бантинг получили за открытие инсулина Нобелевскую премию по физиологии и медицине. Беста не оказалось в списке лауреатов, и Бантинг отдал ему половину полученных денег. С 1926 года было налажено серийное производство инсулина, и тысячи больных сахарным диабетом, ранее обреченных на смерть, смогли вести сравнительно нормальную жизнь.
От медицины к химии
Физиологи Маклеод, Бантинг и Бест использовали для лечения больных экстракт поджелудочной железы животных, но у химиков несколько иной подход — их всегда интересовало, как именно устроено то или иное соединение. Впервые инсулин в кристаллическом виде сумел выделить в 1926 году Джон Абель, именно благодаря его работам удалось наладить промышленное производство лекарства. Абель также определил состав (но не строение) инсулина, после чего стало понятно, что это молекула белка. Начиная с этого момента исследование инсулина переходит из рук медиков к биохимикам.
Необходимо было выяснить, как устроена молекула, привлекавшая внимание столь большого числа исследователей. Эту задачу решил американский биохимик Фредерик Сенгер, который в 1958 году получил Нобелевскую премию «за работы по структуре протеинов, особенно инсулина». Вначале он разработал способ, с помощью которого можно было определить природу концевой группы в белковой молекуле (этот метод стал классическим — обработка в щелочной среде динитрофторбензолом). Потом он буквально разобрал на части всю молекулу инсулина и определил состав полученных аминокислот с помощью самых современных методов — электрофореза, разработанного Арне Тиселиусом (Нобелевская премия 1948 года), и хроматографии, усовершенствованной Арчером Мартином и Ричардом Сингом (нобелевские лауреаты 1952 года). Однако установить, из каких аминокислот собран белок, — лишь половина дела, притом менее сложная. Главное выяснить их последовательность в цепи.
Сенгер разработал план, по которому с помощью специально подобранных ферментов расщеплял цепь в разных заранее намеченных участках на небольшие отрезки, а потом сопоставлял их состав. Работа представляла собой безупречное сочетание логики и экспериментального мастерства. Свой метод Сенгер довел буквально до совершенства, и со временем он стал классическим при исследовании структуры белков.
Отметим, что Сенгер на этом не остановился. Применив похожие логические построения, а также несколько изменив методику и реагенты, он сумел установить последовательность нуклеотидов в ДНК. За эти исследования в 1980 году Сенгеру (совместно с Уолтером Гилбертом и Полом Бергом) была присуждена Нобелевская премия. На сегодня — Сенгер единственный дважды нобелевский лауреат по химии. Никто в то время не мог предположить, что эти исследования ДНК позволят со временем открыть новую страницу в химии инсулина, но об этом речь несколько позже.
Американский биохимик Винсент дю Виньо, в течение нескольких лет изучавший инсулин, узнав о работах Сенгера по расшифровке структуры, решил воспользоваться его методикой, однако пошел дальше. Он не только установил строение двух гормонов (вазопрессина и окситоцина), но и сумел их синтезировать. Фактически он первый сумел синтезировать природные полипептиды. Эту его работу также отметили Нобелевской премией 1955 года, то есть он получил премию на три года раньше Сенгера, чьи идеи помогли ему добиться столь великолепного результата. Работы дю Виньо фактически открыли дорогу к синтезу инсулина, но его молекула была сложнее, чем два уже полученных гормона, кроме того, еще не были разработаны способы, позволяющие связать две полипептидных цепи дисульфидными мостиками.
Тем временем оказалось, что цинковый комплекс из нескольких молекул инсулина (так называемый Zn-инсулин) обладает более длительным лечебным действием. Строение этого комплекса оказалось весьма сложным (он содержит почти 800 атомов), поэтому были привлечены физикохимические методы анализа. В 1972 году английский биофизик Дороти Кроуфут-Ходжкин (лауреат Нобелевкой премии 1964 года за определение с помощью рентгеновских лучей структур биологически активных веществ) установила структуру этого необычайно сложного комплекса.
Компактный язык биохимиков
Прежде чем мы рассмотрим строение молекулы инсулина, вспомним, как биохимики изображают молекулы белков. Все белки — это полимеры, цепи которых собраны из остатков аминокислот. В состав аминокислот входят аминогруппа NH 2 и карбоксильная группа СООН. В образовании белков участвуют только такие аминокислоты, у которых между амино- и карбоксильной группой — всего один углеродный атом (общий вид формулы: H 2 N–CH(R)–COOH). Группа R, присоединенная к атому углерода между амино- и карбоксильной группой, определяет различие между аминокислотами, образующими белки. Эта группа может состоять только из атомов углерода и водорода, но чаще содержит различные функциональные группы. Из всего многообразия аминокислот (теоретически их количество неограниченно) в образовании белков участвуют только двадцать, так называемых фундаментальных. Для строительства инсулина природа использовала 16 аминокислот.
Аминокислоты в белковой молекуле соединяются последовательно, при этом карбоксильная группа одной кислоты взаимодействует с аминогруппой соседней молекулы, в результате образуется пептидная связь –CO–NH– и выделяется молекула воды (рис. 1). Получается, что при любом количестве соединяемых аминокислот на одном конце цепочки обязательно будет находиться аминогруппа, а на другом — карбоксильная. Вместо структурной формулы часто используют сокращенное обозначение, например АЛА-ВАЛ-ГЛИ, что означает последовательность аминокислот «аланин-валин-глицин». Поскольку аминокислот, используемых природой, всего двадцать, то так можно компактно записать формулу любого белка, и никакой неясности при этом не возникает.
1. Так образуется цепь аминокислот
2.Пространственная модель молекулы инсулина и ее условное изображение
Молекула инсулина, как установил Ф.Сенгер, состоит из 51 аминокислотного остатка и представляет собой две соединенные между собой параллельные цепи неодинаковой длины (рис. 2). Обратите внимание, что входящие в цепь остатки аминокислоты цистеина (ЦИС) образуют дисульфидные мостики –S–S–, которые связывают две полимерных молекулы и, кроме того, образуют перемычку внутри одной цепи. Если сравнить изображение, принятое в биохимии, и формулу в виде объемной шаростержневой модели, то очевидно, что первое компактно и очень удобно.
От демонтажа к сборке
Казалось бы, после того, как установлена структура молекулы, синтезировать ее заново не составит большого труда. Ведь если изделие собрано на резьбе, то разобрать и собрать его несложно, нужна лишь отвертка или гаечный ключ. Но если это отливка или сварное изделие, то разобрать или распилить, а затем собрать вновь совсем непросто. В этом случае разборка и сборка — совершенно разные по способам решения задачи.
Основная трудность при сборке белковой молекулы — добиться, чтобы необходимые аминокислоты соединились строго в намеченном порядке. При этом следует помнить, что каждая аминокислота может реагировать не только с другой аминокислотой, но и сама с собой, поэтому в итоге может получиться молекула, не имеющая ничего общего с тем, что синтезирует живой организм.
К моменту, когда решался вопрос о синтезе инсулина, было разработано несколько соответствующих методик. Чтобы аминокислота, которую намечено было присоединить к растущей цепи, не реагировала сама с собой, ее реакционноспособные концы (аминогруппу NH 2 и карбоксильную группу СООН) блокировали специальным образом: карбоксильную группу переводили в п-нитрофениловый эфир, а со стороны аминогруппы присоединяли карбоксибензильную группу. Такая блокированная молекула реагировала с аминогруппой, находящейся на конце растущей цепи (рис. 3). В результате цепь удлинялась на одно пептидное звено.
3.Сборка белковой молекулы: присоединение первой аминокислоты
Однако теперь на конце цепи разместилась блокирующая карбоксибензильная группа. Из показанной выше схемы следует, что цепь наращивают со стороны «аминного» конца этой цепи — того, который оказался заблокированным. Следовательно, нужно сделать этот «аминный хвост» реакционноспособным, то есть перевести его в активную форму. Это делали с помощью бромоводорода с уксусной кислотой (рис. 4). В результате аминогруппа на конце цепи вновь готова реагировать с очередной аминокислотой (естественно, тоже содержащей блокирующие группы). Параллельно были разработаны также несколько иные методы сборки полиамидных цепей.
Структура инсулина. Синтез инсулина
Структура инсулина. Синтез инсулина
а) Инсулин и его метаболические эффекты. Впервые инсулин был выделен в 1922 г. Бантингом (Banting) и Бестом (Best) из поджелудочной железы больных тяжелым диабетом. Это открытие означало возвращение их к практически нормальной жизни здорового человека. На бытовом уровне слово «инсулин» ассоциируется с термином «сахар крови», что довольно справедливо, т.к. инсулин влияет на метаболизм углеводов, хотя сопутствующие нарушению его продукции изменения обмена липидов, приводящие к ацидозу и атеросклерозу, могут быть первопричиной смерти больных диабетом.
Наряду с этим у больных с длительно существующим диабетом существенно снижена способность синтезировать белки, что приводит к изнашиванию тканей и функциональным нарушениям в клетках. Очевидно, что инсулин влияет на обмен белков и жиров не в меньшей степени, чем на обмен углеводов.
б) Инсулин как гормон, связанный с энергетическим изобилием. Если несколькими словами характеризовать инсулин, это будет определение, в котором слово «инсулин» ассоциировалось бы с понятием «энергетическое изобилие». Очевидно, что если предлагается богатая энергией пища, особенно с избытком углеводов, то инсулин начинает продуцироваться в большом количестве. Таким образом, инсулин играет важную роль в запасании энергии.
Если в организм поступают избыточные количества углеводов, они запасаются в виде гликогена в печени и мышцах; если избыток углеводов уже не может депонироваться в виде гликогена, то под влиянием инсулина он превращается в жиры и депонируется в жировой ткани. Применительно к белкам инсулин оказывает непосредственнее влияние на захват аминокислот клетками и синтез из них белка. Кроме того, инсулин тормозит распад белков, уже находящихся в клетках.
в) Химическая структура и синтез инсулина. Инсулин человека представляет собой молекулу белка с молекулярной массой 5808. Он состоит из двух аминокислотных цепочек (для облегчения понимания просим вас изучить рисунок ниже), соединенных между собой дисульфидными связями.
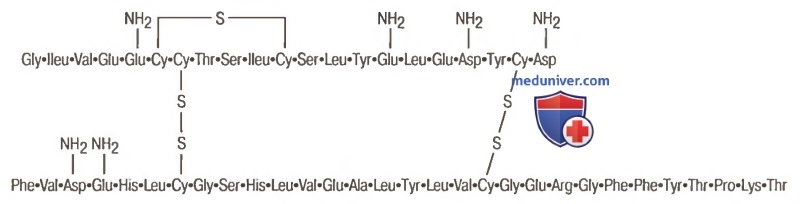
Молекулы инсулина человека
Если эти связи разрушить, разъединив таким образом цепочки аминокислот, инсулин утратит свою активность.
Инсулин синтезируется в бета-клетках островков Лангерганса обычным механизмом синтеза белка. Трансляция инсулина начинается на рибосомах, связанных с эндоплазматическим ретикулумом, с образования препрогормона инсулина. Этот исходный препрогормон с молекулярной массой 11500 в эндоплазматическом ретикулуме расщепляется до проинсулина с молекулярной массой около 9000. Далее в аппарате Гольджи большая его часть дробится на инсулин, упаковывающийся в секреторные гранулы, и пептидный фрагмент. Однако почти 1/6 часть конечного секретируемого продукта остается в форме проинсулина. Проинсулин является неактивной формой гормона.
В крови инсулин циркулирует в несвязанной форме, время его полувыведения составляет всего около 6 мин, поэтому плазма практически полностью освобождается от инсулина за 10-15 мин. Оставшаяся несвязанной с рецепторами клеток-мишеней часть инсулина разрушается главным образом в печени ферментом инсулиназой; в меньшей степени разрушение инсулина происходит в почках и мышцах; совсем небольшая часть — в других тканях. Такое быстрое очищение плазмы от инсулина очень важно, т.к. иногда быстрое прекращение регуляторных влияний инсулина не менее существенно, чем их включение.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Структура инсулина. Синтез инсулина
Первичная структура молекулы инсулина была расшифрована Ф. Стэнглером в 1954 году. Инсулин стал первым белком с известной аминокислотной последовательностью. Инсулин – низкомолекулярный полипептид (м.в.в. = 5800 kd), состоящий из двух цепей с разным количеством аминокислотных остатков (цепь α - 21 и цепь β - 30). Полипептидные цепи соединены между собой двумя дисульфидными связями.
Различные виды инсулина отличаются не только аминокислотным составом, но и α-спиралью, которая обусловливает вторичную структуру гормона. Более сложной является третичная структура, которая образует участки, ответственные за биологическую активность и антигенные свойства гормона. Внутреннее строение молекулы инсулина важно для взаимодействия с его рецептором и проявления биологического действия. Исследованиями с помощью рентгеновских лучей установлено, что гексамерная единица кристаллического цинк-инсулина состоит из трех димеров. Димеры инсулина связаны в кристаллы водородными мостиками между В24 и В26 пептидных групп.
Ген инсулина был выделен и изучен одним из первых. Он расположен на коротком плече 11 хромосомы. Генная сеть, регулирующая продукцию инсулина в ответ на стимуляцию глюкозой, включает следующие процессы: 1) транспорт глюкозы в клетку; 2) метаболизм глюкозы; 3) процессы секреции инсулина; 4) путь сигнальной трансдукции от рецептора инсулина. Она содержит 27 генов, 74 белка и 27 метаболитов. Продукция инсулина под действием глюкозы регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой РНК и повышением трансляции инсулиновой и-РНК.
Образование островков в поджелудочной железе крысы происходит на 10-й день онтогенеза, а на 11-й день в них уже определяется инсулин, уровень которого остается сравнительно стабильным в период с 12-го по 14-й день беременности, а затем (14- 20-й день) количество инсулина резко увеличивается. На 11-й день развития выявляется также глюкагон, и его уровень в несколько десятков раз превышает уровень инсулина. Из мезенхимальной ткани был выделен фактор, который стимулирует ДНК, РНК и синтез белка в панкреатическом эпителии эмбриона и осуществляет контроль над пролиферацией и дифференцировкой панкреатического эпителия в ацинозную ткань и B-клетки.
Биосинтез инсулина в β -клетках происходит из высокомолекулярных предшественников. Долгое время считалось, что они метаболически нейтральны. Теперь, показано, что каждый из продуктов синтеза инсулина обладает самостоятельной биологической активностью.
Сначала в эндоплазмтическом ретикулуме В-клетки синтезируется препроинсулин, имеющий в своем составе 110 аминокислотных последовательностей. Он способствует трансформации стволовых аценоинсулярных клеток в В-клетки. После отщепления т.н. сигнального полипептида, состоящего их 24 аминокислот, превращается в проинсулин. На превращение препроинсулина в проинсулин потребуется около 10-15 минут. Сигнальный полипептид, называемый еще N - концевая последовательность, направляет регенерацию В-клеток.
Проинсулин, состоящий в свою очередь, из 86 аминокислотных остатков, в аппарате Гольджи преобразуется путем отщепления С-пептида, содержащего 31 аминокислоту. Этот процесс занимает около 20-40 минут и происходит в малых (ранних) секреторных гранулах, под влиянием превращающих энзимов и с обязательной затратой энергии. Отщепление С-пептида от проинсулина происходит с помощью кальций-зависимых эндопротеаз РС2 (отщепляет С-пептид от А-цепи) и РС3 (отщепляет С-пептид от В-цепи) После этого образуются кристаллы активного инсулина, имеющего в своем составе 51 аминокислотный остаток, на что уходит 2-4 часа. И, наконец, образуются секреторные гранулы, содержащие “зрелый” инсулин, С-пептид, проинсулин (1-2%), кальций, цинк и амилин. Этот процесс длится 1-2 дня.
Скорость метаболизма проинсулина значительно ниже, чем инсулина. Кроме того, проинсулин имеет низкую аффинность к инсулиновому рецептору (5%). Секреция проинсулина влияет на скорость размножения В-клеток.
Проинсулин может попадать в кровоток, минуя секреторные гранулы. Эта нерегулируемая секреция проинсулина в норме не превышает 3-5%, но при сахарном диабете 2 типа в крови натощак определяется до 50% проинсулина. Таким образом, незрелые гранулы, содержащие проинсулин, прорываются в интерстициальное пространство. Полагаем, что это связано с цитолизом инсулоцитов и попаданием содержимого цитоплазмы в кровь.
В ряде клинических исследований была предпринята попытка использовать проинсулин в качестве потенциально длительно действующего инсулина. Однако, эти исследования были прекращены, поскольку в группе лиц, получавших проинсулин, было выявлено незначительное повышение уровня сердечной смертности.
Значение С-пептида уникально в отношении предотвращения развития осложнений сахарного диабета. В последние годы показано, что применение С-пептида вместе с инсулином для лечения больных, страдающих инсулинозависимым диабетом, приводит к стабилизации сосудистых осложнений диабета и отдаляет появление новых проявлений ангиопатии. Так, малые дозы биосинтетического С-пептида при его инфузии улучшали микроциркуляцию в мышцах, улучшали функцию почек. И, наоборот, в отсутствие С-пептида даже при нормогликемии, поддерживаемой инсулинотерапией, развивались нефропатия и микроангиопатии, свойственные диабету.
В течение последних лет внимание диабетологов привлечено к работам, в которых отмечены изменения в морфологии бета-клеток, включая фиброз островков и накопление в них амилоида. Относительно недавно обнаружено, что амилоид состоит из специфического белка амилина, структуру которого составляют 37 аминокислот. Амилин влияет на подавление постпрандиальной секреции глюкагона и продукцию глюкозы печенью; регуляцию опорожнения желудка, секрецию кишечных гормонов, ограничение уровня прандиальной гликемии. В исследованиях in vitro показано, что амилин уменьшает захват глюкозы и подавляет секрецию инсулина изолированными бета-клетками. Выдвинута гипотеза, что в связи с первичным дефектом на уровне бета-клеток при ИНСД, характеризующимся нарушением превращения проинсулина в инсулин, амилин (участник этого процесса в норме) откладывается в бета-клетках и снижает в дальнейшем секрецию инсулина. [Аметов и др. 2005].
Готовый к использованию инсулин вместе проинсулином и интермедиатными формами I и II (около 6% ), С-пептидом (94%), и ионами цинка хранится в гранулах и выводится путем экзоцитоза под влиянием разных сигналов. Инсулин, С-пептид и проинсулин различаются биологической активностью и длительностью существования. Так, период полураспада инсулина составляет 3-10 мин, С- пептида – около 30 мин, проинсулина – около 20-23 мин. По мере созревания гранул уменьшается количество проинсулина и увеличивается количество инсулина, при взаимодействии которого с ионами цинка образуются кристаллы. Они локализуются в центре гранулы и обусловливают повышенную электронную плотность при морфологических исследованиях поджелудочной железы. С-пептид располагается по периферии гранулы. В-клетки поджелудочной железы у человека содержат более десяти тысяч секреторных гранул. Одна гранула содержит около 300 000 молекул инсулина.
Поговорим про инсулин
Инсулин — это гормон поджелудочной железы, который главным образом воздействует на обмен веществ, причем в основном — на концентрацию глюкозы в крови. В своих тканях-мишенях он влияет как на мембранные, так и на внутриклеточные процессы. Некоторые из его эффектов перечислены в ниже.
Эффекты инсулина

Мембранные эффекты
- Стимуляция транспорта глюкозы (и некоторых других моносахаридов)
- Стимуляция транспорта аминокислот (особенно аргинина)
- Стимуляция транспорта жирных кислот
- Стимуляция поглощения клеткой К+ и Mg2+
Внутриклеточные эффекты
- Стимуляции синтеза РНК и ДНК
- Стимуляция синтеза белка
- Усиленная стимуляция гликогенсинтазы (гликогенез)
- Стимуляция глюкокиназы
- Ингибирование глюкозо-6-фосфатазы
- Стимуляция липогенеза
- Ингибирование липолиза (ингибирование синтеза цАМФ)
- Стимуляция синтеза жирных кислот
- Активация Mg2+-стимулируемой Na+/K+-АТФазы
Механизм действия инсулина и влияние его на обмен

Инсулин и глюкоза
Попав в клетку, глюкоза быстро превращается в глюкозо-6-фосфат, поэтому ее внутриклеточная концентрация остается крайне низкой. Уровень глюкозы в артериальной крови в норме поддерживается в пределах 4-8 ммоль/л (72-144 мг/100 мл), так что по обе стороны клеточной мембраны всегда существует градиент ее концентраций. Несмотря на это, однако, простая диффузия обеспечивает поступление в большинство клеток лишь небольшого количества глюкозы, которого явно недостаточно для удовлетворения их метаболических потребностей (даже при возрастании концентрационного градиента, как это имеет место при высокой гипергликемии). В присутствии же инсулина проникновение декстрозы в клетки резко усиливается. Это действие инсулина проявляется лишь при наличии концентрационного градиента глюкозы, конкурентно ингибируется другими моносахаридами (например, галактозой) и следует кинетике насыщаемого процесса. Таким образом, гормон стимулирует процесс облегченной диффузии декстрозы, который осуществляется при участии чувствительных к гормону белковых транспортеров глюкозы (GLUT), расположенных на клеточной мембране. Эти транспортеры способны переносить глюкозу через клеточную мембрану в обоих направлениях, но ее поток зависит от концентрационного градиента, который направлен из внеклеточного пространства во внутриклеточное. В разных клетках найдены многочисленные GLUT, но инсулинозависимым является только один из этих белков — GLUT4, и именно он присутствует в мембранах клеток скелетных и сердечных мышц, а также жировой ткани.

Димерный рецептор инсулина и последствия инсулиновой активации тирозинкиназы (GLUT — транспортер глюкозы)
Некоторые ткани полностью удовлетворяют свои потребности в глюкозе за счет инсулиннезависимых механизмов. Например, в клетки печени и центральной нервной системы декстроза попадает с помощью инсулиннезависимых GLUT, и поглощение этими тканями зависит только от ее уровня в крови. Кроме того, мембрану эритроцитов, клеток почек и кишечника глюкоза пересекает вместе с ионами натрия, которые поступают в клетки путем пассивной диффузии по градиенту концентрации.

Регуляция продукции инсулина
Инсулин влияет и на внутриклеточные процессы обмена веществ. В печеночных и других клетках он стимулирует синтез гликогена, повышая активность гликогенсинтазы, что ускоряет включение гликозильных остатков в гликоген. Гормон поджелудочной железы повышает также активность печеночной глюкокиназы; этот фермент катализирует фосфорилирование глюкозы (с образованием глюкозо-6-фосфата). Одновременно гормон ингибирует печеночную фосфатазу, которая дефосфорилирует глюкозо-6-фосфат, с образованием свободной глюкозы. Такие изменения активности печеночных ферментов обусловливают снижение продукции декстрозы и наряду со стимуляцией поглощения ее периферическими клетками определяют гипогликемию, возникающее под влиянием инсулина. Возрастающая под действием последнего утилизация глюкозы в тканях обеспечивает сохранение запасов других внутриклеточных энергетических субстратов, таких как жиры и белки.
Белки и инсулин
Инсулин стимулирует не только активный транспорт аминокислот в периферические клетки, но и непосредственно синтез белка. Поскольку эти два эффекта могут не зависеть друг от друга, гормон влияет, очевидно, не только на клеточную мембрану, но и на внутриклеточные процессы. Стимуляции синтеза белка предшествует возрастание активности мРНК. Поскольку гормон с трудом проходит сквозь мембраны клеток, в механизме его ядерного эффекта должен принимать участие второй посредник. Синтез белка под действием инсулина усиливается и вследствие возрастания количества поступающих в клетку аминокислот. С другой стороны, возрастание утилизации глюкозы замедляет распад белка. Ускорение синтеза и замедление распада белка под влиянием гормона приводят к увеличению белковых запасов в интрацеллюлярном секторе.
Все эти эффекты определяют важнейшую роль инсулина в регуляции процессов роста и развития.
Инсулин и жир
Инсулин стимулирует поглощение и окисление глюкозы клетками жировой ткани. Он также стимулирует синтез липопротеиновой липазы в эндотелиальных клетках. Этот фермент катализирует гидролиз триглицеридов, связанных с липопротеинами крови, и способствует поступлению жирных кислот в адипоциты. Наряду с прямой стимуляцией липогенеза в печени и жировой ткани это приводит к увеличению запасов жира. Кроме того, инсулин ингибирует опосредуемый цАМФ липолиз, тормозя гормончувствительную внутриклеточную липопротеиновую липазу.
Инсулин и калий
Присутствие инсулина необходимо для поддержания внутриклеточной концентрации ионов калия; этот эффект, по всей вероятности, является следствием прямого влияния гормона на клеточную мембрану.
Как происходит синтез инсулина в организме
О циркадных ритмах секреции инсулина позволяет судить использование “Биостатора” и инсулинового клэмпа. При использовании “Биостатора” подающего в вену больных диабетом с абсолютной недостаточностью, инсулин в соответствии с уровнем глюкозы в крови, обнаружено повышение глюкозы ранним утром (феномен рассвета). Для позднего послеполуденного времени (приблизительно между 15 и 2 часами) характерен снижение уровня глюкозы.
Использование инсулинового клэмп-метода, предусматривающего введение глюкозы по потребности, исходит из того, что скорость введения глюкозы отражает чувствительность к инсулину. Самая низкая скорость отмечалась в 8 часов 31 мин, а самая высокая в 19 часов 4 минуты. авторы заключают, что чувствительность к инсулину снижается ночью, повышается днем. Исследователи утверждают, что циркадный ритм секреции инсулина не связан с уровнем глюкозы и инсулина в крови, клиренсом инсулина, физическими нагрузками, приемом пищи и сном. Показана отрицательная корреляция между колебаниями скорости введения глюкозы и колебаниями продукции глюкозы печенью, обусловленной изменением уровня СЖК и кортизола.
Фенотипическим признаком функции является колебательный тип секреции В-клеток. У здоровых лиц он наблюдается только натощак и полностью прекращается уже при повышении концентрации глюкозы до 6 ммоль/л. Базальная секреция инсулина у человека колеблется с периодичностью от 8 до 14 минут, с амплитудой колебаний 1,6 mед/мл, при средних значениях 4,6 mед/мл. пульсовая секреция четко коррелирует с колебаниями уровней С-пептида, глюкагона и секретина.
Первая, ранняя фаза длится около 10 минут, характеризуется пиковым выбросом около 5-7% внутриостровкового содержания инсулина, связана с пулом немедленного реагирования. Его обеспечивают гранулы, прилегающие к мембране В-клетки. Во вторую фазу секреция инсулина происходит постепенно, составляет 93-95% запасов инсулина. Для его выделения необходима АТФ-зависимая мобилизация инсулинсодержащих гранул, перемещающихся постепенно в первый пул с последующим экзоцитозом. В норме в результате первой фазы высвобождается 50-100 секреторных гранул инсулина, а в результате второй фазы β-клетка высвобождает около 40 гранул в минуту. На пике ранней инсулиновой секреции β -клетка высвобождает гранулы с интервалом в 3 секунды, в медленную фазу секреции этот период удлиняется до 10 секунд. Таким образом первая фаза секреции способствует быстрому насыщению клетки субстратами.
Ранний пик секреции инсулина играет огромную роль в обеспечении нормального метаболизма глюкозы, хотя составляет всего 10% от всего секретируемого за сутки инсулина. Это способствует быстрому поступлению веществ в клетки. У больных ИНСД и их родственников 1 степени родства, а также у лиц с нарушенной толерантностью к глюкозе были зафиксированы нарушения ранней фазы и пульсирующего характера секреции. Это нарушение секреции инсулина принято считать метаболическим маркером развития заболевания. Исчезновение раннего пика может быть зафиксировано в доклиническом периоде у лиц из группы высокого риска. Люди с ожирением возвращаются к колебательному типу секреции инсулина после потери массы тела.
Этапы синтеза инсулина
Первичная структура молекулы инсулина была расшифрована Ф. Стэнглером в 1954 году. Инсулин стал первым белком с известной аминокислотной последовательностью. Инсулин – низкомолекулярный полипептид (м.в.в. = 5800 kd), состоящий из двух цепей с разным количеством аминокислотных остатков (цепь α - 21 и цепь β - 30). Полипептидные цепи соединены между собой двумя дисульфидными связями.
Различные виды инсулина отличаются не только аминокислотным составом, но и α-спиралью, которая обусловливает вторичную структуру гормона. Более сложной является третичная структура, которая образует участки, ответственные за биологическую активность и антигенные свойства гормона. Внутреннее строение молекулы инсулина важно для взаимодействия с его рецептором и проявления биологического действия. Исследованиями с помощью рентгеновских лучей установлено, что гексамерная единица кристаллического цинк-инсулина состоит из трех димеров. Димеры инсулина связаны в кристаллы водородными мостиками между В24 и В26 пептидных групп.
Ген инсулина был выделен и изучен одним из первых. Он расположен на коротком плече 11 хромосомы. Генная сеть, регулирующая продукцию инсулина в ответ на стимуляцию глюкозой, включает следующие процессы: 1) транспорт глюкозы в клетку; 2) метаболизм глюкозы; 3) процессы секреции инсулина; 4) путь сигнальной трансдукции от рецептора инсулина. Она содержит 27 генов, 74 белка и 27 метаболитов. Продукция инсулина под действием глюкозы регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой РНК и повышением трансляции инсулиновой и-РНК.
Образование островков в поджелудочной железе крысы происходит на 10-й день онтогенеза, а на 11-й день в них уже определяется инсулин, уровень которого остается сравнительно стабильным в период с 12-го по 14-й день беременности, а затем (14- 20-й день) количество инсулина резко увеличивается. На 11-й день развития выявляется также глюкагон, и его уровень в несколько десятков раз превышает уровень инсулина. Из мезенхимальной ткани был выделен фактор, который стимулирует ДНК, РНК и синтез белка в панкреатическом эпителии эмбриона и осуществляет контроль над пролиферацией и дифференцировкой панкреатического эпителия в ацинозную ткань и B-клетки.
Биосинтез инсулина в β -клетках происходит из высокомолекулярных предшественников. Долгое время считалось, что они метаболически нейтральны. Теперь, показано, что каждый из продуктов синтеза инсулина обладает самостоятельной биологической активностью.
Сначала в эндоплазмтическом ретикулуме В-клетки синтезируется препроинсулин, имеющий в своем составе 110 аминокислотных последовательностей. Он способствует трансформации стволовых аценоинсулярных клеток в В-клетки. После отщепления т.н. сигнального полипептида, состоящего их 24 аминокислот, превращается в проинсулин. На превращение препроинсулина в проинсулин потребуется около 10-15 минут. Сигнальный полипептид, называемый еще N - концевая последовательность, направляет регенерацию В-клеток.
Проинсулин, состоящий в свою очередь, из 86 аминокислотных остатков, в аппарате Гольджи преобразуется путем отщепления С-пептида, содержащего 31 аминокислоту. Этот процесс занимает около 20-40 минут и происходит в малых (ранних) секреторных гранулах, под влиянием превращающих энзимов и с обязательной затратой энергии. Отщепление С-пептида от проинсулина происходит с помощью кальций-зависимых эндопротеаз РС2 (отщепляет С-пептид от А-цепи) и РС3 (отщепляет С-пептид от В-цепи) После этого образуются кристаллы активного инсулина, имеющего в своем составе 51 аминокислотный остаток, на что уходит 2-4 часа. И, наконец, образуются секреторные гранулы, содержащие “зрелый” инсулин, С-пептид, проинсулин (1-2%), кальций, цинк и амилин. Этот процесс длится 1-2 дня.
Скорость метаболизма проинсулина значительно ниже, чем инсулина. Кроме того, проинсулин имеет низкую аффинность к инсулиновому рецептору (5%). Секреция проинсулина влияет на скорость размножения В-клеток.
Проинсулин может попадать в кровоток, минуя секреторные гранулы. Эта нерегулируемая секреция проинсулина в норме не превышает 3-5%, но при сахарном диабете 2 типа в крови натощак определяется до 50% проинсулина. Таким образом, незрелые гранулы, содержащие проинсулин, прорываются в интерстициальное пространство. Полагаем, что это связано с цитолизом инсулоцитов и попаданием содержимого цитоплазмы в кровь.
В ряде клинических исследований была предпринята попытка использовать проинсулин в качестве потенциально длительно действующего инсулина. Однако, эти исследования были прекращены, поскольку в группе лиц, получавших проинсулин, было выявлено незначительное повышение уровня сердечной смертности.
Значение С-пептида уникально в отношении предотвращения развития осложнений сахарного диабета. В последние годы показано, что применение С-пептида вместе с инсулином для лечения больных, страдающих инсулинозависимым диабетом, приводит к стабилизации сосудистых осложнений диабета и отдаляет появление новых проявлений ангиопатии. Так, малые дозы биосинтетического С-пептида при его инфузии улучшали микроциркуляцию в мышцах, улучшали функцию почек. И, наоборот, в отсутствие С-пептида даже при нормогликемии, поддерживаемой инсулинотерапией, развивались нефропатия и микроангиопатии, свойственные диабету.
В течение последних лет внимание диабетологов привлечено к работам, в которых отмечены изменения в морфологии бета-клеток, включая фиброз островков и накопление в них амилоида. Относительно недавно обнаружено, что амилоид состоит из специфического белка амилина, структуру которого составляют 37 аминокислот. Амилин влияет на подавление постпрандиальной секреции глюкагона и продукцию глюкозы печенью; регуляцию опорожнения желудка, секрецию кишечных гормонов, ограничение уровня прандиальной гликемии. В исследованиях in vitro показано, что амилин уменьшает захват глюкозы и подавляет секрецию инсулина изолированными бета-клетками. Выдвинута гипотеза, что в связи с первичным дефектом на уровне бета-клеток при ИНСД, характеризующимся нарушением превращения проинсулина в инсулин, амилин (участник этого процесса в норме) откладывается в бета-клетках и снижает в дальнейшем секрецию инсулина. [Аметов и др. 2005].
Готовый к использованию инсулин вместе проинсулином и интермедиатными формами I и II (около 6% ), С-пептидом (94%), и ионами цинка хранится в гранулах и выводится путем экзоцитоза под влиянием разных сигналов. Инсулин, С-пептид и проинсулин различаются биологической активностью и длительностью существования. Так, период полураспада инсулина составляет 3-10 мин, С- пептида – около 30 мин, проинсулина – около 20-23 мин. По мере созревания гранул уменьшается количество проинсулина и увеличивается количество инсулина, при взаимодействии которого с ионами цинка образуются кристаллы. Они локализуются в центре гранулы и обусловливают повышенную электронную плотность при морфологических исследованиях поджелудочной железы. С-пептид располагается по периферии гранулы. В-клетки поджелудочной железы у человека содержат более десяти тысяч секреторных гранул. Одна гранула содержит около 300 000 молекул инсулина.
Читайте также:
