Андрогены - синтез, метаболизм. Андрогеновые рецепторы
Обновлено: 03.05.2024
Цель исследования. Изучение роли нарушений обмена стероидных гормонов в генезе андрогенной алопеции у женщин. Материал и методы. Приведены результаты исследования концентрации стероидных гормонов в сыворотке крови и слюне у 87 пациенток с андрогенной алопецией и 30 здоровых женщин. Результаты. Наличие регулярного менструального цикла у подавляющего большинства (87,8%) пациенток с андрогенной алопецией, низкая (10,3%) выявляемость синдрома поликистозных яичников свидетельствуют о низкой частоте клинических проявлений эндокринных нарушений у пациенток с облысением. При этом у 44,8% пациенток с андрогенной алопецией лабораторными методами диагностирован повышенный уровень дигидротестостерона, тогда как увеличение уровня тестостерона общего и свободного в сыворотке крови было определено только у 11,5 и 12,6% соответственно. Полученные данные могут косвенно указывать на повышение активности 5-α-редуктазы, посредством которой происходит конверсия тестостерона в дигидротестостерон. Показана информативность определения уровня свободного тестостерона в слюне для оценки гормонального фона у обследуемых пациенток. Заключение. Результаты исследования позволили рекомендовать определение концентрации дигидротестостерона, индекса свободных андрогенов и уровня свободного тестостерона в слюне при обследовании женщин с андрогенной алопецией для оценки гормонального фона.
Ключевые слова
Полный текст
Выпадение волос является косметическим дефектом, приводящим к психологическим проблемам и снижению качества жизни женщин молодого возраста [1]. Основная роль в формировании алопеции традиционно отводится избыточному влиянию андрогенов на волосяные фолликулы, обусловленному эндокринной патологией, ассоциированной с гиперан-дрогенией. Андрогенная алопеция входит в симпто-мокомплекс гиперандрогенных дермопатий (SAHA: Seborrhea — себорея, Acne — вульгарные угри, Hirsutism — гирсутизм и Alopecia — алопеция). Однако в научной литературе имеются указания на то, что гиперандрогения диагностируется менее чем у половины женщин с алопецией [2, 3]. Разноречивость данных литературы может быть связана с оценкой различных фракций андрогенов и использованием для этой цели разных методов исследования. Известно, что только 1—2% циркулирующего в крови тестостерона является биологически активным, большая его часть находится в связанном с белками состоянии и является неактивной [4]. В этой связи при оценке андрогенного статуса пациентов целесообразно определять, помимо измерения общего уровня андрогенов, также индекс свободных андрогенов, который отражает содержание свободных, биологически активных гормонов, не связанных с половым стероид-связываю-щим глобулином [5, 6]. В ряде публикаций представлены данные о высокой информативности определения концентрации свободного тестостерона в слюне [7, 8]. По данным P. Baxendale, концентрация этого гормона в слюне коррелирует с концентрацией его в сыворотке крови и может являться дополнительным методом оценки андрогенного статуса [9]. Однако исследования по применению этого метода для обследования пациенток с андрогенной алопецией единичны [10]. Следует отметить, что при изучении андрогенного статуса часто не учитывается уровень метаболитов половых гормонов, обладающих подчас более высокой биологической активностью, что необходимо принимать во внимание при изучении причин развития андрогензависимых состояний. Так, установлено, что тестостерон под действием 5-а-редуктазы переходит в более активный метаболит — дигидротестостерон, который способствует замедлению обменных процессов в фолликулах волосистой части головы, снижению скорости роста волос, их выпадению и истончению. В результате реакции ароматизации тестостерон и ан-дростендион превращаются в эстрогены — эстради-ол и эстрон. Ароматаза, метаболизируя андрогены в эстрогены, препятствует процессам миниатюризации волосяных фолликулов [11]. Нарушение периферического метаболизма андрогенов в результате повышения активности 5-а-редуктазы или снижения активности ароматазы может способствовать развитию андрогенной алопе ции. Однако особенности метаболизма андрогенов, в частности андроген-эстрогенового баланса, у пациенток с алопецией изучены недостаточно. Установлено, что алопеция может возникать и при отсутствии выраженных нарушений синтеза и метаболизма андрогенов. В связи с этим в последние годы была предложена классификация клинических форм заболевания в соответствии с патогенетическими механизмами его развития: шалопеция гиперандрогенная, возникающая в результате повышенного синтеза андрогенов в организме; ш алопеция, не ассоциированная с гиперандрогенны-ми состояниями у женщин репродуктивного и постменопаузального возраста [12]. Возникновение поредения волос у женщин без гиперандрогенных состояний связано с повышенной чувствительностью волосяных фолликулов к действию андрогенов у генетически предрасположенных к этому лиц [12]. Таким образом, этиология и патогенез алопеции, возникающей у женщин репродуктивного возраста, роль андрогенов в ее формировании остаются до конца не выясненными, что затрудняет разработку индивидуализированных подходов к терапии этого заболевания с учетом особенностей гормонального профиля пациенток. Цель исследования: изучение роли стероидных гормонов в генезе андрогенной алопеции у женщин репродуктивного возраста на основании определения их концентрации в сыворотке крови и слюне. Материал и методы Проведено клинико-лабораторное обследование 87 женщин, обратившихся за медицинской помощью в ФГБУ «ГНЦДК» Минздрава России по поводу поредения волос на голове. На основании результатов трихоскопии и фототрихограммы всем пациенткам был установлен диагноз андрогенной алопеции (основная группа). Возраст пациенток составил от 18 до 40 лет (M ± m: 29,5 ± 5,4 года), средняя масса тела — 64 ± 2,05 кг, все они проживали в европейской части России. Контрольную группу составили 30 здоровых женщин, не имевших клинических проявлений андрогенной алопеции и не использовавших в целях контрацепции гормональные препараты в течение 3 мес. перед началом исследования. Средние показатели возраста (29,3 ± 5,7 года) и антропометрические измерения (средняя масса тела 63 ± 1,67 кг) у женщин контрольной группы не отличались от данных, полученных в основной группе. Протокол обследования пациенток включал оценку характера менструального цикла, а также определение концентрации стероидных гормонов в сыворотке крови и тестостерона в слюне. Вестник дерматологии и венерологии Научные исследования л 29 Образцы венозной крови для исследования брали у пациенток натощак в утренние часы на 2—3-й день естественного или индуцированного прогестагенами менструального цикла. Содержание в сыворотке крови лютеинизирующего (ЛГ), фолликулостимулирующего (ФСГ), тиреотропного (ТТГ) гормонов, пролакти-на, тестостерона общего, андростендиона, кортизола, дегидроэпиандростерона сульфата (ДГЭА-С), эстра-диола, полового стероидсвязывающего глобулина (ПССГ) определяли на автоматическом иммунохеми-люминесцентном анализаторе закрытого типа Immulite 2000™ (фирмы Simens, Великобритания). Уровень свободного тестостерона, 17-гидроксипрогестерона, дигидротестостерона в сыворотке крови определяли в иммуноферментном анализе с набором реагентов «Free Testosterone ELISA» (EIA-2924), «Dihydrotestosterone ELISA» (EIA-4132), «17-ОН-progesterone ELISA» (EIA-2924) производства фирмы DRG Instruments GmbH (Россия — Германия). Для оценки биологически активного, свободного тестостерона применяли индекс свободных андрогенов (ИСА), который рассчитывали по формуле: ИСА = показатель содержания тестостерона (в нмоль/л) ж 100% / содержание ПССГ (нмоль/л). Образцы слюны для исследования пациентки собирали самостоятельно в утренние часы натощак 3 дня подряд; пробирки с образцами слюны сохраняли в морозильных отделениях бытовых холодильников, перед исследованием пробы слюны, полученные от одной пациентки, смешивали; содержание активного тестостерона определяли из полученного пула методом твердофазного иммуноферментного анализа с набором реагентов Salivatory Testosterone ELISA (SLV-3013) производства фирмы DRG Instruments GmbH (Германия). Статистическую обработку полученных данных проводили с использованием пакета статистических программ Statistica 6.0, GraphPad InStat v.3.06, Microsoft Office Excel 2007. Достоверность различий средних арифметических значений оценивали с помощью t-теста или методом Манна — Уитни. При сравнении частотных показателей для оценки достоверности использовали критерий х2 или точный критерий Фишера. Результаты исследования и обсуждение При обращении за медицинской помощью женщины с андрогенной алопецией предъявляли жалобы на повышенное выпадение волос, их истончение, расширение центрального пробора, поредение в височных областях, усиление салоотделения на коже волосистой части головы, зуд, болезненность при механическом перемещении волос во время проведения укладки, расчесывании. Дебют заболевания в возрасте до 25 лет отмечали 49 (56,3%) пациенток, в интервале 26— 30 лет — 22 (25,3%), в 31—40 лет — 16 (18,4%) женщин. Возникновение первых проявлений заболевания 13 (14,9%) пациенток связывали с нервным перенапряжением, 11 (12,6%) — с беременностью и родами, 4 (4,6%) — с отменой комбинированных оральных контрацептивов, 3 (3,4%) — с прерыванием беременности, 9 (10,3%) — с резким снижением калорийности потребляемых в пищу продуктов и диетой, одна (1,1%) — с началом курения (так как во время перерыва в применении табачных изделий в течение 1,5 года выпадение волос не беспокоило). 46 (53,1%) женщин не смогли связать начало заболевания с каким-либо определенным фактором. Исследование характера менструального цикла позволило выявить у 15 (17,2%) из 87 пациенток нарушения менструального цикла по типу олигоменореи: у 4 (4,6%) женщин — задержки менструации до 1 мес., у 6 (6,9%) — от 1 до 3 мес., у 5 (5,7%) — от 3 до 6 мес., у 2 (2,2%) отмечена вторичная аменорея. У 13 (14,9%) женщин с андрогенной алопецией имело место бесплодие. В основной группе у 15 (17,2%) пациенток были выявлены сопутствующие заболевания, сопровождающиеся нарушением обмена стероидных гормонов: синдром поликистозных яичников — у 9 (10,3%), функциональная гиперпро-лактинемия — у 4 (4,6%), гипоталамо-гипофизарная дисфункция имела место у — 2 (2,2%); у 27 (31,0%) больных были установлены сопутствующие гинекологические заболевания: функциональные кисты яичников — у 6 (6,9%), эктопия шейки матки — у 5 (5,7%), миома матки — у 5 (5,7%), аденомиоз — у 2 (2,2%), хронический сальпингоофрит — у 2 (2,2%), гиперплазия эндометрия — у 1 (1,1%), фиброзно-кистозная мастопатия — у 6 (6,9%). При анализе анамнестических данных и результатов клинического осмотра у 41 (47,1%) пациентки была диагностирована только андрогенная алопеция, у 46 (52,9%) женщин это заболевание сочеталось с другими кожными проявлениями андрогени-зации. Сочетание андрогенной алопеции с себореей наблюдали у 42 (91,3%) больных, в том числе только андрогенная алопеция и себорея — у 8 (17,5%), проявления вульгарных акне — у 16 (34,8%), гирсу-тизм — у 14 (30,4%), акне в сочетании с гирсутиз-мом — у 4 (8,7%) женщин. Сочетание андрогенной алопеции с вульгарными акне наблюдали у 2 (4,3%) пациенток, с гирсутизмом — у 2 (4,3%). Средний показатель гирсутного числа, рассчитанный по модифицированной шкале Ферримана — Голлвея [13], в основной группе обследованных пациенток был существенно выше, чем в контрольной (10,6 ± 1,8 и 6,3 ± 1,1 соответственно; р < 0,001). Таким образом, анализ анамнестических данных и результатов клинического осмотра 87 больных с андрогенной алопецией основной группы позволил на основании сочетания нескольких косвенных признаков предположить нарушения секреции стероид 30 L № 3, 2013 ных гормонов у большинства пациенток. Наличие у 46 (52,9%) больных симптомокомплекса гиперандро-генных дермопатий, у 15 (17,2%) — нарушений менструального цикла обусловило необходимость проведения дополнительного обследования пациенток для оценки уровня циркулирующих стероидных гормонов. Результаты лабораторных исследований гормонов, представленные в табл. 1, свидетельствовали о достоверном повышении в крови уровня дигидротестостерона и показателя ИСА в крови, содержания тестостерона в слюне, а также снижении уровня ПССГ в крови у женщин с андрогенной алопецией по сравнению с соответствующими показателями в контрольной группе. Полученные нами результаты координируют с данными, представленными Е. Olsen о снижении уровня ПССГ у женщин с андрогенной алопецией [14], и данными M. Birch о повышении ИСА у женщин с андрогенной алопецией в сочетании с гирсутизмом [15]. В результате проведенных исследований установлено достоверное снижение среднего уровня эстра-диола в группе женщин с андрогенной алопецией по отношению к группе контроля (p < 0,05). Для косвенной оценки метаболизма половых стероидов осуществлялся расчет некоторых соотношений концентрации эстрогенов и андрогенов. У пациенток с андрогенной алопецией выявлено двукратное снижение величины отношения уровня эстрадиола к уровню тестостерона общего и свободного в сыворотке крови по сравнению с группой контроля (p < 0,05) (табл. 1). Полученные результаты указывают на нарушение эстроген-андрогенного баланса и могут косвенно свидетельствовать о снижении ароматазной активности у женщин репродуктивного возраста с андрогенной алопецией. Концентрация свободного тестостерона в слюне была достоверно повышена у женщин, страдающих андрогенной алопецией, по сравнению с группой здоровых женщин (48,43 ± 23,74 и 29,04 ± 15,15 пг/мл соответственно; р < 0,001), тогда как показатели содержания тестостерона (общего и свободного) в сыворотке крови были менее информативными. Полученные нами результаты подтвердили данные ряда зарубежных исследований об успешном использовании слюны в качестве биологического материала для определения концентрации свободного тестостерона и информативности примененного метода исследования [7, 16, 17]. 1 Таблица 1 Содержание гормонов у женщин с андрогенной алопецией и в контрольной группе Показатель Основная группа n = 87 Контрольная группа n = 30 p ЛГ, мМЕ/мл 6,24 ± 3,27 4,68 ± 1,93 0,052 ФСГ, мМЕ/мл 6,60 ± 2,51 6,05 ± 1,93 0,467 ТТГ, мкМЕ/мл 1,53 ± 0,74 1,23 ± 0,80 0,063 Пролактин, нг/мл 11,59 ± 5,21 9,76 ± 4,96 0,096 Тестостерон свободный, пг/мл 1,05 ± 0,81 1,18 ± 0,68 0,055 Тестостерон общий, нмоль/л 38,2 ± 19,1 30,96 ± 15,17 0,063 Дигидротестостерон, пг/мл 345,75 ± 178,2 t 221,51 ± 126,06 < 0,001* Андростендион, пг/мл 2,90 ± 1,02 2,50 ± 0,85 0,057 ДГЭА-С, мкг/дл 197,58 ± 103,51 177,72 ± 84,62 0,346 17-гидроксипрогестерон, нг/мл 0,70 ± 0,24 0,62 ± 0,20 0,104 Эстрадиол, пг/мл 36,46 ± 16,26 X 63,77 ± 29,39 < 0,001* Кортизол, мкг/дл 12,26 ± 3,84 10,81 ± 4,98 0,181 Половой стероидсвязывающий глобулин, нмоль/мл 60,29 ± 37,68 72,13 ± 29,02 0,021* ИСА, % 5,61 ± 1,71 t 1,67 ± 1,01 < 0,001* Тестостерон в слюне, пг/мл 48,43 ± 23,74 t 29,04 ± 15,15 < 0,001* Эстрадиол / тестостерон общий 0,95 ± 0,45 X 2,06 ± 0,98 < 0,001* Эстрадиол / тестостерон свободный 30,45 ± 18,13 X 54,48 ± 13,42 < 0,001* Примечание. * Статистически значимые различия содержания гормонов в сыворотке крови и слюне у больных с андрогензависимой алопецией по сравнению со здоровыми женщинами контрольной группы (р < 0,05). Вестник дерматологии и венерологии Научные исследования л 31 1 Таблица 2 Характер и частота гормональных нарушений у женщин основной и контрольной групп Число выявленных случаев в группах абс, (%) Величина показателя Основная группа n = 87 Контрольная группа n = 30 p Лютеинизирующий гормон >11,6 мМЕ/мл 3 (3,4) 0 (0) 1,000 Фолликулостимулирующий гормон > 11,3 мМЕ/мл 1 (1,1) 0 (0) 1,000 Тиреотропный гормон > 4 мкМЕ/мл 0 (0) 0 (0) 1,000 Пролактин > 25 нг/мл 4 (4,6) 0 (0) 0,571 Тестостерон свободный в сыворотке крови > 4,1 пг/мл 11 (12,6) 0 (0) 0,117 Тестостерон общий в сыворотке крови > 81 нг/дл 10 (11,5) 0 (0) 0,115 Дигидротестостерон > 368 пг/мл 39 (44,8) 3 (10) < 0,001* Андростендион >3,3 пг/мл 26 (29,9) 3 (10) 0,030* 17-гидроксипрогестерон > 0,8 нг/мл 4 (4,6) 1 (3,3) 1,000 Половой стероидсвязывающий глобулин < 18 нмоль/мл 1 (1,1) 0 (0) 1,000 ИСА >8% 10 (11,5) 1 (3,3) 0,285 Тестостерон в слюне > 50,4 пг/мл 17 (19,5) 5 (10,7) 1,000 Примечание. * Статистически значимые различия в частоте гормональных нарушений при определении уровня гормонов в сыворотке крови у больных женщин по сравнению с контрольной группой (р < 0,05). Учитывая отсутствие в полученных результатах достоверных различий по средним показателям содержания андрогенов в сыворотке крови, был проведен сравнительный анализ частоты выявления повышенного уровня андрогенов у женщин с андрогенной алопецией (табл. 2). У каждой третьей пациентки основной группы (29,9%) выявлено повышение уровня андростендиона в сыворотке крови, у каждой девятой (11,5—12,6%) — повышение уровня тестостерона. У 44,8% пациенток с андрогенной алопецией выявлен повышенный уровень дигидротестостерона, тогда как увеличение содержания тестостерона общего и свободного в сыворотке крови обнаружено только у 11,5 и 12,6% женщин. Полученные данные могут косвенно указывать на повышение активности 5-альфа-редуктазы, посредством которой происходит конверсия тестостерона в дигидротестостерон. Полученные данные позволяют рекомендовать проведение оценки обмена стероидных гормонов у женщин репродуктивного возраста с андрогенной алопецией на основании определения концентраций: дигидротестостерона эстрадиола, ИСА в сыворотке крови и тестостерона в слюне. Наличие регулярного менструального цикла у подавляющего большинства пациенток (82,8%) с андрогенной алопецией и низкая выявляемость син дрома поликистозных яичников (10,3%) свидетельствуют о невысокой частоте клинических проявлений эндокринных нарушений у пациенток с облысением. В то же время у 44,8% пациенток с андрогенной алопецией лабораторными методами выявлен повышенный уровень дигидротестостерона, тогда как увеличение уровня общего и свободного тестостерона, являющегося его предшественником, в сыворотке крови обнаружено только у 11,5 и 12,6% соответственно. Из полученных данных следует, что в гене-зе заболевания играют роль нарушения метаболизма андрогенов в результате изменения ферментных систем, проявляющиеся повышением уровня более активных андрогенов, оказывающих влияние на волосяные фолликулы кожи волосистой части головы. Применение стероидных антиандрогенов, входящих в состав комбинированных оральных контрацептивов, показано только женщинам с гиперандрогенной формой алопеции. Для каждой третьей пациентки, предъявляющей жалобы на выпадение волос, характерно повышение активных метаболитов андрогенов, что обосновывает целесообразность применения нестероидных антиандрогенов, блокирующих андрогенные рецепторы и ферментные системы и опосредующих периферическую конверсию менее активных андрогенов в более активные формы. 32 L № 3, 2013 Результаты исследования позволили установить скрининговый комплекс лабораторных исследований для обследования женщин с андрогенной алопецией: определение концентрации дигидротестостерона, эстрадиола и ИСА в сыворотке крови и тестостерона в слюне. Полученные данные подтвердили целесообразность дальнейшего изучения роли эстроген-андроген-ного баланса в генезе заболевания и свидетельствовали об информативности определения тестостерона в слюне. I
Андрогены - синтез, метаболизм. Андрогеновые рецепторы
Андрогены - синтез, метаболизм. Андрогеновые рецепторы
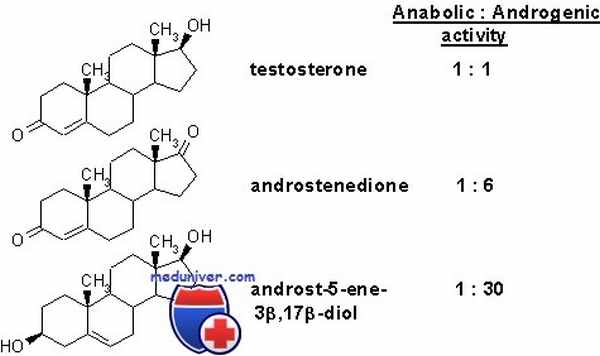
Клетки theca яичников секретируют множество андрогенов (19-углеродных стероидов), в том числе андростендион, тестостерон и ДГЭА. Андростендион — основной из них. В клетках theca содержится фермент 17р-гидроксистероиддегидрогеназа, превращающий андростендион в тестостерон. У женщин в пременопаузе по меньшей мере 60% циркулирующего тестостерона происходит из яичников за счет такого превращения или непосредственной секреции.
Андростендион и тестостерон могут превращаться в гранулезных клетках под воздействием ФСГ в эстрогены путем ароматизации. В периферических тканях андростендион может превращаться в эстрон или тестостерон. В отличие от тестостерона и дегидротестостерона андростендион не обладает высокой аффинностью к андрогеновым рецепторам (АР).
Расщепление боковой цепи холестерина с превращением его в прегненолон — одновременно и начальная точка, и определяющая скорость стадия стероидогенеза. В яичнике расщепление боковой цепи холестерина контролируется ЛГ. Главным источником холестерина для стероидогенеза в яичнике человека служат липопротеины низкой плотности. Увеличение образования цАМФ вследствие активации аденилатциклазы ЛГ стимулирует транскрипцию мРНК рецептора липопротеинов низкой плотности и соответственно повышает их захват.
После этого цАМФ-активируемый стероидогенный активный регуляторный протеин обеспечивает увеличение внутриклеточного транспорта холестерина к внутренней мембране митохондрий, где и происходит расщепление его боковой цепи.
В преовуляторном фолликуле предпочтительный путь синтеза андрогенов/эстрогенов — путь превращения прегненолона в 17-гидроксипрегненолон, так называемый d-путь. Клетки theca яичников способны ферментировать прегненолон в андрогены, но не могут превращать андростендион или тестостерон в эстрогены путем ароматизации. Этот процесс может происходить только в гранулезных клетках под действием ФСГ. В отличие от преовуляторных фолликулов в желтом теле стероидогеиез идет преимущественно по d-пути с первоначальным превращением прегненолона в прогестерон.
Андрогеновые рецепторы по строению сходен с эстрогеновым. Он активирует экспрессию гена-мишени через ту же последовательность связывания лиганда, ядерной транслокации, связывания с ДНК и комплексообразования с корегуляторами и факторами транскрипции гена. Известна ключевая роль андрогенных рецепторов в развитии мужских половых органов и вторичных половых признаков, однако их физиологическое значение для женской репродуктивной системы остается неясным. Недавние исследования на животных с андрогенной недостаточностью позволяют предположить важную роль андрогенов в созревании гранулезных клеток.
У этих животных также были отмечены снижение фертильности с нарушениями фолликулогенеза, патология созревания желтого тела и снижение чувствительности матки к гонадотропинам.
Обмен андрогенов
Андростендион в равных количествах синтезируется яичниками и надпочечниками. Его сывороточные концентрации повторяют таковые эстрадиола, колеблясь в диапазоне от 0,5 до 3 нг/мл. Содержание андростендиона повышается в период от средней до поздней фолликулиновой фазы, достигая максимума непосредственно перед пиком ЛГ. Во время овуляции оно снижается, вновь затем повышаясь до пиковой концентрации в среднюю лютеиновую фазу и падая до минимальной ко времени начала менструации.
В противоположность этому концентрация тестостерона в течение менструального цикла изменяется мало, лишь слегка повышаясь во время овуляции. Концентрация тестостерона в сыворотке крови колеблется в диапазоне 1,5-60 нг/дл.
Андрогены (лекция)
Андрогены (греч. aner, andros — мужчина и genesis — происхождение) — соединения, обладающие свойствами мужского полового гормона тестостерона (Т). Т (андрост-4-ен-17р-ол-3-он; мол, масса 288,41) является производным андростана. В 1935 г. Лакер из 100 кг семенников быков впервые выделил 10 мг чистого вещества, которое он назвал тестостероном. Его биологическая активность оказалась в 10 раз выше таковой известного к тому времени андростерона. На основании ряда исследований было высказано предположение, что Т является 17-дигидропроизводным андростендиона. Вскоре гипотетическая структура Т была расшифрована и осуществлен его синтез. Это явилось прологом для синтеза десятков производных Т с заданными свойствами. Позже из различных биологических сред человека и животных было выделено большое количество естественных андрогенов, секретируемых семенниками и надпочечниками, а также продуктов их метаболизма, экскретируемых с мочой. Биосинтез и метаболизм андрогенов. С помощью различных методов, в том числе химико-аналитических, радиоизотопных, хроматографических, перфузии семенников, исследуя продукты метаболизма, экскретируемые с мочой, удалось разработать принципиальную схему синтеза андрогенов. Аккумулируемый клетками Лейдига семенников эфир холестерина является источником образования андрогенов.
Ключевые слова
Для цитирования:
For citation:
Андрогены (греч. aner, andros — мужчина и genesis — происхождение) — соединения, обладающие свойствами мужского полового гормона тестостерона (Т). Т (андрост-4-ен-17р-ол-3- он; мол, масса 288,41) является производным андростана.
В 1935 г. Лакер из 100 кг семенников быков впервые выделил 10 мг чистого вещества, которое он назвал тестостероном. Его биологическая активность оказалась в 10 раз выше таковой известного к тому времени андростерона. На основании ряда исследований было высказано предположение, что Т является 17-дигидропроизводным андростендиона. Вскоре гипотетическая структура Т была расшифрована и осуществлен его синтез. Это явилось прологом для синтеза десятков производных Т с заданными свойствами. Позже из различных биологических сред человека и животных было выделено большое количество естественных андрогенов, секретируемых семенниками и надпочечниками, а также продуктов их метаболизма, экскретируемых с мочой.
Биосинтез и метаболизм андрогенов
С помощью различных методов, в том числе химико-аналитических, радиоизотопных, хроматографических, перфузии семенников, исследуя продукты метаболизма, экскретируемые с мочой, удалось разработать принципиальную схему синтеза андрогенов. Аккумулируемый клетками Лейдига семенников эфир холестерина является источником образования андрогенов.
Образование андрогенов в клетках Лейдига находится под регулирующим контролем лютеинизирующего гормона (ЛГ), а у развивающегося плода — хорионического гонадотропина. Функционально это единая система гипофиз — семенники, которая в свою очередь регулируется гипоталамическим гона- долиберином. В основе ее саморегуляции лежит принцип отрицательной и положительной обратной связи, впервые открытый русским ученым М. М. Завадовским. Через механизмы отрицательной обратной связи Т уменьшает импульсный выброс гонадотропинов. В этом процессе принимают участие также активные метаболиты Т дигидротестостерон и эстрадиол.
По современным представлениям, в системе регуляции имеется и механизм положительной обратной связи, где только эстрадиол, но не Т обеспечивает выброс ЛГ при определенных патофизиологических условиях, например при кастрации или гипогонадизме. Т обеспечивает ингибирующий эффект прежде всего на уровне гипоталамуса и в меньшей степени на гипофизарном уровне.
Кроме ЛГ, и другие факторы могут модулировать гормональный ответ клеток Лейдига. Например, гормон роста усиливает секрецию Т у мальчиков с дефицитом соматотропного гормона. Некоторые пептиды могут оказывать активирующее или ингибирующее влияние на секрецию Т. К ним относятся аргинин, вазопрессин, окситоцин, активин и p-эндорфин. Последний могут синтезировать семенники.
Образование андрогенов в основном по Д5-пути происходит также и в сетчатой зоне коры надпочечников. Их синтез частично контролируется адренокортикотропным гормоном гипофиза. В значительных количествах надпочечники вырабатывают дегидроэпиандростерон и в огромных количествах — его сульфатную форму. В незначительных количествах они образуют также Т, андростендион и lip-гидроксиандростенди- он. Последний могут синтезировать только надпочечники, так как фермент lip-гидроксилаза отсутствует в гонадах. В отличие от надпочечников семенники не секретируют сульфатную форму дегидроэпиандростерона. Дегидроэпиандростерон могут также синтезировать определенные структуры мозга животных и человека.
Метаболические превращения андрогенов происходят в основном в печени, а продукты их деградации выводятся главным образом с мочой в виде соединений серной или глюкуроновой кислоты. При этом Зр-оксистероиды при участии сульфокиназы конъюгируются только с серной кислотой, а Зр-ок-
17-Гидроксипро- 77-Гидроксипрогестерон гестерон
Дегидрозпиандро- Андростендион стерон
Рис. 1. Основные пути биосинтеза андрогенов в семенниках людей.
Тестостерон 5с£-андростанол- 17J3-OH-3
5/з - андростандион - 3,17
5сС- андростандион - 3,77
но ' н Андростерон
Рис. 2. Метаболизм
систероиды связаны преимущественно с глюкуроновой кислотой. Конъюгация обеспечивается глюкурозилтрансферазой. На рис. 2 показаны основные пути метаболизма андрогенов. Его направленность детерминирована реакцией восстановления в кольце А и восстановления кетогруппы в 17-м положении. Ниже горизонтальной линии представлены основные метаболиты андрогенов. Их соотношение имеет существенные видовые, а у некоторых животных и половые различия. У человека оно зависит от функционального состояния печени, щитовидной железы и других факторов.
Кортикостероиды — кортизол и кортизон — также превращаются в андрогены и выводятся с мочой К ним относятся 1 ip-оксиандростерон, 1 ip-оксиандростендион, 11-кетоандро- стерон, 11-окситестанолон, 11-кетотестанолон и адреностерон. Метаболиты Т имеют значительно меньшую андрогенную активность или лишены ее. Некоторые из них приобретают новые биологические свойства. Например, этиохоланолон оказывает пирогенное действие. В тканях-мишенях Т метаболизируется также в активные метаболиты — дигидротестостерон (ДГТ) и эстрадиол. Метаболиты с кетогруппой при 17-м атоме углерода объединяются понятием 17-кетостероиды (17-КС). Только 30% экскретируемых с мочой 17-КС являются продуктом превращения андрогенов семенников, остальные 70% имеют надпочечниковое происхождение. Определение 17-КС долгое время использовалось для оценки функции надпочечников и половых желез.
Секреция андрогенов
Метаболическая инактивация андрогенов и их экскреция компенсируются постоянной продукцией стероидов. Процессы синтеза и секреции Т протекают практически одновременно. В таблице представлен диапазон колебаний концентрации (в нмоль/л) андрогенов и их предшественников в периферической крови и в крови, оттекающей от семенника человека. В
Концентрация (в нмоль/л) стероидов в крови
наибольшем количестве семенники секретируют Т, затем андростендион, дегидроэпиандростерон и ДГТ. Доминирующим предшественником является 17а-гидроксипрогестерон.
В эксперименте на самцах обезьян с одномоментной селективной катетеризацией надпочечниковой и семенниковой вен определены количественные параметры продукции андрогенов. Семенники вырабатывают (из расчета нмоль/сут) Т — 70—90, андростендион — 17—35, ДГТ — 8—20. Надпочечники секретируют Т в 10 раз меньше, ДГТ — в сопоставимых количествах, андростендион в 10 раз больше, а продукция дегидроэпиандростерона достигает 12 мкмоль железой за сутки.
Основная часть Т (более 98%), поступающего в кровь общей циркуляции, связывается со специфическим транспортным белком — тестостерон-эстрадиолсвязывающим глобулином. Его синтез происходит в печени. На процесс связывания влияют эстрогены. Т связывается также и альбумином, хотя этот комплекс менее прочный, но он проникает через гематоэнцефалический барьер, тогда как комплекс с глобулином не проникает в мозг. Биологическое действие осуществляет свободный Т. Другой связывающий белок, называемый андро- генсвязывающим глобулином, содержится в жидкости семенных канальцев. Он обеспечивает высокую концентрацию Т внутри семенника, которая требуется для обеспечения процесса сперматогенеза. Этот белок отличается от глобулина крови как иммунологически, так и степенью сродства к Т и ДГТ.
Уровень плазменного Т существенно снижается с возрастом только в случае сопутствующих заболеваний, однако уровень свободного Т у пожилых мужчин уменьшается. С возрастом содержание в крови ДГТ немного уменьшается, но его образование в ткани предстательной железы нарастает. Это является основной причиной развития гиперплазии и аденомы предстательной железы. У пожилых мужчин снижается чувствительность андрогеновых рецепторов тканей-мишеней к Т и ДГТ, исчезает суточный ритм М. Продукция надпочечникового андрогена — дегидроэпиандростерона прогрессивно снижается после 30 лет. Стресс, курение, неблагоприятные факторы внешней среды ингибируют продукцию Т.
Биологическое действие андрогенов
Андрогены обеспечивают прежде всего регуляцию развития, роста и функцию органов и тканей репродуктивной системы. Биологическое влияние андрогенов на ткани-мишени реализуется через специфические рецепторы и во многом определяется конфигурацией молекулы стероида. Последовательность происходящих реакций под действием Т выглядит следующим образом:
- проникновение свободного Т в клетку;
- образование комплекса Т + рецептор;
- трансформация комплекса в форму, способную связываться ядерным акцептором;
- связывание с хроматиновым акцептором;
- избирательная инициация транскрипции специфических мРНК и координированный синтез транспортных и рибосомных РНК;
- процессинг первичных РНК-транскриптов;
- транспорт определенных мРНК в цитоплазму;
- трансляция поступающих мРНК и обеспечение повышенного синтеза белка;
- посттрансляционные модификации белков.
В настоящее время клонирован ген андрогенового рецептора, который всесторонне охарактеризован.
Биологические эффекты андрогенов зависят от возраста. В эмбриональный период Т обеспечивает формирование и развитие семенных пузырьков, придатка семенников и семя- выводящего протока. Процесс роста и развития предстательной железы, полового члена, мошонки и наружной уретры контролирует ДГТ, который является метаболитом Т. Он образуется непосредственно в тканях-мишенях с участием фермента 5а-редуктазы. В настоящее время доказано наличие у млекопитающих изоформ (1-й и 2-й тип) данного фермента, кодируемых разными генами. Изоформы имеют различные биохимические и фармакологические свойства, а также различное распределение в тканях. В урогенитальном тракте 2-й тип фермента содержится в мезенхимальных и стромальных клетках, которые обеспечивают формирование и последующий рост репродуктивных органов, таких как предстательная железа. Физиологическая роль изоформы 1-го типа пока неясна. Она обнаружена в коже и печени человека. Во время пуберта- ции андрогены обеспечивают развитие вторичных половых признаков, голосового аппарата, стимулируют рост (за счет повышения секреции гормона роста я усиления продукции инсулиноподобного ростового фактора I).
Андрогены необходимы для нормальной половой функции. Т инициирует и поддерживает процесс сперматогенеза, либидо и спонтанные эрекции. Он не влияет на эрекции, обусловленные визуальными стимулами. Кроме этого, для взрослого организма андрогены необходимы для поддержания вторичных половых признаков, кроветворения, мышечной и костной ткани. Они оказывают генерализованное анаболическое действие на белковый обмен (задержка азота, увеличение массы тела, суммарной массы поперечнополосатой мускулатуры и нарастание ее силы). В печени андрогены влияют на синтез различных сывороточных белков, стимулируют выработку почками эритропоэтина. Андрогены оказывают прямое действие на стволовые клетки системы кроветворения. Они стимулируют формирование кости, ее плотность, обеспечивают созревание остеобластов и хондроцитов.
Андрогены участвуют в дифференцировке мозга. В их отсутствие его развитие идет по женскому типу. Они влияют на те участки мозга, которые контролируют циклическую регуляцию секреции гонадолиберина гипоталамусом и половое поведение. Т в этом случае действует опосредованно, через ДГТ и эстрадиол, которые образуются из него с участием 5а-редукта- зы и ароматазы в специфических нейронах гипоталамуса. ДГТ, вводимый экзогенно, не воспроизводит эффектов Т, так как его молекула не подвергается ароматизации. Мозг эмбрионов обоего пола защищен от высокого уровня эстрогенов в крови матери а-фетопротеином, обладающим огромной емкостью для связывания эстрогенов.
У низших животных существует прямая корреляция между уровнем Т и агрессивным поведением. У человека такая связь не доказана.
Недостаточная продукция андрогенов приводит к развитию различных форм гипогонадизма, а избыточная — разных типов гиперандрогении.
Методы определения андрогенов
Для определения содержания андрогенов используют биохимические, химические и радиоиммунологические методы. В течение длительного времени единственно возможным подходом к оценке уровня андрогенов был биологический метод. Их биологическую активность определяли по росту гребня молодых петушков и кастрированных петухов, по массе предстательной железы и семенных пузырьков у неполовозрелых или кастрированных крыс и мышей, С домешаю этого метода тестируют андрогенную активность вновь синтезированных андрогенов, сравнивая ее с активностью Т.
Решающую роль в понимании синтеза и метаболизма андрогенов сыграли химические методы, включая все варианты хроматографии (бумажная, колоночная, тонкослойная, газожидкостная с масс-спектрометрией и высокоэффективная жидкостная хроматография). Они до сих пор остаются важными приемами для изучения метаболизма андрогенов. Метод определения 17-КС сыграл большую роль в диагностике гормональных нарушений надпочечников и семенников.
В последнее время широкое распространение получили радиоиммунологические методы определения уровня андрогенов с использованием высокоспецифических поликлональных и моноклональных антител. Они оказали определяющее влияние на развитие как экспериментальной, так и клинической эндокринологии. Их роль в развитии современной медицины ученые сравнивают с появлением телескопа в XVII веке. Чувствительность метода обеспечивает определение андрогенов в биологических средах в пикограммовых количествах. Для надежного определения Т и ДГТ требуется их предварительное хроматографическое разделение; для определения сульфатных форм андрогенов, например дегидроэпиандростерона, созданы прямые методы иммуноанализа без предварительного сольволиза. В последнее десятилетие созданы альтернативные неизотопные иммунологические методы определения гормонов. Наиболее широкое распространение получили иммуноферментные методы, люминесцентные, методы специфической флюоресценции и усиленной люминесценции. В качестве меченого компонента используются пероксидаза хрена, щелочная фосфатаза, европий, люминол, изолюминол или акридин, комбинация пероксидазы хрена с люминолом. К достоинствам этих методов относятся их высокая производительность и возможность длительного использования. Отпадают все требования и неудобства, связанные с использованием изотопных методов.
Аналоги тестостерона
Т очень быстро инактивируется в печени и поэтому имеет ограниченное значение для перорального применения в качестве заместительной терапии при различных формах гипогонадизма. С этой целью были синтезированы аналоги Т с более длительным биологическим действием. Практически все они являются эфирами Т. К ним относятся тестостерона пропионат, тестостерона энантат, который оказывает более медленное, но более продолжительное действие. При парентеральном введении он обеспечивает гормональный эффект в течение 2— 3 нед. В последнее время синтезирован новый эфир Т — тестостерона буциклат. 1 инъекция масляного раствора стероида поддерживает уровень Т в крови в пределах нормальных колебаний в течение 3 мес. Ведутся работы по использованию пролонгированных андрогенов в комбинации с прогестинами для подавления фертильности, которая достигается ингибированием сперматогенеза при сохранении либидо. Из пероральных производных Т используют метилтестостерон, однако по активности он уступает эфирам Т. Назначают препараты при половом недоразвитии, мужском климактерическом состоянии и связанных с ним сердечно-сосудистых и нервных расстройствах. Следует помнить о гепатотоксическом действии ряда производных Т.
Антиандрогены
Естественным антагонистом андрогенов является прогестерон. Некоторые его производные имеют еще более выраженное влияние. Антиандрогены, конкурируя за связь с андроге- новыми рецепторами, противодействуют эффектам Т и ДГТ в тканях-мишенях. Наиболее активным антиандрогеном является ципротеронацетат. Он применяется для лечения гирсутизма, некоторых маскулинизирующих синдромов, а также для лечения аденомы и рака предстательной железы. К более слабым антиандрогенам относятся спиронолактон и препарат нестероидной природы флутамид. В последнее время синтезирован и получил распространение в клинике новый антиандроген, специфический блокатор 5а-редуктазы финастерид, или проскар. Препарат, являясь производным стероидов андростанового ряда, избирательно блокирует 5а-редуктазную активность и тем самым снижает образование ДГТ из Т. Он практически не связывается андрогеновыми рецепторами. Успешно применяется для лечения гиперплазии предстательной железы.
Анаболические стероиды
Т оказывает выраженное анаболическое действие и является самым мощным естественным анаболическим гормоном. Поэтому снижение его продукции, обусловленное гипогонадизмом, кастрацией, сопровождается нарушением белкового обмена, атрофией скелетной мускулатуры, ожирением, развитием остеопороза. Однако применению Т как анаболика препятствует его сильное андрогенное действие. В последние годы получены производные Т с усиленными анаболическими свойствами и маловыраженной андрогенной активностью. Они получили название анаболических стероидов. К ним относятся метандростенолон (синонимы: дианабел, неробол), феноболин (синонимы: нероболил, туринабол), ретаболил (синоним: туринабол-депо), силаболин, метиландростендиол (синоним: метандриол).
Основным показанием к применению анаболических стероидов является нарушение белкового обмена (кахексия различного генеза, тяжелые травмы, ожоги, инфекционные и другие заболевания, сопровождающиеся потерей белка). Их применяют при остеопорозе, обширных пластических операциях на костях, при миопатиях и прогрессирующей мышечной дистрофии, при хронических заболеваниях почек и легких. Анаболические стероиды назначают при задержке роста, хронической недостаточности надпочечников, диабетических ангиопатиях, адипозогенитальной дистрофии, гипофизарной карликовости и др. Анаболические стероиды увеличивают фибринолиз и уровень антитромбина III. Положительное влияние анаболических стероидов на спортивные результаты научно не доказано.
Полиморфизмы генов, кодирующих ферменты метаболизма половых гормонов
Исследование полиморфизмов генов является генетическим исследованием. Поиск вариантов генов или полиморфизмов позволяет выявить варианты генов, которые оказывают неблагоприятное воздействие на организм. Например, полиморфизмы генов, отвечающих за свертывание крови важны при планировании беременности, поскольку наличие неблагоприятных аллелей (вариантов генов) может привезти к чрезмерному образованию тромбов и, как следствие, прерыванию беременности. Определение вариантов генов BRCA1 и BRCA2, CHEK2 помогает выявить риск развития рака молочной железы и начать превентивно менять свои привычки. Аналогичным образом, исследование полиморфизмов генов, кодирующих половые гормоны помогает исключить генетический фактор патологии репродуктивной сферы.
Половые гормоны
Половые гормоны относятся к группе стероидных гормонов. Стероидные гормоны помимо регулирования репродуктивной функции (прогестины, эстрогены, андрогены), отвечают за антистрессовые реакции (глюкокорткоиды) и солевой обмен (минералокортикоиды).
Общим предшественником синтеза всех стероидов является холестерин. Половые гормоны синтезируются, в основном, в яичках и яичниках, а также в коре надпочечников. Разнообразие путей биосинтеза в тканях обеспечивается действием различных ферментов, которые расположены в разных компартментах клетки — мембранах эндоплазматического ретикулума и в митохондриях.
Биосинтез и секреция половых гормонов в эндокринных железах контролируется гипофизарными гормонами: лютеинизирующим гормоном (ЛГ), фолликулостимулирующим гормоном (ФСГ). В свою очередь производство гормонов в гипофизе зависит от уровня, так называемых, высвобождающих факторов, которые образуются в верхней части мозга — гипоталамусе. Половые гормоны по механизму отрицательной обратной связи регулируют синтез гормонов гипофиза. Если концентрация половых гормонов высокая, то синтез тропных гормонов снижается, и, наоборот, при снижении концентрации половых гормонов, синтез и секреция гормонов-регуляторов возрастает.
Мужские половые гормоны
Мужские половые гормоны вырабатываются в основном в мужских половых железах — в клетках Лейдига семенников (95%). Остальные 5% андрогенов образуются в коре надпочечников. Пути биосинтеза андрогенов в яичках и коре надпочечников одинаков.
Отщепление боковой цепи холестерола и образование прегненолона — первая реакция стероидогенеза. Однако, в отличие от аналогичной реакции, протекающей в надпочечниках, эта стадия стимулируется ЛГ, а не адренокортикотропным гормоном (АКТГ).
Тестостерон
Превращение прегненолона в тестостерон может протекать двумя путями: через образование прогестерона или дегидроэпиандростерона.
Суточная секреция тестостерона у мужчин составляет в норме примерно 5 мг и сохраняется на протяжении всей жизни организма. Гормон циркулирует в крови в связанной с белками плазмы форме: альбумином (40%) и специфическим глобулином, связывающим половым гормоном (ГСПГ). Лишь 2% от общего количества гормона в крови транспортируется в свободном виде и проявляют биологическую активность.
Дигидротестостерон
В семенных канальцах, предстательной железе, коже, наружных половых органах тестостерон служит предшественником более активного андрогена — дигидротестостерона. Это превращение происходит при участии фермента — 5α-редуктазы. В процессе участвует примерно 4% тестостерона. Семенники человека секретируют в сутки 50–100 мкг дигидротестостерона. Однако большое количество гормона — следствие периферических превращений. Суммарная суточная секреция дигидротестостерона составляет 400 мкг.
В некоторых периферических тканях, небольшое количество тестостерона превращается в эстрадиол. В качестве побочных продуктов клетки Лейдига также постоянно секретируют эстрадиол и прогестерон, хотя роль этих гормонов в развитии и поддержании функций размножения и формирования полового поведения у мужчин до конца не изучена.
Андрогены действуют на другие органы и ткани помимо гонад: эмбриональные вольфовы структуры, мышцы, кости, почки, мозг. Действие андрогенов различно в разные периоды жизни. У эмбриона под действием андрогенов органы репродукции формируются по мужскому типу. У плода мужского пола происходит маскулинизация мозга. Андрогены обладают мощным анаболическим действием и стимулируют клеточное деление, поэтому в пубертатном периоде происходит резкое увеличение линейных размеров тела, скелетных мышц, костей. Андрогены вызывают изменение структуры кожи и волос, снижение тембра голоса вследствие утолщения голосовых связок и увеличения объёма гортани, стимулируют секрецию сальных желёз.
Женские половые гормоны
В яичниках синтезируются женские половые гормоны — эстрогены и прогестины, среди которых наиболее активны 17β-эстрадиол и прогестерон.
Образование эстрогенов
Согласно современным представлениям, синтез женских половых гормонов идет через образование мужских половых гормонов. Образование эстрогенов яичников предполагает выработку андрогенов (андростендиона) в клетках теки фолликулов с последующей ароматизацией андрогенов в клетках гранулёмы. В клетках теки синтезируются рецепторы ЛГ. Рецепторы ФСГ образуются в клетках гранулёмы. ЛГ, связываясь с рецепторами клеток теки, активирует фермент, катализирующий превращение холестерола в прегненолон. Эта реакция стимулирует и образование основного андрогена яичников — андростендиона. ФСГ, взаимодействуя с рецепторами клеток гранулёмы, активирует содержащийся в этих клетках комплекс, который стимулирует превращение андрогенов в эстрогены.
Непосредственно в клетках теки синтезируется малое количество эстрогенов. Значительная часть эстрогенов продуцируется путём периферической ароматизации андрогенов в жёлтом теле, фетоплацентарном комплексе (во время беременности). Дополнительно эстрогены производятся в коре надпочечников, жировой ткани, печени, коже и других тканях, где присутствует повышенная ароматазная активность.
Примерно 95% циркулирующих в крови эстрогенов связано с транспортными белками — ГСПГ и альбумином. Биологической активностью обладает только свободная форма эстрогенов. Эстрогены влияют на развитие вторичных женских половых признаков, вызывают размножение эндометрия и клеток молочной железы. Однако под влиянием эстрогенов находятся не только клетки репродуктивной сферы, но и кожа, мозг, кости, эндотелий сосудов, волосяные фолликулы. Различные нарушения в половой сфере достаточно легко предупредить, если знать о генетических особенностях ферментов, катализирующих наиболее важные реакции синтеза половых гормонов. К таким генам относятся 5а-редуктаза, SHBG, AR,CYP17.
Ген: CYP17, 17a-гидроксилаза/17,20-лиаза
Полиморфизм: A1/A2 (5′- C/T)
Продукт гена — ключевой фермент биосинтеза стероидных гормонов в яичниках и надпочечниках. Фермент присоединяет гидрокси-группу (OH) к прегненолону и прогестерону в позиции 17-го атома углерода, в результате чего образуется 17-гидроксипрегненолон и 17-гидроксипрогестерон. Также в этих молекулах фермент рассекает связь между углеродами 17 и 20, в результате образуются дегидроэпиандростерон и андростендион соответсвенно.
Повышенный уровень андрогенов (мужских половых гормонов) может быть обусловлен полиморфизмом гена CYP17, генотипы A1/A2 и A2/A2 которого соответствуют предрасположенности к невынашиванию беременности.
Ген 5 альфа-редуктаза
Полиморфизм: Val89Leu (V89L)
Фермент α-редуктаза типа 2А катализирует превращение тестостерона в биологически активную форму дигидротестостерон. Ключевой фермент в эффектах андрогенов.
Ген: SHBG, глобулин, связывающий половые гормоны (ГСПГ)
Полиморфизм: STR TAAAA(n) (полиморфизм коротких повторяющихся последовательностей).
Перенос андрогенов из источника их продукции к месту назначения происходит в связанном виде с глобулином, связывающим половые гормоны, который синтезируется в печени. Степень биологической активности андрогенов определяется уровнем свободных андрогенов (связанные с ГСПГ стероиды биологически не активны). Одной из причин высокого уровня свободного тестостерона является снижение уровня ГСПГ, с которым связывается 65% циркулирующего в крови тестостерона. Вследствие снижения уровня ГСПГ возрастает скорость превращения андростендиона в тестостерон. Снижение уровня ГСПГ в сыворотке крови происходит при ожирении, циррозе печени, вирусных гепатитах, гипотиреозе, акромегалии и лечении кортикостероидами. Низкий уровень ГСПГ в сыворотке крови может быть обусловлен сочетанием генетических и негенетических факторов.
Ген: AR, рецептор андрогенов
Полиморфизм: STR (CAG)n (полиморфизм коротких повторяющихся последовательностей).
Рецептор андрогена связывает биологически активный андроген — дигидротестостерон. При связывании рецептора с дигидротестостероном включается цепь биохимических реакций, связанных с эффектами тестостерона в андроген-зависимых тканях. Активность гена AR зависит от длины трехнуклеотидного повтора (CAG)n. От этой активности зависит и баланс между андрогенами и эстрогенами, а также активация генов, регулирующих клеточный цикл. Показана связь между гиперандрогенией, ассоциированной с синдромом поликистозных яичников, и длиной полиморфного участка (CAG)n в гене AR.
40.132 Анализ полиморфизмов в генах 5а-редуктаза, SHBG, AR,CYP17 (кодирующих ферменты метаболизма половых гормонов).
Половые гормоны

Репродуктивная функция у обоих полов полностью контролируется и регулируется гормонами. Основные половые гормоны разделены на два класса – эстрогены (женские) и андрогены (мужские). И у мужчин, и у женщин присутствуют оба вида гормонов, но в совершенно разных количествах. Так, например, суточная выработка мужского гормона тестостерона у мужчин в 20-30 раз больше чем у большинства женщин. В свою очередь, женский половой гормон эстрадиол, в небольших количествах есть и у мужчин. У женщин, кроме двух основных классов гормонов присутствует ещё один класс: гестагены, главный представитель этого класса – прогестерон. У мужчин половые гормоны образуются в ткани семенников, у женщин они синтезируются яичниками, кроме того, независимо от пола, небольшое количество гормонов вырабатывается в коре надпочечников. Считается, что эстрогены в большей степени отвечают за память, а андрогены – за познавательные функции, настроение, половое влечение. Избыток и, наоборот, дефицит гормонов одинаково неблагоприятно сказываются на здоровье. Так, дефицит и переизбыток тестостерона препятствуют созреванию яйцеклетки.
Прогестерон – основная функция состоит в подготовке организма женщины к беременности. Он необходим для поддержания беременности и тонуса гладкой мускулатуры матки. Предотвращает избыточное разрастание слизистой матки и оказывает влияние на ткань молочных желез (стимулирует рост и развитие железистой ткани молочных желез, способствует подготовке их к лактации).
Каждый месяц эстроген заставляет внутренний выстилающий слой матки – эндометрий – расти и обновляться, в то время как лютеинизирующий гормон (ЛГ) способствует высвобождению яйцеклетки в одном из яичников. На месте высвободившейся яйцеклетки образуется так называемое жёлтое тело, которое вырабатывает прогестерон. Прогестерон вместе с гормоном, выделяемым надпочечниками, останавливает рост эндометрия и подготавливает матку к возможной имплантации оплодотворенной яйцеклетки. Если оплодотворения не происходит, желтое тело исчезает, уровень прогестерона падает и наступает менструальное кровотечение. Если же оплодотворенная яйцеклетка прикрепляется к стенке матки, желтое тело продолжает производить прогестерон. Через несколько недель плацента берет на себя функцию желтого тела по выработке прогестерона, являясь основным источником этого гормона во время беременности.
Анализ используется для выявления причин бесплодия, диагностики внематочной или патологической беременности, контроля за состоянием плода и плаценты во время беременности и чтобы определить, была ли у пациентки овуляция.
Тестостерон – основной мужской половой гормон, отвечающий за формирование вторичных половых признаков и половую функцию. Его синтез стимулируется и контролируется лютеинизирующим гормоном (ЛГ), вырабатываемым гипофизом. Уровень тестостерона подвержен значительным колебаниям в течение суток, своего пика он достигает между 4 и 8 часами утра, а минимум приходится на вечерние часы (между 16:00 и 20:00).

Кроме того, его концентрация возрастает после физических нагрузок и уменьшается с возрастом. В особенно большом количестве он вырабатывается у подростков в период полового созревания. У мужчин тестостерон синтезируется яичками и надпочечниками, а у женщин – надпочечниками и в небольшом количестве яичниками.
Тестостерон способствует развитию вторичных половых признаков, таких как увеличение полового члена, рост волос на теле, развитие мышечной массы и низкий голос. У взрослых мужчин он регулирует сексуальные инстинкты и поддержание мышечной массы. Тестостерон также присутствует в организме женщины, хотя и в меньшей концентрации. От него зависят либидо (сексуальное влечение), способность к оргазмам, уровень инсулина, стройная фигура, развитие мышечной массы, костная ткань. Тестостерон отвечает за активность и переносимость эмоциональных нагрузок. В постменопаузу, когда исчезнут эстрогены и гестагены, именно тестостерон будет еще некоторое время поддерживать плотность костной ткани, сердечно-сосудистую систему и поможет легче переносить климактерический синдром.
Анализ назначается при мужском и женском бесплодии или пониженном половом влечении, замедленном либо преждевременном половом созревании у мальчиков и эректильной дисфункции у мужчин, при болезнях гипоталамуса, гипофиза, опухолях яичек.
Лютеинизирующий гормон (ЛГ) – гормон передней доли гипофиза, отвечает за бесперебойную работу всей системы половых желез, равно как и за выработку мужских и женских половых гормонов - прогестерона и тестостерона. У женщин ЛГ воздействует на клетки оболочки яичника и жёлтое тело, стимулирует овуляцию и активирует в клетках яичников синтез эстрогенов и прогестерона, у мужчин - на клетки семенников, активируя в них синтез тестостерона, благодаря чему, в частности, происходит созревание сперматозоидов.
Анализ проводится для диагностики бесплодия и оценки функционального состояния репродуктивной системы.
ФСГ (фолликулостимулирующий гормон) регулирует выработку половых гормонов, но сам не является таковым, поскольку вырабатывается не половыми железами, а гипофизом. В организме ФСГ регулирует деятельность половых желез: способствует образованию и созреванию половых клеток (яйцеклеток и сперматозоидов), влияет на синтез женских половых гормонов (эстрогенов).
У женщин ФСГ влияет на формирование фолликула . Достижение максимального уровня ФСГ приводит к овуляции . У мужчин ФСГ стимулирует рост семявыносящих канальцев , увеличивает уровень тестостерона в крови, тем самым обеспечивая процесс созревания сперматозоидов и либидо . У мужчин ФСГ стимулирует рост семявыносящих канальцев , увеличивает уровень тестостерона в крови, тем самым обеспечивая процесс созревания сперматозоидов и либидо .
Определение уровня фолликулостимулирующего гормона (ФСГ) проводится для оценки функции гипофиза, репродуктивной функции (как женщин, так и мужчин), а так же при нарушениях полового созревания у детей и подростков. Анализ назначается для определения причин нарушения менструального цикла различного генеза, диагностика дисфункциональных маточных кровотечений, дифференциальная диагностика центральных и периферических форм заболеваний женской половой системы, контроля эффективности гормонотерапии.
Пролактин – один из гормонов, синтезируемых гипофизом – железой контролирующей метаболизм, а также процессы роста и развития организма. Пролактин необходим для нормального развития молочных желез и обеспечения лактации - он увеличивает выработку молозива, способствует его созреванию и превращению в зрелое молоко. Он также стимулирует рост и развитие молочных желез, увеличение числа долек и протоков в них. Также он контролирует секрецию прогестерона и тормозит выработку фолликулостимулирующего гормона (ФЛГ), обеспечивая нормальный менструальный цикл, тормозя овуляцию и наступление новой беременности. В норме этот физиологический механизм предотвращает беременность следующим ребенком в период кормления грудью предыдущего и может предотвращать менструации в период кормления. В крови мужчин и небеременных женщин пролактин, обычно, присутствует в малых количествах. В повседневной жизни пролактин повышается во время сна, физической нагрузки и полового акта. Но у мужчин чрезмерное повышение его уровня способно нарушать половую функцию угнетая созревание сперматозоидов в яичках и вызывая бесплодие.
Анализ используется для диагностики бесплодия и нарушения половой функции, исследования функции гипофиза, выяснения причины галактореи (выделения молока или молозива вне связи с процессом кормления ребёнка), головных болей и ухудшения зрения.
Хорионический гонадотропин человека (ХГЧ) – это гормон, который вырабатывается в плодной оболочке человеческого эмбриона. ХГЧ является важным показателем развития беременности и её отклонений. Его производят клетки хориона (оболочки зародыша) сразу после его прикрепления к стенке матки (это происходит лишь через несколько дней после оплодотворения). Зародыш на этом этапе беременности представляет собой заполненный жидкостью микроскопический пузырёк, стенки которого состоят из быстро размножающихся клеток. Из одной части этих клеток и развивается будущий ребёнок (эмбриобласт), в то время как из клеток, находящихся снаружи зародыша, образуется трофобласт – та часть плодного яйца, с помощью которого оно прикрепляется к стенке матки. В дальнейшем из трофобласта образуется хорион.
Хорион выполняет функцию питания зародыша, являясь посредником между организмом матери и ребенка. Кроме того, он вырабатывает хорионический гонадотропин, который, с одной стороны, влияет на формирование ребенка, с другой – специфическим образом воздействует на организм матери, обеспечивая благополучное протекание беременности. Появление этого гормона в организме будущей матери на начальной стадии беременности и объясняет важность теста для ранней диагностики беременности.
Хорионический гонадотропин стимулирует секреторную функцию жёлтого тела яичников, которое должно продуцировать гормон прогестерон, поддерживающий нормальное состояние внутренней оболочки стенки матки – эндометрия. Эндометрий обеспечивает надёжное прикрепление плодного яйца к организму матери и его питание всеми необходимыми веществами. Благодаря достаточному количеству хорионического гонадотропина жёлтое тело, в норме существующее лишь около 2 недель в течение каждого менструального цикла, при успешном зачатии не подвергается рассасыванию и остаётся функционально активным в течение всего срока беременности. Причём именно у беременных под влиянием хорионического гонадотропина оно производит очень большие количества прогестерона. Кроме того, ХГЧ стимулирует продукцию эстрогенов и слабых андрогенов клетками яичников и способствует развитию функциональной активности самого хориона, а в дальнейшем и плаценты, которая образуется в результате созревания и разрастания хориональной ткани, улучшая её собственное питание и увеличивая количество ворсин хориона.
Таким образом, роль хорионического гонадотропина заключается в специфическом и многостороннем воздействии на организм женщины и плода в целях успешного протекания беременности.
На основании анализа на хорионический гонадотропин определяется присутствие в организме женщины хорионической ткани, а значит, и беременность. Анализ используется, в том числе, для диагностики многоплодной, внематочной и неразвивающейся беременности, выявления задержек в развитии плода, угрозы самопроизвольного аборта, недостаточности функции плаценты. Может назначаться, как часть комплексного обследования по выявлению пороков развития плода, а также для контроля за эффективностью искусственного аборта.
Свободный В-ХГЧ – Бета-субъединица хорионического гонадотропина человека – одна из составляющих молекулы специфического гормона – хорионического гонадотропина, образующегося в оболочке человеческого эмбриона. При отсутствии беременности результат теста на бета-ХГЧ будет отрицательным. Обнаружение бета-ХГЧ позволяет предположить, что после оплодотворения прошло уже как минимум 5-6 дней.
Анализ проводят в целях ранней диагностики беременности (3–5-дневной задержки менструации), выявления её осложнений и диагностики заболеваний, связанных с нарушением секреции ХГЧ.
Эстрадиол — пожалуй, основной и один из наиболее активных женских половых гормонов группы эстрогенов. Относится к типично женским гормонам, поскольку, в женском организме в значительном количестве, вырабатывается яичниками, реализуя большое количество физиологических функций. У мужчин эстрадиол тоже вырабатывается, но в очень малом количестве, и имеет скорее вспомогательные функции.
В женском организме эстрадиол играет исключительно важную роль в регуляции менструального цикла и функционировании всей половой системы. В детском и пубертатном периодах, гормон отвечает за рост и развитие всех органов, относящиеся к репродуктивной сфере. Под его влиянием происходят циклические изменения в тканях половых органов, а также формирование вторичных женских половых признаков (рост молочных желез, оволосение лобка и подмышек и т.д.). У взрослых женщин эстрадиол стимулирует течение первой фазы менструального цикла, вызывает рост и пролиферацию (активное деление клеток) эндометрия, таким образом, подготавливая его к внедрению плодного яйца, и наступлению беременности. Во время беременности эстрадиол усиливает обмен веществ во всех тканях организма. По мере развития беременности он начинает вырабатываться плацентой всё в большем и большем количестве, обеспечивая т.о. повышенные потребности в скорости обмена веществ и кровотоке у женщины. В мужском организме эстрадиол участвует в формировании спермы, т.е. необходим для зачатия. Но, всё же, для мужчин его роль не настолько значительна, как для женщин.
Определение уровня эстрадиола у женщин фертильного возраста проводится при диагностике большого числа заболеваний и состояний, таких как бесплодие, нарушения менструального цикла, отсутствие овуляций, поликистозе и опухолях яичников и т.п, а также для оценка функций плаценты на ранних сроках беременности и мониторинга при экстракорпоральном оплодотворении. Используется при диагностике и лечении остеопороза. У мужчин анализ проводится при низком качестве спермы и бесплодии, заболеваниях надпочечников и печени.
Андростендион – основной стероидный гормон, является промежуточным продуктом и основой для образования тестостерона и эстрона. Синтезируется, у мужчин и женщин, корой надпочечников и половыми железами. У обоих полов, уровень андростендиона имеет выраженные колебания, как в течении суток (максимум в утренние часы), так и с возрастом (увеличивается, примерно, с 7-и, и плавно снижается после 30 лет). У женщин показатель также зависит от фазы менструального цикла (максимум в середине) и значительно возрастает при беременности. Определение уровня андростендиона используется для оценки синтеза андрогенов (избытка секреции мужских гормонов) и диагностики различных нарушений функционирования половой и эндокринной систем.
Цены на исследования можно узнать в разделе "Прейскурант" клинической лаборатории. Кровь на исследования принимается ежедневно (кроме воскресенья) с 7 до 11 часов. Строго натощак .
Читайте также:
