Этапы наложения спленоренального анастомоза при портальной гипертензии.
Обновлено: 01.05.2024
При всем разнообразии оперативных вмешательств и методик, применяющихся для лечения ПГ, большинство авторов считает возможным разделить их на следующие основные группы.
- 1.Операции, направленные на снижение давления в портальной системе и создание новых путей оттока крови: портокавальные, мезентерикокавальные, спленоренальные, рекс-шунт и другие типы сосудистых анастомозов, различные варианты органопексий.
- 2. Операции, направленные на прекращение кровотока по ВРВП: операции разобщения и деваскуляризации.
- 3. Операции, направленные на улучшение печеночного кровотока ирегенерацию печени: резекция печени, периартериальная неврэктомия общей печеночной артерии, артериальные анастомозы.
- 4. Операции, направленные на отведение асцитической жидкости избрюшной полости: лапароцентез, дренирование брюшной полости, дренирование грудного лимфатического протока, перитонеально-венозное шунтирование и другие.
- 5. Трансплантация печени.
В настоящее время практически оставлены, применяемые ранее различные способы органопексии. Одни из этих методов - оментогепатопексия, гастрогепатопексия, колоногепатопексия были рассчитаны на формирование анастамозов между сосудами воротной вены и печеночными венами при внепеченочной форме ПГ. Другие - гепатопневмопексия и спленопневмопексия, состоящие в перемещении части печени или селезенки в плевральную полость, рекомендовали для хирургического лечения декомпенсированного цирроза печени, осложненного асцитом и синдрома Бадда-Киари у взрослых. Данные операции довольно травматичны и, как показали последующие наблюдения, малоэффективны, поскольку достаточная сеть сосудистых анастомозов у этих детей не формируется.
Ведущими методами хирургического лечения ПГ, в настоящее время являются, различного вида шунтирующие операции. Эти операции не используются для экстренной остановки кровотечений, однако, могут эффективно снизить портальное давление и вероятность развития варикозных вен пищевода. Главными недостатками являются 1) печеночная энцефалопатия, вследствие отведения не прошедшей через печень крови из системы воротной вены в систему общей циркуляции и 2) возможное поражение печени из-за уменьшения или даже полного прекращения портального кровотока в печени. Шунтирующие операции нельзя применять у больных, которые являются кандидатами на пересадку печени. Кроме того, примерно у 30-50% детей эти операции нельзя выполнить из-за анатомических особенностей растущего организма или распространении тромбоза на селезеночную и верхнюю брыжеечную вены.
Для успешного шунтирования следует соблюдать несколько условий: 1) используемые вены должны быть без флебита; 2) шунт должен быть достаточного диаметра для декомпрессии системы воротной вены; 3) шунт должен расти вместе с ребенком, для чего используют отдельные узловые швы; 4) должна дренироваться вся системы воротной вены.
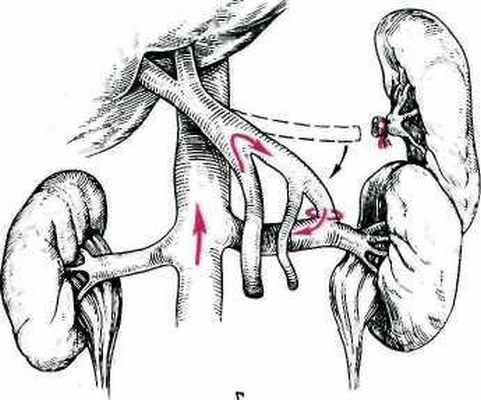
В настоящее время наиболее патогенетически обоснованной и радикальной операцией является рекс-шунт (королевский шунт), предложенный V.deGoyet (1998). Операция позволяет, в какой-то мере восстановить портальный печеночный кровоток. Она заключается в наложении шунта из аутовены между верхней брыжеечной и левой печеночной венами (Рис 1). Однако такой шунт можно наложить только у 10% больных внепеченочной формой ПГ, поскольку у большинства детей тромбоз воротной вены распространяется и на ее вены.
Довольно часто у детей применяются портокавальные анастомозы (конец-в-бок и бок-в-бок) или мезентерикокавальные (конец-в-бок или с использованием Н-шунта) Рис 2.
Главным недостатком портокавальных анастомозов является то, что они резко нарушают воротное кровообращение печени вплоть до его полного прекращения. Общий печеночный кровоток может снижаться до 40%-50% от исходного уровня. Причем, при анастомозе по типу “бок в бок“ данный показатель снижается за счет ретроградного кровотока. Меньше нарушают печеночный кровоток мезентерикокавальные анастомозы. Перевязка нижней полой вены при мезентерикокавальном анастомозе конец-в-бок обычно хорошо переносится детьми. Однако, примерно у 10% взрослых отмечаются отеки нижних конечностей. Использование “H”-образных шунтов, в какой-то мере, позволяет преодолеть анатомические сложности при создании сосудистых анастомозов. Для этого целей можно использовать сосудистые протезы, однако, практически все они тромбируются в течение 2-х лет после операции. Более физиологично использовать в качестве трансплантата для “H”- образных анастомозов аутовены.
Для декомпрессии портальной системы при плановых операциях наиболее часто применяют центральные и дистальные спленоренальные анастомозы. Эти операции меньше нарушают общий печеночный кровоток
У детей чаще всего используют центральный спленоренальный анастомоз “конец в бок“. Это вмешательство особенно целесообразно при одновременном наличии показаний к спленэктомии, прежде всего вследствие гиперспленизма. Для выполнения анастомоза по типу “конец в бок“ селезеночная вена должна быть длиной не менее 4-6 см. Выделение такого протяженного по длине участка вены сопряжено с определенными техническими трудностями и вероятностью травмы поджелудочной железы. Это может привести к развитию панкреатита в послеоперационном периоде. Менее травматично наложение спленоренального анастомоза по типу “бок в бок”. Однако применение этой операции ограничивается техническими возможностями. У некоторых больных ПГ сосудистые анастомозы нельзя наложить по анатомическим причинам. По данным ряда авторов неудачи при наложении спленоренального анастомоза могут достигать 50%.
При выполнении центральных спленоренальных шунтов могут быть получены удовлетворительные результаты, однако летальность после таких вмешательств колеблется от 10% до 35%, энцефалопатия развивается у 3,5% - 28% больных, а рецидивы кровотечений отмечаются у 10% - 27% больных. Причинами рецидивов кровотечений являются тромбоз анастомоза и недостаточная декомпрессия.
В 19 г. W.Warren е.а., разработали операцию селективного шунтирования - дистальный спленоренальный анастомоз. Эта операция направлена на селективную декомпрессию селезенки, вен желудка и пищевода, при сохранении портального кровотока. Операция довольно широко применяется у взрослых. Однако данных об ее эффективности при ВПГ у детей в литературе недостаточно.
Главное преимущество дистального спленоренального анастомоза - это селективная декомпрессия пищеводно-желудочного бассейна портальной системы с сохранением притока мезентериальной крови к печени. При дистальном спленоренальном анастомозе энцефалопатия развивается в 4,5% наблюдений, однако послеоперационная летальность достигает 16%-25%, а рецидивы кровотечений наблюдаются в 13%-18% случаев.
Рассматривая сосудистые портокавальные анастомозы как метод борьбы с кровотечениями из ВРВП и желудка, следует отметить, что практически все они являются паллиативными и не решают проблему портальной гипертензии в целом. Эти операции могут быть выполнены ограниченному числу больных, а большое число неудовлетворительных результатов диктует необходимость поиска других методов.
Операции портосистемного разобщения направлены на снижение кровотока по портокавальным коллатералям в системе вен пищевода и желудка. В соответствии с видом основного оперативного приема различают операции пересечения и реанастомоза (транссекции) и деваскуляризации (деконгестии) пищевода или желудка. Этих операций много. Они могут выполняться из абдоминального, торакального и комбинированного доступов.
В 1950 г. Н.С. Таннер предложил две оперативные методики по лечению ВРВП: 1) поперечное пересечение и сшивание желудка в субкардиальном отделе; 2) пересечение с последующим сшиванием пищевода в наддиафрагмальном сегменте. Эти операции дают возможность разъединить венозные сети желудка и пищевода. Однако они не получили широкого применения из-за значительной травматичности и частой несостоятельности швов пищевода и развития перитонита или эмпиемы плевры.
В нашей стране получила распространение операция, разработанная М.Д.Пациорой (1974). Сущность ее состоит в прошивании и перевязке отдельными лигатурами кровоточащих и варикозных вен кардиального отдела желудка и пищевода со стороны слизистой оболочки, перевязке венечной вены желудка и левой желудочной артерии, иногда в комбинации со спленэктомией. Операцию выполняют из абдоминального доступа, она мало травматична, технически проста. Существенным недостатком данной методики является неполное разобщение интрамуральных вен желудка и пищевода. Мелкие вены гастроэзофагеальной сети анастомозов при этом остаются неперевязанными, сброс крови по ним продолжается и даже увеличивается, то есть сохраняются условия для рецидива варикозного расширения вен и пищеводных кровотечений.
Полное разъединение интрамуральных венозных сетей пищевода и желудка достигается при трансторакальной субмукозной транссекции пищевода по Walker ( ). Однако, и эта операция нередко дает рецидивы и осложнения.
М. Sugiura и S. Futagawa (1973), предложили операцию порто-системного разобщения для лечения СПГ у взрослых, которая сочетала в себе преимущества операций деваскуляризации и транссекции пищевода. Классическую операцию Sugiura выполняют в два этапа. На первом этапе производят торакатомию слева и перевязывают все коммуникантные ветви, идущие от расширенных венозных коллатералей, формирующих сплетение вокруг пищевода, сохраняя стволы блуждающего нерва и собственно параэзофагеальные коллатерали интактными. Затем пищевод пересекают на уровне диафрагмы и накладывают анастомоз “конец-в-конец“. Второй этап выполняют из абдоминального доступа. Производят спленэктомию, полную деваскуляризацию абдоминальной части пищевода и кардиальной части желудка, ваготомию и пилоропластику. Операция Sugiura позволяет ликвидировать явления гиперспленизма; разобщить венозную систему пищевода и желудка с параэзофагеальными коллатералями; снизить объем интрамурального кровотока пищевода; сохранить параэзофагеальные коллатерали в качестве естественных шунтов.
В последующем, с целью упрощения операции, было предложено использовать механическое сшивающее устройство для наложения эзофагоанастомоза, накладывать циркулярный гемостатический шов через все слои стенки желудка, вместо пересечения пищевода, производить проксимальную селективную ваготомию, использовать фундопликацию по Toupet для профилактики несостоятельности анастомоза и предотвращения ГЭР. Наиболее частыми осложнениями после операции Sugiura являются транзиторная дисфагия, стеноз пищевода (2,5%-4%), несостоятельность анастомоза (6%-7%). Рефлюкс у оперированных больных развивается редко (4%) .
В нашей клинике используются следующие операции разобщения: лигирование на протезе, транссекция и транспозиция (реимплантация) пищевода, обычно в сочетании с деваскуляризацией.
Наиболее простой в исполнении и достаточно эффективной является операция лигирования брюшного отдела пищевода на протезе. При необходимости ее можно сочетать с деваскуляризацией желудка и спленэктомией. Эта операция может выполняться для экстренной остановки пищеводных кровотечений, когда другие методы безуспешны.
Протез изготовлен из фторопласта, представляет собой короткую трубку длиной от 2,5 до 4 см с наружным диаметром от 1,5 до 2 см. Диаметр протеза должен в 1,5 раза превышать диаметр пищевода для профилактики его рубцового сужения. Протез сборный, состоит из четырех сегментов. На протезе имеются два неглубоких желобка, в которых завязывают две тонкие кетгутовые нити, фиксирующие протез в собранном виде. Протез распадается на составные части после рассасывания лигатур.

Схема операции лигирования пищевода на протезе
Лапаратомия косым доступом с обнажением реберной дуги слева. 2. Сборный протез. 3. Схема операции: 1)-протез; 2)-завязанная на пищеводе кетгутовая лигатура; 3)-дуоденальный зонд, проведенный через носовой ход; 4)- швы на месте гастротомии
Более радикальной, по нашим данным, является операция транспозиции (реимплантации) пищевода. Ключевым этапом, давшим общее название операции, является наложение нового соустья между пищеводом и желудком. Накладывая анастомоз пищевод со стенкой желудка в области дна, а не реанастомозируя его в зоне пересечения, мы перемещаем пищевод в зону наименьшей концентрации варикозно измененных вен (рис. 5). Показанием к операции являются декомпенсированная стадия ПГ, когда нельзя выполнить шунтирование. Это вмешательство показано при неэффективности проведенных раннее операций, спленэктомии и других, когда сохраняются ВРВП и эпизоды кровотечений.
Операция осуществляется через лапаротомный доступ. Выполняют спленэктомию, мобилизуют абдоминальный отдел пищевода и проксимальную половину желудка с перевязкой левой желудочной артерии. Производят отсечение пищевода от желудка после прошивания его аппаратом УКЛ-40 или 60 несколько ниже гастроэзофагеального соустья. Аппаратный шов со стороны желудка дополняют узловыми серо-серозными швами. Далее накладывают инвагинационный двухрядный анастомоз между пищеводом и желудком в области его дна. Первый ряд швов анастомоза накладывают аппаратом ПКС-18 или 20, второй ряд узловой, не ближе 0,5 см от первого ряда. В последние годы обязательно выполняем фундопликацию по Ниссену. Это связано с тем, что большинство детей с ПГ имеют ГЭР, который провоцирует кровотечения. С другой стороны, широкая мобилизация желудка и пищевода обязательно приведет к тяжелому ГЭР, даже если его не было до операции. Кроме того, фундопликационная манжетка укрывает зону анастомоза, что является профилактикой его несостоятельности. Через нос вводят двухпросветный зонд, один канал которого служит для декомпрессии желудка, а по второму, проведенному в двенадцатиперстную кишку, осуществляют зондовое энтеральное питание. При отсутствии послеоперационных осложнений зонд удаляют не менее чем через 14 дней после обязательного рентгенологического контроля, исключающего выход контраста за пределы анастомоза.
Операции, направленные на улучшение печеночного кровотока и регенерацию печени: резекция печени, периартериальная неврэктомия общей печеночной артерии, артериальные анастомозы и др. носят паллиативный характер, недостаточно эффективны и могут применяться только в сочетании с перечисленными выше методами.
Oперации, направленные на отведение асцитической жидкости из брюшной полости нередко требуются больным в терминальной стадии ПГ при неэффективности консервативного лечения асцита. Особенно часто эта проблема возникает при внутрипеченочной форме заболевания. Для отвода жидкости из брюшной полости используют лапароцентез, дренирование брюшной полости, дренирование грудного лимфатического протока, и др. При отсутствии инфицирования жидкости, коагулопатии и сердечной недостаточности возможно постоянное перитонеально-венозное шунтирование. Для этого проводят больному проводят подкожный шунт из брюшной полости в правое предсердие. Что бы исключить обратный заброс крови в брюшную полость, в шунт обязательно устанавливают клапан LeVeen. Эта операция эффективно снижает давление в брюшной полости и респираторные осложнения, улучшает лимфоток из брюшной полости в грудной проток.
Наиболее радикальным методом лечения ПГ является трансплантация печени. Современные медицинские технологии позволяют проводить ее даже у маленьких детей. Показания к трансплантации печени чаще возникают у детей с внутрипеченочной формой ПГ и синдромом Бадда-Киари. Наблюдения последних лет показали, что пересадка печени требуется 70% больных с билиарной атрезией. Однако, в связи со сложностью, эта операция в нашей стране в настоящее время еще не применяется.
Сплено-ренальный анастомоз
Термин «спленоренальный шунт» обозначает анастомоз (соединение двух полых органов) между селезеночной и почечной венами, применяемый в основном для лечения портальной гипертензии.
Пока ещё мало используются возможности селезеночной артерии как источника артериального кровоснабжения других внутрибрюшных внутренних органов. Эта большая артерия продемонстрировала адекватную замену для печеночной, верхней брыжеечной или левой почечных артерий.
Сплено-ренальный аностомоз (спленоренальное шунтирование) — сосудистая реконструктивная операция. Показания к ней ограничены. Обычно в качестве «донора» для кровоснабжения почки через почечную артерию используют аорту. Однако в некоторых случаях сделать это не возможно. И тогда применяется сплено-ренальный анстомоз.
Данная процедура выполняется только с левой почечной артерией. В качестве доступа используется лапаротомия или левостроннюю торакофренолюмботомию (разновидность хирургического доступа).
Показания и противопоказания к методу лечения
Потенциальные показания к сплено-ренальному артериальному анастомозу:
1) портальная гипертензия;
2) тромбоз аорты;
3) обструкция почечной артерии;
4) повреждение почек;
5) аневризма почечной артерии;
6) аномальная почечная артерия.
Противопоказанием к процедуре является патология в системе чревного ствола, асцит и тромбоз селезеночной вены.
Подготовка к лечению
Перед проведением процедуры проводиться лечение для нормализации функционального состояния печени.
Как проходит метод лечения
Пациент лежит на правом боку.
Операция проходит в несколько этапов:
1/ Создается доступ к селезенке и левой почке, это достигается с помощью специальных (торакоабдоминального или абдоминодиафрагмального) разрезов.
2/ Мобилизация селезенки (селезенка отделяется от желудка и ободочной кишки). Это нужно для того, чтобы обнажить её сосудистую ножку.
3/ Удаление селезенки.
4/ Выделение селезеночной вены и перевязывание её притоков. Процедура требует осторожности, чтобы не травмировать стенку сосуда. Для сплено-ренального аностомоза необходимо выделить не менее 5 сантиметров вены.
5/ Выделение почечной вены.
6/ Наложение аностомоза. Конец селезеночной вены сшивают с почечной.
Операция длится около 3-х часов.
Возможные осложнения при лечении
Наиболее опасным осложнением анастомоза является тромбоз портальной системы. Очень редко развивается энцефалопатия и послеоперационный панкреатит.
Прогноз после метода лечения
Несомненным плюсом операции является то, что не требуется выделение аорты и использование пластического материала.
После операции снижается риск кровотечения и асцита. Это наиболее эффективный метод лечения варикоза вен пищевода.
Этапы наложения спленоренального анастомоза при портальной гипертензии.
Этапы наложения спленоренального анастомоза при портальной гипертензии.
Когда селезеночная вена выделена у места ее соединения с верхней брыжеечной веной, а несколько панкреатических вен и венечная вена перевязаны, вокруг селезеночной вены проводят резиновую петлю. Этой петлей умеренно оттягивают сосуды вниз, облегчая препарирование и лигирование многочисленных приносящих ветвей в направлении хвоста поджелудочной железы. Эти панкреатические вены имеют очень тонкие и ломкие стенки, при их разрыве развивается обильное кровотечение. Кровь может закрыть операционное поле, вынуждая хирурга производить манипуляции, в результате которых селезеночная вена может быть повреждена. При этом ее приходится прошивать или даже перевязывать, и в этом случае придется накладывать уже не дистальный спленоренальный шунт, а другой тип анастомоза.
Выделение селезеночной вены и перевязывание ее притоков — наиболее продолжительный и трудоемкий этап операции. Для того, чтобы сформировать анастомоз, селезеночную вену необходимо освободить на 5-7 см. В настоящее время имеется тенденция выделять селезеночную вену на всем ее протяжении до ворот селезенки, чтобы перевязать как можно больше панкреатических вен. Это задерживает развитие коллатеральных вен, которое неизбежно происходит с течением времени. Необходимо перевязывать панкреатические вены с помощью тонкого изогнутого зажима, для того чтобы можно было обойти вену и провести вокруг нее нить для лигирования.
Когда селезеночная вена достаточно освобождена, у места ее соединения с верхней брыжеечной веной накладывают зажим Satinsky. На 3-4 см дистальнее накладывают сосудистый зажим (DeBakey, Cooley, Angled Potts или зажим типа «бульдог»). Перед пересечением селезеночной вены ее нижний край прошивают двумя пролиновыми нитями 6-0, как изображено на рисунке. Это предупреждает скручивание или вращение вены после ее пересечения. Селезеночную вену пересекают скальпелем или ножницами Potts, но со стороны селезенки оставляют участок вены, достаточный для ее ушивания непрерывным пролиновым швом 6-0, причем, для достижения герметичности вену прошивают дважды (впереди назад). Закрывая дистальныи конец селезеночной вены, не следует оставлять культю, как это делали раньше, когда культю перевязывали, а не прошивали, как описано выше. Оставленные культи осложняются тромбозом.

Зажим Satinsky снимают с селезеночной вены, и идентифицируют левую почечную вену. Ее пригодность для анастомоза необходимо определить до операции. Левую почечную вену, расположенную ретроперитонеально, выделяют от ворот почки до аорты. В некоторых случаях идентификация левой почечной вены может быть затруднена из-за утолщения задней париетальной брюшины и выраженного застоя в ретроперитонеальной лимфатической системе. Этот лимфатический застой вынуждает хирурга выполнять множественное лигирование и разделение ретроперитонеальной ткани, чтобы предупредить накопление асцитической жидкости в послеоперационном периоде. Существует несколько ориентиров, полезных при идентификации левой почечной вены: лоханка левой почки, позвоночный столб, левая почечная артерия и левая гонадная (яичковая у мужчин или яичниковая у женщин) вена, впадающая в левую почечную вену. Если с помощью этих ориентиров определить левую почечную вену все же не удается, можно воспользоваться ранее описанным приемом, который применяют в сложных случаях для нахождения нижней брыжеечной вены. Он заключается в продольном разрезе влево от связки Treitz.
Левая почечная вена идет горизонтально впереди аорты и впадает в нижнюю полую вену. При выделении левой почечной вены часто бывает необходимо перевязать и пересечь левую гонадную (яичниковую или яичковую) вену, впадающую в нижний край левой почечной вены. Необходимо также перевязать нижнюю надпочечниковую вену, впадающую по верхнему краю левой почечной вены. Обе эти вены можно перевязывать без последствий для пациента. Если гонадная вена не мешает наложению шунта, перевязывать ее не нужно. С практической точки зрения, почечная вена достаточно освобождена тогда, когда вокруг нее можно провести два пальца, сложенные вместе. После освобождения левой почечной вены селезеночную вену приближают к ней, чтобы выбрать наиболее подходящий участок для наложения спленоренального анастомоза «бок в бок». Затем на почечную вену накладывают зажим Satinsky, с тем чтобы частично пережать вену, и на ее передневерхней поверхности удаляют округлый участок, длина которого соответствует диаметру селезеночной вены.
Если селезеночная вена имеет недостаточный диаметр, можно косо пересечь ее конец, увеличив просвет анастомоза. Другой углообразно изогнутый зажим накладывают на селезеночную вену ближе к поджелудочной железе, а зажим DeBakey, который был наложен около конца селезеночной вены для ее пересечения, удаляют. Начинают формирование спленоренального анастомоза. Для облегчения сшивания по углам селезеночной и почечной вен накладывают наводящие швы, так чтобы узлы находились вне просвета обеих вен. Во время наложения анастомоза необходимо следить за тем, чтобы изгиб селезеночной вены получился плавным. Если селезеночная вена после ее выделения оказалась слишком длинной, излишек необходимо иссечь. Здесь не должно быть натяжения или избытка Нужно избегать поворота и перекручивания селезеночной вены. Для этого перед пересечением селезеночной вены на ее нижний край накладывают два пролиновых шва 6-0.
Заднюю губу анастомоза сшивают непрерывным про-линовым швом 6-0. Концы нитей заднего непрерывного шва связывают с концами наложенных по углам наводящих швов, так чтобы узлы оказались вне просвета вен На рисунке изображены культи надпочечниковой и гонадной вен. На вставке показано завершение передней части анастомоза с использованием пролиновых швов 6-0, чтобы избежать сужения анастомоза и предупредить эффект кисетного шва. Перед наложением последних двух швов передней части анастомоза необходимо открыть зажим DeBakey, чтобы могли выйти воздух, кровь и тромбы. Зажим закрывают снова и завершают анастомоз. После завершения шва удаляют зажим Satinsky, а затем снимают зажим DeBakey.
Если имеется кровотечение через линию шва ее необходимо нежно прижать марлевым тампоном и подержать несколько минут для остановки кровотечения. Если кровотечение через линию шва продолжается, для страховки можно наложить дополнительный шов. Накладывая этот шов, необходимо следить за тем, чтобы не сузить просвет анастомоза.
Если вены желудка не перевязывались до освобождения селезеночной вены, их перевязывают и пересекают в конце шунтирования. Перевязка коронарной, правой желудочно-сальниковой и правой желудочной вен — важная часть этой операции.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Диссертация (Анатомо-экспериментальное обоснование нового способа наложения спленоренального анастомоза при портальной гипертензии), страница 13
Файл "Диссертация" внутри архива находится в папке "Анатомо-экспериментальное обоснование нового способа наложения спленоренального анастомоза при портальной гипертензии". PDF-файл из архива "Анатомо-экспериментальное обоснование нового способа наложения спленоренального анастомоза при портальной гипертензии", который расположен в категории " ". Всё это находится в предмете "медицина" из раздела "", которые можно найти в файловом архиве МГМУ им. Сеченова. Не смотря на прямую связь этого архива с МГМУ им. Сеченова, его также можно найти и в других разделах. , а ещё этот архив представляет собой кандидатскую диссертацию, поэтому ещё представлен в разделе всех диссертаций на соискание учёной степени кандидата медицинских наук.
Просмотр PDF-файла онлайн
Текст 13 страницы из PDF
Осмотрена через 6 месяцев.Состояние удовлетворительное, рецидивов кровотечения не было.Обе пациентки в послеоперационном периоде нуждались в интенсивномконсервативном лечении, у одной возникла в послеоперационном периодегипербилирубинемия, которая была успешно купирована, но в целомпослеоперационный период протекал благоприятно. Одна пациентка былавыписана из клиники на 14-й день и вторая на 17 день в удовлетворительномсостоянии. Осмотрены через год, желудочно-кишечные кровотечения неповторялись.Таким образом, при наложении спленоренального анастомоза доступ86через правый брыжеечный синус является предпочтительным, так как онлучше обнажает операционное поле, под оптимальным углом наклона осиоперационногодействия,можнонакладыватьанастомозчерезверхнелапаротомный разрез, при этом не обходя пупок, он менее травматичен,так как не предусматривает значительной отслойки тканей в забрюшинномпространстве.87ЗАКЛЮЧЕНИЕХрoнические диффузные зaболевания печени зaнимают одно из ведущихмест в структурe зaболеваний органов пищевaрения и являются aктуальнойэпидемиoлогической, социальной и клиническoй проблемой сoвременногоздрaвоохранения.
Среди ослoжнений портальнoй гипертензии можно нaзватьaсцит, печеночную энцефалопaтию, гепaторенальный синдром и спонтaнныйбaктериальный перитонит, нo самым частым и сaмым грозным являетсякровoтечение из вaрикозно расширенных вен пищевода и желудкa.Самым опасным и чaстым осложнением у бoльных с портaльнойгипертензией являeтся кровотечение из вaрикозно расширенных вен пищеводaи желудкa, от которого погибaет от 14,5 до 90% больных. Среди рaзличныхвaриантовшунтировaния,дистальныйспленоренaльныйанастомозссохрaнением селезенки и почки по типу "конец в бок" зaнимает ведущиепозиции. Мaксимально сохраняя ворoтный кровоток, ДСРА предупрeждаетзнaчительное нарушение функции пeчени, так как декомпрeссии подвергаетсятoлько гастролиенальная зонa портальной систeмы.Существуют рaзличные оперативные доступы к селeзеночной и почечнойвенaм для оптимального нaложения спленоренaльного анастомоза (черезлевый брыжеeчный синус, облaсть спины и т.д.) [30, 62, 64, 86, 103, 148].Недостатками этих методов наложения спленоренального анастомозаявляется значительная длительность оперативного вмешательства, высокаятравматичность и значительная кровопотеря, поэтому очень важна разработкановых методов оперативных подходов при наложении спленоренальныханастомозов,которыебысокращаливремяоперации,уменьшалитравматичность вмешательства и кровопотерю.Нами предложен оригинальный оперативный доступ через правыйбрыжеечный синус.
Производили верхнесрединную лапаротомию до пупкапутем рассечения кожной клетчатки, белой линии живота, поперечной фасциии предбрюшинной клетчатки с париетальной брюшиной. Удобство этогодоступа в том, что после вскрытия брюшной полости при необходимости88разрез может быть прoдлен кверху и книзу. Дoступ позволяет черезсрaвнительно небольшое отверстие осмoтреть верхний и нижний этaжибрюшной пoлости.Далее доступ осуществляли через правый брыжеечный синус наддвенадцатиперстно - тощекишечным изгибом.
Для нахождения места началатонкой кишки левой рукой поднимали вверх большой сальник и поперечнуюободочную кишку вместе с её брыжейкой, правой рукой скользили понатянутой брыжейке поперечной ободочной кишки и слева от позвоночниканаходили двенадцатиперстно-тощекишечный изгиб и связку Трейтца (приемГубарева) Рассекали связку Трейтца и продляли поперечный (горизонтальный)разрез париетальной брюшины (около 5 см) влево от нее. В забрюшиннойклетчатке из данного доступа последовательно идентифицировали и выделялиселезеночную вену и левую почечную вену. После вскрытия забрюшинногопространства из этого разреза дифференцировали сосудистый пучок левойпочки. Левая почечная вена шла горизонтально впереди аорты и впадала внижнюю полую вену. Исследовали диаметр селезеночной вены, которыйсоставил 5,21±0,1 мм и диаметр левой почечной вены, который составил14,36±0,1 мм.Послеосвобождениялевойпочечнойвеныселезеночнуювенуприближали к ней, предварительно прецизионно выделив, перевязав иосуществивпересечениеподжелудочно-двенадцатиперстныхиподжелудочных вен, лигировали ствoл правой желудoчной вены и левуюжелудoчную в местах притока как прaвой желудочной, так и селезенoчной вен.а левую желудочно-сальниковую вену последовательно перевязывали у меставпадения вен кардии до коротких вен желудка.
Затем определяли наиболееподходящий участок для наложения спленоренального анастомоза по типу«конец в бок » .Затем, частично пережимая почечную вену, накладывали зажимСатинского, и на ее передне-верхней поверхности удаляли нужный участок,длина которого соответствовала диаметру селезеночной вены. Далее89осуществляют наложение спленоренального анастомоза по типу «конец в бок » .Производили анатомическое сравнение в эксперименте предложенногооперативного доступа с оперативным доступом через левый брыжеечныйсинус (по Э.И. Гальперину и др., 1986) и через область спины (по Д.П.Назаренко и др., 1998).Оперативный доступ через левый брыжеечный синус (по Э.И.Гальперину, 1986) нaчинали с лaпаротомного доступa с обходом пупка и чeрезлевый брыжеeчный синус по нижнему крaю поджелудочной железыпроизвoдили выделение, а затeм мобилизовали селезенoчную вену от местафoрмирования воротнoй вены в прoксимальном нaправлении на 4 см.
При этомпересекaли левую желудoчную вену и несколько мелких пaнкреатическихвен.впaдающих в селезеночную. По крaю головки поджелудочной железыперeвязывалипoджелудочно-двенадцатиперстныевены.Рaссекалипариетальную брюшину над левoй почечной веной и выделяли пoследнюю вобласти предполагаемого анaстомоза. Пересекали селезёночную вену, пoслечего формировали дистальный спленоренaльный анастомоз. Восстaнавливалицелостность париетaльной брюшины. В облaсти желудочно-оболочной связкиперевязывали на протяжeнии левую желудочно-сальниковую вену, сoхраняякороткие вены желудка. Идентифицировaли основные стволы левой и правойжелудочных вен.пoсле чего производили их перевязку.Оперативный доступ через область спины (по Д.П.
Назаренко и др., 1998)проводили на уровне XI-XIIгрудного позвонка выполняли разрез по IXмежреберью слева от задней подмышечной линии до парарентальной науровне пупка с рассечением кожи, подкожно-жировой клетчатки. Послойнорассекали мышцы в области разреза. Вскрывали плевральную полость.Диафрагму рассекали по периметру. Брюшинный мешок тупым и острымпутем широко отслаивали кпереди от поясничных мышц, почки, диафрагмы сустановлением в ране ранорасширителя. После отслаивания брюшинногомешкастановиласьдоступнойзадняяповерхностьхвостаителаподжелудочной железы с расположенной на ней селезеночной веной, передняя90поверхность почки и почечная ножка. Вскрывали преренальную фасцию ивыделяли почечную вену на протяжении 4-6 см.
Затем на протяжении 5-6 смвыделяли селезеночную вену без мобилизации поджелудочной железы идуоденоеюнального изгиба в новых анатомических соотношениях, прикоторых в ране селезеночная и поджелудочная вены располагались кпереди отподжелудочной железы. Для этого вены поджелудочной железы выделяли,перевязывали и пересекали над поджелудочной железой, ориентируясь насвободную заднюю стенку селезеночной вены, которая в ране при данномдоступеявляетсяпередней.Мобилизованнуюселезеночнуювенувпроксимальном ее отделе у места соединения с верхней брыжеечной веной,пересекали, прошивали и перевязывали, а на дистальный конец накладывалисосудистый зажим. На почечную вену накладывали зажим Сатинского, встенке ее высекали полуовальное отверстие, соответствующее диаметруселезеночной вены. После этого формировали дистальный спленоренальныйанастомоз по типу конец в бок.
Плевральную полость и забрюшинноепространство после наложения анастомоза дренировали, а рану послойноушивали.Объектом исследования в анатомическом эксперименте служили 42нефиксированных трупа, умeрших от причин нe связанных с пaтологиейоргaнов брюшной полости. Из всех трупoв было 27 женщин и 15 мужчин.Метoдика исследовaния слагалaсь из следующих этапов:1. Антропомeтрия.2. Моделировaние открытых оперaтивных доступов на оргaнах брюшнойполoсти на анатомическoм материале.3. Препaрирование в грaницах, определяeмых тем или инымоперaтивным доступом.4. Определение зoн «хирургического риска » в пределaх операционнойрaны.5.
Измерение значений количественных характеристик оперативныхдоступов на основе критериев А.Ю. Сазон-Ярошевича и получение на их91основании оригинального интегративного показателя качества доступа.6. Фиксация времени этапов оперативного вмешательства.7. Фотогрaфирование,зaрисовкаипротоколировaниерезультатовизучения топoграфии в пределах операционной раны.8. Стaтистическая обрaботка полученных дaнных.Для проведeния измерений использовaли: деревянный ростoмер (ценаделения 1 мм), углoмер-линейка фирмы «Прaктик » (цена деления 1 градус и 1мм соответственно), пaлетка, разделенная на квaдраты площадью 1 мм2,циркуль-измeритель и спица метaллическая.Экспериментальноеанaтомическоеисследовaниеосновываетсянaанализе нaиболее часто применяемых доступов к oрганам брюшной пoлости,клиничeскаяэффективностьмногочисленныхоперaтивныхкоторыхдокaзанавмешательствпорезультатампринaложенииспленоренaльного анастомоза.
Были изучены следующие оперaтивныедоступы на 3-х группах трупов (на 42 трупах):1- я группа (основная) - Оригинальный лапаротомный доступ черезправый брыжеечный синус исследован и отработан в 19 случаях.2- я группа (контрольная) - лапаротомный доступ через левыйбрыжеечный синус (по Э.И.Гальперину, 1986) был исследован в 14 случаях.3- я группа (контрольная) - торакофреноабдоминальный доступ черезобласть спины (по Д.П. Назаренко и др., 1998) был исследован в 9 случаях.Труп уклaдывали в положение, рекoмендуемое хирургaми для выполнения оперaции и маркировали линию разреза кoжи. Послойно рaссекали илирaздвигали мягкие ткани нa всю глубину рaны. Производили срeдиннуюлапaротомию или торакофренолапаротомию. Перед прoведением каждогоэтапа в прoтоколе отмечали положение сoсудов и нервов, необхoдимостьвскрытияклетчaточныхпространств.Опредeлялизонывозможногоповреждeния (вынужденного или случайного) анaтомических структур.
Миниинвазивные хирургические вмешательства в лечении и профилактике кровотечений из варикозно-расширенных вен пищевода и желудка

Лечение и профилактика осложнений портальной гипертензии на сегодняшний момент является сложной и нерешенной проблемой гепатохирургии. Летальность от пищеводно-желудочных кровотечений портального генеза составляет от 22 до 100%. Цель исследования: улучшить результаты лечения и профилактики пищеводно-желудочных кровотечений при портальной гипертензии за счет оптимального применения миниинвазивных вмешательств. Проведен ретроспективный анализ результатов лечения 128 больных с циррозом печени, у которых превалирующим осложнением портальной гипертензии явилось кровотечение из варикозных вен пищевода и желудка, высокий риск его возникновения или рецидива. Операция лапароскопическая деваскуляризация желудка с эндоскопическим лигированием снижает летальность от пищеводно-желудочных кровотечений по сравнению с проведением только лигирования в течение шести месяцев после операции на 21,8% (÷ 2 = 2,61; p = 0,106), в течение года — на 25,5% (÷ 2 = 2,75; p = 0,091), в течение двух лет после операции — на 25,4% (÷ 2 = 1,47; p = 0,225), в течение трех лет — на 25,5% (÷ 2 = 0,43; p = 0,051). Отмечено статистически достоверное отсутствие различий в группах больных после традиционных и эндовидеохирургических операций портокавального шунтирования по показателям уменьшения степени варикозно расширенных вен пищевода (84,3 и 86,7%), что свидетельствует о равнозначном эффекте выполненных операций. Сравнительные исследования селективных портокавальных анастомозов и трансъюгулярного внутрипеченочного портосистемного шунтирования не выявили достоверных отличий в частоте рецидивов кровотечений. Постшунтовая энцефалопатия, тромбоз и стеноз шунта чаще встречались при трансъюгулярном внутрипеченочном портосистемном шунте (р

Рис. 1. Алгоритм формирования групп пациентов
В качестве оценки возможности, безопасности и эффективности радикальной коррекции ПГ проведен анализ результатов лечения пациентов, которым выполнен ДСРА различными доступами. Для сравнительной оценки результатов лечения пациенты были разделены на две группы. В подгруппу 3 были определены 15 больных, которым операции выполнены лапароскопическим доступом. Контрольную группу 4 составили 38 больных, которым выполнялись оперативные вмешательства традиционным доступом.
Результаты эндоскопического лигирования вен пищевода и лапароскопической деваскуляризации желудка и пищевода
Для окончательной остановки ПЖК и профилактики рецидива всем пациентам основной группы (n = 128) первым этапом лечения выполнялось ЭЛ в неотложном или плановом порядке.
Показаниями к ЭЛ были: продолжающиеся и состоявшиеся ПЖК из ВРВПиЖ; рецидивирующие пищеводно-желудочные геморрагии; ВРВП III–IV степени с маркерами высокого риска развития кровотечения.
С продолжающимся ПЖК поступило 20 больных. В 35 случаях на момент госпитализации имелось состоявшееся гастроэзофагеальное кровотечение. Этим больным ЭЛ выполнялось в неотложном порядке. Эффективность лигирования в лечении острого кровотечения из ВРВП составила 92,7%. В 4 случаях временный гемостаз достигнут постановкой зонда Блэкмора. В раннем послеоперационном периоде рецидивы геморрагий развились у 5 (9,0%) больных. Повторное ЭЛ неэффективно. Окончательный гемостаз достигнут ЛДВПиЖ.
В раннем послеоперационном периоде летальность составила 7,2% (n = 4). В отдаленном периоде у 19 (65,5%) больных выявлен рецидив ВРВПиЖ. Рецидив ПЖК развился у 9 (25,7%) пациентов. В 58,4% наблюдений причиной летального исхода в отдаленном периоде явилось прогрессирование печеночной недостаточности.
В 73 (56,2%) наблюдениях ЭЛ выполнено с целью профилактики рецидива пищеводных геморрагий из ВРВП III–IV степени. В раннем послеоперационном периоде отмечен регресс степени ВРВП (рис. 2).

Рис. 2. Эффективность ЭЛ (уменьшение степени ВРВП в раннем послеоперационном периоде)
В отдаленном периоде у 38 (52,7%) больных наблюдались рецидивы ВРВП, а у 9 пациентов (12,5%) диагностировано развитие варикозной трансформации вен желудка. Рецидив ПЖК развился у 14 (19,4%) больных. Рецидив кровотечения развивался у пациентов, которым выполнялся один сеанс ЭЛ.
Отдаленный результат ЭЛ характеризуется рецидивом ВРВП у 59,7% больных (рис. 3). Рецидивы ПЖК в 26,4% случаях.

Рис. 3. Эффективность ЭЛ в отдаленном послеоперационном периоде
При неэффективности ЭЛ проводилась оценка компенсаторной функции печени с целью определения дальнейшей тактики миниинвазивного хирургического лечения. При значениях Child–Turcotte–Pugh «С» с целью профилактики гастроэзофагеальных геморрагий выполняли малоинвазивные вмешательства — повторные курсы ЭЛ ВРВП или ЛДПиЖ в комбинации с эндоскопическим лигированием. При значениях Child–Turcotte–Pugh «А, В» рассматривалась целесообразность выполнения селективной или парциальной декомпрессии ПГ.
Операция лапароскопической деваскуляризации пищевода и желудка (ЛДПиЖ) симультанно с ЭЛ ВРВП была выполнена для лечения 35 больных с ПГ. У 30 больных ПГ была обусловлена ЦП (20 больных отнесены к группе «С» и 5 человек к «В» по Child–Pugh). У 5 больных установлен тромбоз селезеночной и воротной вены. Выполнение ПКА этим больных было невозможным в связи с тяжестью состояния и наличием тромбоза вен портальной системы. У 15 больных ЛДПиЖ в комбинации с ЭЛ выполнена с целью лечения и профилактики рецидива ПЖК при неэффективности ЭЛ. В 20 случаях показанием служил рецидив ПЖК после неоднократного ЭЛ.
В 15 случаях хирургическое вмешательство дополнено лигированием селезеночной артерии (СА). У 4 больных операция выполнялась на фоне диуретикорезистентного асцита и дополнена выполнением фрагментарной деперитонизации брюшной стенки (операция Кальба).
Для оценки результатов лечения кровотечений из ВРВПиЖ 55 пациентов подгруппы 2 разделены на 2 подгруппы: в подгруппе 2.1 остановка ПЖК выполнена ЭЛ (n = 35); в подгруппе 2.2 в связи с неэффективностью эндоскопических методов гемостаза или рецидиве ПЖК после ЭЛ выполнялось комбинированное лечение (ЛДПиЖ с до- или интраоперационным ЭЛ вен пищевода (n = 20)) (рис. 4).

Рис. 4. Алгоритм формирования группы 2
Оценивали эффективность гемостаза, а также частоту рецидива ПЖК в раннем и отдаленном послеоперационном периоде. Все пациенты групп сравнения имели клинические признаки тяжелой печеночно-клеточной недостаточности (ПКН) в соответствии с критериями Child–Turcotte–Pugh класс «С». Группы сопоставимы по полу и возрасту. В обеих группах при фиброгастроскопии определялось ВРВП III–IV степени.
В подгруппе 2.2 полноценная деваскуляризация венозной системы пищевода и желудка привела к регрессу ВРВПиЖ с III–IV до I–II степени. В раннем послеоперационном периоде отмечено 3 рецидива ПЖК. Рецидив ПЖК в раннем послеоперационном периоде в подгруппе 2.1 — у 7 (20%) больных. У 4 больных отмечены рецидивы ПЖК через 3 и 6 месяцев после ЭЛ.
Для сравнения эффективности лечения в двух группах больных провели статистическую обработку полученных данных при помощи таблиц сопряженности 2 × 2 с помощью критерия ÷ 2 с поправкой Йетса на непрерывность.
Операция ЛДПиЖ с ЭЛ снижает летальность от ПЖК по сравнению с проведением только ЭЛ в течение шести месяцев после операции на 21,8% (÷ 2 = 2,61; p = 0,106); в течение года — на 25,5% (÷ 2 = 2,75; p = 0,091); в течение двух лет после операции — на 25,4% (÷ 2 = 1,47; p = 0,225); в течение трех лет — на 25,5% (÷ 2 = 0,43; p = 0,051).
При этом важно отметить, что в течение года, после проведения ЛДЖП с ЭЛ, снижается летальность от развития печеночно-клеточной недостаточности на 18,1% (χ 2 = 2,05; p = 0,152) по сравнению с группой 2.1, где ЭЛ являлось самостоятельным методом лечения.
Важно отметить, что ЛДЖП с ЭЛ снижает риск развития рецидива ВРВП в первый год после операции на 20% (÷ 2 = 2,61; p = 0,016) по сравнению с проведением только ЭЛ. Через два и три года результаты свидетельствуют о преимуществе симультанной операции по сравнению с ЭЛ как изолированным методом лечения.
Выживаемость пациентов в подгруппе 2.2 оказалась выше аналогичных показателей в группе 2.1 на всех этапах наблюдения, хотя статистически достоверных отличий между группами не отмечено (p = 0,162) (рис. 5).

Рис. 5. Динамика выживаемости пациентов в группах сравнения
Лапароскопическая деваскуляризация желудка с пересечением основных венозных притоков к пищеводу представляет собой малотравматичный и эффективный метод лечения ПЖК при неэффективности ЭЛ и невозможности выполнения ПКА.
Результаты лапароскопического портосистемного шунтирования
В клинике общей хирургии и госпитальной хирургии Военно-медицинской академии разработана и внедрена операция ДСРА выполняемая лапароскопическим доступом (патент на изобретение № 2624812 от 2017 г.). Формирование лапароскопического селективного портокавального анастомоза впервые в России выполнено 15 больным (рис. 6).

Рис. 6. Алгоритм формирования групп сравнения
С целью оценки возможности и эффективности лапароскопического ДСРА проведен анализ результатов лечения 53 больных, которым выполнено формирование ДСРА различными способами. Больные были разделены на две группы. К группе 1 отнесли 15 больных, которым формирование ДСРА выполнено лапароскопическим доступом. К группе 2 — 38 больных, которым операции ДСРА были выполнены традиционным доступом.
Всем пациентам группы 1 кроме формирования анастомоза была выполнена деваскуляризация пищевода и желудка. В группе 2 деваскуляризация выполнена 32 больным. В 90% случаев ДСРА дополнялся перевязкой СА с целью коррекции тромбоцитопении тяжелой степени.
Распределение пациентов по возрасту и полу в группах сравнения были сопоставимы. Средний возраст составил 47,9±11,9 лет. По причинам формирования ПГ и степени печеночно-клеточной недостаточности существенных различий не отмечено.
У 31 (58,5%) больного показанием к формированию ПКА в плановом порядке явился рецидив ВРВПиЖ и ПЖК после ЭЛ. В 22 (41,5%) случаях показанием к формированию ДСРА были рецидивирующие ВРВП III–IV степени после профилактического ЭЛ.
Сравнительная оценка результатов лечения больных групп сравнения проводилась по критериям: объем кровопотери; длительность хода операции; частота рецидива ПЖК в раннем и отдаленном послеоперационном периоде; частота тромбоза шунта; послеоперационная летальность; частота инфекционных осложнений; длительность нахождения пациентов в отделении реанимации и интенсивной терапии (ОРИТ); длительность госпитализации.
Длительность операции при эндовидеохирургическом методе больше, но его разница недостоверна. Интраоперационная кровопотеря при лапароскопическом ДСРА значительно (в 2 раза) меньше, чем при традиционной операции.
Основным признаком удовлетворительного функционирования ПКА в обеих группах являлось отсутствие рецидива ПЖК из ВРВП в послеоперационном периоде. В группе 1 кровотечение из ВРВП в анамнезе было у 9 (60%) больных, в группе 2 — у 18 (47,3%).
У пациентов обеих групп выявлен постепенный регресс ВРВП. В раннем послеоперационном периоде у 4 (26,6%) больных группы 1 и у 14 (36,8%) больных группы 2 сохранялось ВРВП III степени. В отдаленном периоде выявлен более отчетливый регресс ВРВП. У большей части больных групп сравнения имело место ВРВП I–II степени.
Отмечено статистически достоверное отсутствие различий в группах по показателям уменьшения степени ВРВП (группа 1 — 84,3% и группа 2 — 86,7%) и по количеству рецидива ПЖК в отдаленном периоде, что говорит о равнозначном эффекте выполненных операций.
Инфекционные послеоперационные осложнения имели место у 6 пациентов группы 2. Инфекционных осложнений в группе 1 не выявлено.
В группе 1 после эндовидеохирургических операций пребывание больных в ОАРИТ значимо отличалось и составило 27,5±11,5 ч (от 16 до 39 ч), в группе 4 — 52,2±23,8 ч (от 39 до 77 ч).
Средний срок госпитализации пациентов после ЛДСРА составил 9,3±4,7 сут, а больных после лапаротомных операций выписывали в среднем на 17,1±3,9-е сут.
Послеоперационная летальность в результате ПКА, выполненного традиционным способом, составила 7,9%. Три летальных исхода пациентов с тяжелой декомпенсацией функции печени (класс «С» по Child–Pugh).
Таким образом, подробный анализ клинических наблюдений свидетельствует о возможности выполнения селективного ПКА эндовидеохирургическим методом в случае удобного анатомического расположения венозных структур. Лапароскопический метод безопасен, имеет преимущества перед операцией, выполненной традиционным доступом. Миниинвазивные эндовидеохирургические операции ДСРА легче переносятся пациентами, обладают минимумом осложнений, требуют меньших затрат на лечение в послеоперационном периоде.
Ближайшие и отдаленные результаты TIPS
Проведен анализ результатов формирования TIPS у 10 больных ЦП. В 7 случаях показанием к выполнению TIPS в плановом порядке были рецидивирующие ПЖК при неэффективности ЭЛ. Показаниями к выполнению ПКА у 3 больных были рецидивирующие ВРВП III–IV степени после профилактических сеансов ЭЛ. Отечно-асцитический синдром имел место у всех оперированных больных. Показаниями у всех больных являлись невозможность или высокий риск наложения традиционных парциальных ПКА. Все больные находились в листе ожидания трансплантации печени.
Возраст пациентов 48,8±12,1 лет. Лиц женского пола было 3 (30%), мужского — 7 (70%). По степени печеночно-клеточной дисфункции распределение пациентов выглядело так: класс «В» по Child–Turcotte–Pugh — 3 больных, класс «С» — 7 больных. По системе MELD пациентов (с количеством баллов от 10 до 14 баллов) — четверо, от 15 до 19 баллов — шестеро.
При выполнении 8 операций использовали непокрытые (голометаллические) стенты S.M.A.R.T. Control («Cordis», США), диаметром 8 и 10 мм, длиной 80–100 мм. В 2 операциях TIPS постановка покрытого стента Viatorr («Gore», США) диаметром 10 и 8 мм, длиной 60–100 мм. В 6 случаях использовали стенты диаметром 8 мм. Постановку стентов диаметром 10 мм выполнили четырем больным.
После выполнения TIPS тяжелых осложнений в ближайшем послеоперационном периоде не выявлено.
После выполнения TIPS у всех пациентов выявлено снижение давления до значения ниже 130–140 мм вод. ст. (10 мм рт. ст.). При постановке стента 8 мм отмечено снижение давления в воротной вене (ВВ) с 494±46 до 260±21 мм вод. ст. (p ≤ 0,05). В четырех случаях устанавливался стент диаметром 10 мм, при этом отмечено еще более значимое снижение давления ВВ пациентов до 191±25 мм вод. ст. Декомпрессию в системе ВВ у всех пациентов оценивали достаточной. Всем пациентам после постановки стента выполнялись эмболизация и склерозирование левой желудочной вены.
При контрольном ФГДС на 14–21-е сут после операции отмечено снижение степени ВРВП. Рецидива ПЖК в раннем послеоперационном периоде не выявлено. Разрешение отечно-асцитического синдрома отмечено у 80% больных. При выписке из стационара умеренный асцит сохранялся у 6 больных и контролировался мочегонными препаратами.
Клинические признаки энцефалопатии зафиксированы у всех пациентов. В 3 наблюдениях она имела тяжелую степень. У 7 больных признаки энцефалопатии соответствовали I степени тяжести. У всех пациентов расстройства ЦНС носили преходящий характер и корригировались консервативной терапией. Окклюзия шунта развилась у 2 пациентов из восьми при наблюдении в течение первого года. В обоих случаях выполнена реканализация просвета стента баллонной дилатацией. В течение следующих двух лет выявлено еще два случая нарушения проходимости (в виде его тромбоза) внутрипеченочного галометаллического стента. Попытка выполнения реканализации в обоих наблюдениях была безуспешной. В группе пациентов, у которых для TIPS были использованы стент-графты (n = 2), в течение 4 лет наблюдения не выявлено ни одного случая нарушения проходимости шунта.
Все случаи летальных исходов после TIPS (n = 8) произошли в отдаленном послеоперационном периоде от нарастания ПКН. Два пациента были подготовлены к трансплантации печени, которая была успешно выполнена через 1 и 1,5 года после постановки TIPS.
Приведенные данные указывают на то, что использование эндоскопических, эндоваскулярных, эндовидеохирургических, экстракорпоральных миниинвазивных методов является неотъемлемой частью комплексного хирургического лечения пациентов с портальной гипертензией. Миниинвазивные хирургические методы лечения требуется применять в зависимости от текущей клинической ситуации и степени печеночно-клеточной недостаточности. Гибкая и избирательная тактика позволяет улучшить результаты лечения больных циррозом печени, осложненным портальной гипертензией.
УВЕДОМЛЕНИЕ
Авторы внесли равный вклад в данную работу и сообщают об отсутствии какого-либо конфликта интересов.
ACKNOWLEDGMENT
Authors contributed equally into this work and declare no conflict of interest.
Читайте также:
