Фенилкетонурия
Обновлено: 02.05.2024
Фенилкетонурия (ФКУ) – достаточно тяжелое наследственное заболевание, при котором нарушение обмена аминокислот приводит к их накоплению в клетках организма. Характеризуется поражением головного мозга. При отсутствии лечения ФКУ может привести к умственной отсталости, судорогам, поведенческим проблемам и психическим расстройствам.
Ребенок, рожденный от матери, с признаками ФКУ, может иметь проблемы с сердцем, маленькую голову и низкий вес при рождении.
Симптомы ФКУ
Некоторые симптомы заболевания проявляются на 3-5 месяц жизни. Развитию первых признаков фенилкетонурии является поступление белка грудного молока или его заменителей.
Симптом ФКУ со стороны кожного покрова:
- светлая кожа и светлые волосы (обусловлены сниженной выработкой пигмента меланина);
- сыпь, напоминающая экзему, включающая аллергическое воспаление после выделения кетонов (атопический дерматит);
- чувствительность к солнечному свету (фоточувствительность) – красная или розовая кожная сыпь после воздействия солнечного света;
- увеличение частоты гнойных инфекций;
- образование ороговевших участков в волосах, на тыльной стороне рук, ягодицах и передней части бедер (кератоз пиларис);
- уменьшение доли пигментных родинок (пигментных невусов);
- склероз соединительной ткани кожи (склеродермические бляшки) – заболевание, вызывающее отвердение и сужение кожи.
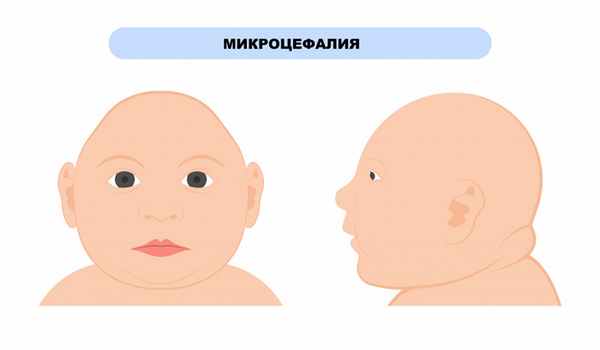
Следствием заболевания является тяжелая умственная отсталость и микроцефалия. При отсутствии терапевтических мер развиваются такие поведенческие расстройства, как самоповреждение, крайняя гиперактивность и психические припадки. Не исключен паркинсонизм (экстрапирамидные проявления) и субпигментация в радужной оболочке глаз.
Причины возникновения фенилкетонурии
Ген PAH, мутация которого вызывает развитие заболевания, кодируется с образованием белка, называемого фенилаланиновой гидроксилазой. Этот белок на самом деле является ферментом, задачей которого является преобразование аминокислоты фенилаланина в тирозин, другую аминокислоту.
Поскольку фермент не вырабатывается нормально, на медицинском языке формируется состояние, называемое гиперфенилаланинемией или ГПА. Параллельно с повышением уровня аминокислоты фенилаланина, что приводит к серьезному повреждению центральной нервной системы, образуется острый дефицит тирозина, продукта превращения фенилаланина.
Тирозин превращается в биохимическом процессе в меланин, пигмент, который придает темный цвет глазам, волосам и коже. Так, среди страдающих этим заболеванием, обычно можно увидеть очень светлые глаза, светлые волосы и кожу.
Дефектный ген передается аутосомно-рецессивно, поэтому для того, чтобы болезнь появилась у потомства, оба родителя должны быть носителями дефектного гена и оба должны передать дефектный ген потомству.
Методы диагностики ФКУ
Сегодня тест на фенилкетонурию делают в роддоме всем новорожденным через 2 дня после появления на свет. Это обследование должно своевременно выявить больных детей, чтобы назначить соответствующее лечение. Диагностика ФКУ включает:
Фенилкетонурия
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Фенилкетонурия: причины появления, симптомы, диагностика и способы лечения.
Определение
Фенилкетонурия (ФКУ) – группа аутосомно-рецессивных заболеваний, обусловленных нарушением обмена незаменимой аминокислоты фенилаланина, поступающей в организм человека с белковой пищей.
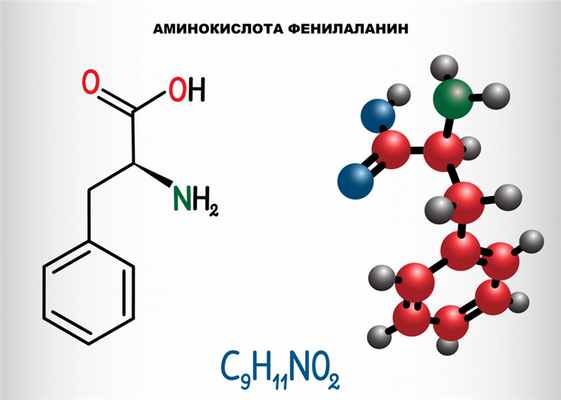
Причины появления фенилкетонурии
Причина заболевания связана с нарушением обмена незаменимой аминокислоты фенилаланина, приводящим к повышению ее уровня в крови, тканях и биологических жидкостях.
Избыток фенилаланина токсичен для нервной системы и при длительном воздействии вызывает в ней необратимые дегенеративные изменения.
Фенилаланин не синтезируется в клетках организма и поступает только с пищей. Метаболизм этой аминокислоты осуществляется двумя путями: участвует в биосинтезе белка или превращается в тирозин под действием фермента фенилаланингидроксилазы. В клетках меланоцитах, которые присутствуют в коже, волосах, сетчатке глаза, тирозин превращается в пигмент меланин. В щитовидной железе из тирозина синтезируются гормоны тироксин и трийодтиронин. В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов – дофамина, норадреналина, адреналина.
Классификация заболевания
Фенилкетонурия объединяет несколько форм нарушения обмена фенилаланина, сходных по клиническим признакам:
- классическая (ФКУ I типа), обусловленная мутацией гена ФАГ (РАН) фенилаланингидроксилазы;
- ФКУ II типа, обусловленная мутацией структурного гена для цитозольной дигидроптеридинредуктазы, что вызывает метаболический блок на путях превращения фенилаланина в тирозин, а также предшественников нейромедиаторов катехоламинового и серотонинового ряда;
- ФКУ III типа вызвана мутацией структурного гена для цитозольной пирувоилтетрагидроптерин синтазы, что приводит к ее недостаточности в печени и эритроцитах.
По уровню фенилаланина в сыворотке крови выделяют:
- легкую гиперфенилаланинемию – 120-600 мкмоль/л (2−10 мг/дл);
- умеренную (мягкую, среднюю) ФКУ – 600-1200 мкмоль/л (10−20 мг/дл);
- классическую (тяжелую) ФКУ – 1200 мкмоль/л и более (>20 мг/дл).
Новорожденный с ФКУ выглядит здоровым, а первые симптомы манифестируют при употреблении в пищу белковой пищи, содержащей большое количество фенилаланина.
Проявления заболевания зависят от тяжести мутационного повреждения фермента, степени активности фермента и сроков начала терапии.
Классическая фенилкетонурия характеризуется полным или почти полным дефицитом фенилаланингидроксилазы в печени. Проявляется у ребенка в возрасте 2-6 месяцев вялостью, отсутствием интереса к окружающему, иногда повышенным беспокойством, срыгиванием, снижением мышечного тонуса, признаками атопического дерматита, задержкой психомоторного развития, судорогами.
Эпилептические приступы могут быть первым признаком болезни и встречаются почти у половины нелеченных больных. Приступы носят упорный характер и плохо поддаются терапии.
Во втором полугодии жизни дети перестают реагировать на обращенную к ним речь, узнавать родителей, не фиксируют взгляд и не реагируют на яркие игрушки, не переворачиваются на живот, не сидят. Отмечается задержка статико-моторного и психоречевого развития.
Нарушения обмена аминокислот приводят к гипопигментации волос и кожи, поскольку у детей почти не вырабатывается пигмент меланин. В результате присутствует гиперчувствительность к инсоляции, может наблюдаться тяжелая экзема, дерматит, фолликулярный кератоз, повышенная склонность к гнойничковым инфекциям. У больных отмечают «мышиный» запах мочи, который объясняется выделением метаболитов фенилаланина. При отсутствии лечения медленно прогрессирует умственная отсталость. Могут наблюдаться двигательные, психопатоподобные и шизофреноподобные расстройства.
Умеренная фенилкетонурия характеризуется низкой остаточной ферментативной активностью. Клинически болезнь проявляется на первом-втором году жизни и медленно прогрессирует при отсутствии лечения.
Клинические проявления ФКУ II сходны с классической фенилкетонурией. Однако есть и свои особенности: гибель нейронов, кальцификация и анормальная васкуляризация центральной коры, белого вещества, базальных ганглий и таламуса, а также нарушение метаболизма фолатов. В клинической картине преобладает тяжелая умственная отсталость, судороги, признаки повышенной возбудимости, мышечная дистония (непроизвольные движения и формирование патологических поз), спастический тетрапарез (комплекс двигательных нарушений верхних и нижних конечностей).
Проявления фенилкетонурии III напоминают болезнь Паркинсона. Наблюдаются затруднения в удержании равновесия в определенной позе или при смене позы, недостаточная двигательная активность с ограничением скорости и объема движений, увеличение секреции слюнных желез, нарушения глотания, а также тяжелая умственная отсталость, микроцефалия.
Игнорирование рекомендаций по диетотерапии, недостаточный контроль уровня фенилаланина в крови могут иметь отдаленные последствия: низкий коэффициент интеллекта, замедленная речь, нарушения памяти, проблемы с концентрацией внимания и поведением.
У взрослых пациентов, прекративших соблюдение диеты, наблюдается ухудшение неврологического и психологического состояния, возникает поздняя эпилепсия, атаксия, тремор, депрессивные расстройства, неврозы.
Если пациенты соблюдают диету с ограничением высокобелковых продуктов, но не принимают специальные аминокислотные смеси без фенилаланина, существует риск развития дефицита витаминов, микро- и макроэлементов.
Женщинам с ФКУ до зачатия и во время беременности необходимо строго придерживаться рекомендованного врачом диетического питания, в противном случае у родившихся детей может диагностироваться синдром материнской фенилкетонурии, который проявляется дисморфией лица, задержкой умственного и физического развития, микроцефалией (значительным уменьшением размера черепа), врожденными пороками сердца.
Диагностика фенилкетонурии
Определить риск рождения ребенка с ФКУ можно с помощью генетической экспертизы у обоих родителей до зачатия ребенка:
- фенилкетонурия, PAH м.;
Исследование мутаций в гене PAH. Фенилкетонурия (гиперфенилаланинемия, ФКУ, ГФА, OMIM261600) - группа гетерогенных аутосомно-рецессивных заболеваний, обусловл�.
Фенилкетонурия (ФКУ)
Фенилкетонурия это нарушение метаболизма аминокислот Обзор нарушений метаболизма аминокислот и органических кислот (Overview of Amino Acid and Organic Acid Metabolism Disorders) Почки активно реабсорбируют значительные количества аминокислот. Дефекты переноса аминокислот в почечной канальце включают цистинурию и болезнь Хартнупа, которые обсуждаются в другом месте. Прочитайте дополнительные сведения , приводящее к возникновению клинического синдрома умственной отсталости с когнитивными и поведенческими расстройствами, вызванными повышенным уровнем фенилаланина. Основной причиной является недостаточность активности фенилаланин гидроксилазы. Диагноз ставят на основании выявления высокого уровня фенилаланина при нормальном или низком содержании тирозина. Лечение – пожизненная диета без фенилаланина. Прогноз при лечении отличный.
Для получения информации о других нарушениях аминокислот, см. таблицу нарушения обмена фенилаланина и тирозина Нарушения метаболизма фенилаланина и тирозина . См. также Подходы к лечению пациентов с подозрением на наследственное нарушение обмена веществ (Approach to the Patient With a Suspected Inherited Disorder of Metabolism) Подходы к лечению пациентов с подозрением на наличие наследственного заболевания обмена веществ Большинство наследственных нарушений метаболизма (врожденные нарушения обмена веществ) являются редкими, и, следовательно, для их диагностики необходим более высокий индекс подозрения. Своевременная. Прочитайте дополнительные сведения .
Патофизиология фенилкетонурии
Избыточно потребляемый фенилаланин (т.е. не использующийся для синтеза белка), как правило, преобразуется в тирозин фенилаланингидроксилазу; тетрагидробиоптерин (BH4) является необходимым кофактором в данной реакции. Когда одна из нескольких мутаций гена приводит к недостаточности или отсутствию фенилаланингидроксилазы, происходит накопление потребляемого фенилаланина; мозг является основным повреждаемым органом, возможно, из-за нарушения миелинизации.
Некоторый избыток фенилаланина метаболизируется в фенилкетоны, которые выводятся из организма с мочой, что приводит к развитию фенилкетонурии. Степень дефицита фермента и, следовательно, тяжести гиперфенилаланинемии варьируется среди пациентов в зависимости от конкретной мутации.
Варианты заболевания
Хотя почти все случаи (98–99%) ФКУ развиваются в результате дефицита фенилаланингидроксилазы, фенилаланин также может накапливаться, если BH4 не синтезируется из-за недостаточности дигидроптерин синтазы или не регенерируется из-за недостаточности дигидропиридин редуктазы. Кроме того, поскольку BH4 также является кофактором тирозингидроксилазы, участвующей в синтезе дофамина и серотонина, дефицит BH4 изменяет синтез медиаторов, вызывающих неврологические симптомы независимо от накопления фенилаланина.
Симптомы и признаки фенилкетонурии
Большинство детей с фенилкетонурией при рождении нормальные, симптомы и признаки появляются постепенно, в течение нескольких месяцев, по мере накопления фенилаланина. Отличительная черта нелеченой ФКУ – тяжелая умственная отсталость. У детей также возникают крайняя гиперактивность, нарушение походки, психозы, часто возникает неприятный «мышиный» запах тела, обусловленный фенилуксусной кислотой (продукт распада фенилаланина) в моче и поте. Кроме того, дети, как правило, имеют более светлую кожу, волосы и цвет глаза, чем непоражённые члены семьи, и у некоторых из них болезнь может проявляться сыпью, похожей на младенческую экзему.
Диагностика ФКУ
Рутинный неонатальный скрининг
(См. также the American College of Medical Genetics and Genomics Therapeutic Committee's 2013 diagnosis and management guidelines for phenylalanine hydroxylase deficiency.)
В США и многих развитых странах, всем новорожденным проводят скрининг на фенилкетонурию Скрининговые тесты для новорождённых Рекомендации по скринингу новорожденных зависят от клинических условий и государственных стандартов. Определение группы крови показано, если мать имеет кровь группы 0 или резус-отрицательную. Прочитайте дополнительные сведения в течение 24-48 часов после рождения, проводя один из нескольких анализов крови Начальное тестирование Большинство наследственных нарушений метаболизма (врожденные нарушения обмена веществ) являются редкими, и, следовательно, для их диагностики необходим более высокий индекс подозрения. Своевременная. Прочитайте дополнительные сведения ; отклоняющиеся от нормы результаты подтверждают непосредственным измерением уровня фенилаланина. В классической ФКУ уровни фенилаланина у новорожденных часто составляют > 20 мг/дл (1,2 ммоль/л). Те, у кого есть частичный недостаток, как правило, имеют уровни 8–10 мг/дл, в то время как на обычной диете уровни > 6 мг/дл уже требуют лечения; для отличия от классической ФКУ требуется анализ мутаций, идентифицирующий незначительные мутации гена или, реже, измерение активности фенилаланин-гидроксилазы печени, которое показывает уровень активности в 5–15% от нормального.
Дефицит BH4 отличается от других форм ФКУ повышенными концентрациями биоптерина или неоптерина в моче, крови, спинномозговой жидкости или во всех 3 жидкостях; также можно использовать генетическое тестирование. Распознавание важно, биоптериновый профиль мочи при первичной диагностике нужно определять регулярно, поскольку стандартное лечение ФКУ не предотвращает неврологические повреждения.
Диагностику у детей в семьях с положительным семейным анамнезом можно проводить пренатально с помощью прямого исследования мутации после биопсии хориона или амниоцентеза.
Прогноз при ФКУ
Адекватное лечение, начатое в первые дни жизни, предотвращает возникновение тяжелых проявлений заболевания. Тем не менее умеренный когнитивный дефицит и проблемы с психическим здоровьем все еще могут возникать даже при хорошем диетическом контроле. Лечение, начатое после 2–3 лет, может быть эффективно только в контроле крайней гиперактивности и некупируемых судорог.
Дети, рожденные от матерей с плохо контролируемой ФКУ (т.е. имеющих высокий уровень фенилаланина), во время беременности имеют высокий риск микроцефалии и дефектов развития.
Лечение ФКУ
Ограничение потребления фенилаланина
Лечение фенилкетонурии заключается в соблюдении пожизненной диеты без фенилаланина. Все природные белки содержат около 4% фенилаланина. Поэтому основные продукты питания включают
Натуральные продукты с низким содержанием белка (например, фрукты, овощи, некоторые злаки)
Белковые гидролизаты, из которых удален фенилаланин
Смеси аминокислот без фенилаланина
Примерами коммерчески доступных продуктов без фенилаланина являются продукты PKU Anamix ® (для младенцев), XPhe Maxamaid ® (для детей от 1 до 8 лет), XP Maxamum ® (для детей > 8 лет); Phenex ® -1 и Phenex ® -2; Phenyl-Free ® 1 и Phenyl-Free ® 2; PhenylAde ® (различные); PKU Lophlex ® LQ; и Phlexy-10 ® (различные формы). Некоторое количество фенилаланина необходимо для роста и метаболизма; эта потребность удовлетворяется за счет измеряемых количеств природного белка с молоком или фруктами с низким содержанием белка.
Требуется частый мониторинг уровней фенилаланина в плазме; рекомендуемые значения для всех детей располагаются в пределах 2–6 мг/дл (120–360 мкмоль/л). Планирование диеты и управление ею должно войти в привычку у женщин детородного возраста до беременности – так они помогут своим будущим детям. Тирозин используют чаще, поскольку это незаменимая аминокислота у пациентов с ФКУ. Кроме того, всем пациентам с дефицитом фенилаланин-гидроксилазы необходимо провести пробное назначение сапроптерина, назначение которого может иметь преимущества.
Для лиц с BH4-недостаточностью лечение также включает тетрагидробиоптерин по 1–5 мг/кг перорально 3 раза в день, леводопу, карбидопу и 5-OH триптофан и фолиевую кислоту по 10–20 мг перорально 1 раз в день при дефиците дигидроптерин-редуктазы. Тем не менее цели лечения и подход являются такими же, как при ФКУ.
Ключевые моменты
ФКУ возникает как последствие, когда одна из нескольких мутаций гена приводит к недостаточности или отсутствию фенилаланингидроксилазы, вслседствие чего происходит накопление потребляемого с пищей фенилаланина; мозг является основным повреждаемым органом, возможно, из-за нарушения миелинизации.
Фенилкетонурия (ФКУ) вызывает клинический синдром умственной отсталости с когнитивными и поведенческими нарушениями; при отсутствии лечения развивается тяжелая умственная отсталость.
В США и многих развитых странах, всех новорожденных обследуют на фенилкетонурию в течение 24-48 часов после рождения, проводя один из нескольких анализов крови; отклоняющиеся от нормы результаты подтверждают непосредственным измерением уровня фенилаланина.
Лечение заключается в пожизненном ограничении поступления фенилаланина с пищей; адекватное лечение, начатое в первые дни жизни, предотвращает возникновение многих проявлений этого заболевания.
Несмотря на то, что при наличии лечения прогноз благоприятный, требуется частый мониторинг уровней фенилаланина в плазме; рекомендуемые значения располагаются в пределах 2–6 мг/дл (120–360 мкмоль/л) для всех детей.
Дополнительная информация
Ниже следуют англоязычные ресурсы, которые могут быть информативными. Обратите внимание, что The manual не несет ответственности за содержание этих ресурсов.
American College of Medical Genetics and Genomics Therapeutic Committee: Diagnosis and management guidelines for phenylalanine hydroxylase deficiency (2013)
Online Mendelian Inheritance in Man® (OMIM®) database: полная информация о генах и их молекулярной и хромосомной локализации
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Фенилкетонурия
Фенилкетонурия – наследственное нарушение аминокислотного обмена, обусловленное недостаточностью печеночных ферментов, участвующих в метаболизме фенилаланина до тирозина. Ранними признаками фенилкетонурии служат рвота, вялость или гиперактивность, запах плесени от мочи и кожи, задержка психомоторного развития; типичные поздние признаки включают олигофрению, отставание в физическом развитии, судороги, экзематозные изменения кожи и др. Скрининг новорожденных на фенилкетонурию проводится еще в родильном доме; последующая диагностика включает молекулярно-генетическое тестирование, определение концентрации фенилаланина в крови, биохимический анализ мочи, ЭЭГ, МРТ головного мозга. Лечение фенилкетонурии заключается в соблюдении специальной диеты.
Общие сведения
Фенилкетонурия (болезнь Феллинга, фенилпировиноградная олигофрения) – врожденная, генетически обусловленная патология, характеризующаяся нарушением гидроксилирования фенилаланина, накоплением аминокислоты и ее метаболитов в физиологических жидкостях и тканях с последующим тяжелым поражением ЦНС. Фенилкетонурия впервые описана А. Феллингом в 1934 г.; встречается с частотой 1 случай на 10 000 новорожденных. В неонатальном периоде фенилкетонурия не имеет клинических проявлений, однако поступление фенилаланина с пищей вызывает манифестацию заболевания уже в первом полугодии жизни, а в дальнейшем приводит к тяжелым нарушениям развития ребенка. Именно поэтому пресимптоматическое выявление фенилкетонурии у новорожденных является важнейшей задачей неонатологии, педиатрии и генетики.
Причины фенилкетонурии
Фенилкетонурия является заболеванием с аутосомно-рецессивным характером наследования. Это означает, что для развития клинических признаков фенилкетонурии ребенок должен унаследовать по одной дефектной копии гена от обоих родителей, являющихся гетерозиготными носителями мутантного гена.
Чаще всего к развитию фенилкетонурии приводит мутация гена, кодирующего фермент фенилаланин-4-гидроксилазу и расположенного на длинном плече 12 хромосомы (локус12q22-q24.1). Это, так называемая, классическая фенилкетонурия I типа, составляющая 98% всех случаев заболевания. Гиперфенилаланинемия может достигать 30 мг% и выше. При отсутствии лечения данный вариант фенилкетонурии сопровождается глубокой умственной отсталостью.
Кроме классической формы, различают атипичные варианты фенилкетонурии, протекающие с той же клинической симптоматикой, но не поддающиеся коррекции диетотерапией. К ним относятся фенилкетонурия II типа (недостаточность дегидроптеринредуктазы), фенилкетонурия III типа (дефицит тетрагидробиоптерина) и другие, более редкие варианты.
Вероятность рождения ребенка, больного фенилкетонурией, повышается при заключении близкородственных браков.
Патогенез фенилкетонурии
В основе классической формы фенилкетонурии лежит недостаточность фермента фенилаланин-4-гидроксилазы, участвующего в конверсии фенилаланина в тирозин в митохондриях гепатоцитов. В свою очередь, производный тирозина – тирамин является исходным продуктом для синтеза катехоламинов (адреналина и норадреналина), а дийодтирозин – для образования тироксина. Кроме этого, результатом метаболизма фенилаланина служит образование пигмента меланина.
Наследственная недостаточность фермента фенилалаиин-4-гидроксилазы при фенилкетонурии приводит к нарушению окисления фенилаланина, поступающего с пищей, в результате чего его концентрация в крови (фенилаланинемия) и спинномозговой жидкости значительно возрастает, а уровень тирозина соответственно падает. Избыточное содержание фенилаланина устраняется путем повышенной экскреции с мочой его метаболитов - фенилпировиноградной, фенилмолочной и фенилуксусной кислот.
Нарушение обмена аминокислот сопровождается нарушением миелинизации нервных волокон, снижением образования нейромедиаторов (дофамина, серотонина и др.), запускающими патогенетические механизмы задержки умственного развития и прогредиентное слабоумие.
Симптомы фенилкетонурии
Новорожденные с фенилкетонурией не имеют клинических признаков заболевания. Обычно манифестация фенилкетонурии у детей происходит в возрасте 2-6 месяцев. С началом кормления в организм ребенка начинает поступать белок грудного молока либо его заменителей, что приводит к развитию первых, неспецифических симптомов – вялости, иногда – беспокойства и гипервозбудимости, срыгивания, мышечной дистонии, судорожного синдрома. Одним из ранних патогномоничных признаков фенилкетонурии служит упорная рвота, которая нередко ошибочно расценивается как проявление пилоростеноза.
Ко второму полугодию становится заметным отставание ребенка в психомоторном развитии. Ребенок становится менее активным, безучастным, перестает узнавать близких, не пытается садиться и вставать на ножки. Аномальный состав мочи и пота обусловливают характерный «мышиный» запах (запах плесени), исходящий от тела. Часто наблюдается шелушение кожи, дерматиты, экзема, склеродермия.
У детей с фенилкетонурией, не получающих лечения, выявляется микроцефалия, прогнатия, позднее (после 1,5 лет) прорезывание зубов, гипоплазия эмали. Отмечается задержка речевого развития, а к 3-4 годам выявляется глубокая олигофрения (идиотия) и практически полное отсутствие речи.
Дети с фенилкетонурией имеют диспластическое телосложение, нередко - врожденные пороки сердца, вегетативные дисфункции (потливость, акроцианоз, артериальную гипотонию), страдают запорами. К фенотипическим особенностям детей, страдающих фенилкетонурией, следует отнести светлую кожу, глаза и волосы. Для ребенка с фенилкетонурией характерны специфическая поза «портного» (согнутые в суставах верхние и нижние конечности), тремор рук, шаткая, семенящая походка, гиперкинезы.
Клинические проявления фенилкетонурии II типа характеризуются тяжелой степенью умственной отсталости, повышенной возбудимостью, судорогами, спастическим тетрапарезом, сухожильной гиперрефлексией. Прогрессирование заболевание может приводить к гибели ребенка в возрасте 2-З лет.
При фенилкетонури III типа развивается триада признаков: микроцефалия, олигофрения, спастический тетрапарез.
В настоящее время диагностика фенилкетонурии (а также галактоземии, врожденного гипотиреоза, адрено-генитального синдрома и муковисцидоза) входит в программу неонатального скрининга, осуществляемого всем новорожденным.
Скрининг-тест проводится на 3-5 день жизни доношенного и 7 день жизни недоношенного ребенка путем забора образца капиллярной крови на специальный бумажный бланк. При обнаружении гиперфенилаланемии более 2,2 мг% ребенка направляют к детскому генетику для повторного обследования.
Для подтверждения диагноза фенилкетонурии проверяется концентрация фенилаланина и тирозина в крови, определяют активность печеночных ферментов (фенилаланингидроксилазы), выполняется биохимическое исследование мочи (определение кетоновых кислот), метаболитов катехоламинов в моче и др. Дополнительно проводится ЭЭГ и МРТ головного мозга, осмотр ребенка детским неврологом.
Генетический дефект при фенилкетонурии может быть обнаружен еще на этапе беременности в ходе инвазивной пренатальной диагностики плода (хорионбиопсии, амниоцентеза, кордоцентеза).
Дифференциальный диагноз фенилкетонурии проводят с внутричерепной родовой травмой новорожденных, внутриутробными инфекциями, другими нарушениями обмена аминокислот.
Лечение фенилкетонурии
Основополагающим фактором в лечении фенилкетонурии является соблюдение диеты, ограничивающей поступление белка в организм. Лечение рекомендуется начинать при концентрации фенилаланина >6 мг%. Для грудных детей разработаны специальные смеси - Афенилак, Лофенилак; для детей старше 1 года – Тетрафен, Фенил-фри; старше 8 лет - Максамум-ХР и др. Основу диеты составляют низкобелковые продукты - фрукты, овощи, соки, белковые гидролизаты и аминокислотные смеси. Расширение диеты возможно после 18 лет в связи с возрастанием толерантности к фенилаланину. В соответствии с российским законодательством обеспечение лиц, страдающих фенилкетонурией, лечебным питанием, должна осуществляться бесплатно.
Больным назначается прием минеральных соединений, витаминов группы В и др.; по показаниям - ноотропные средства, антиконвульсанты. В комплексной терапии фенилкетонурии широко используется общий массаж, ЛФК, иглорефлексотерапия.
Дети, страдающие фенилкетонурией, находятся под наблюдением участкового педиатра и психоневролога; нередко нуждаются в помощи логопеда и дефектолога. Необходим тщательный мониторинг нервно-психического статуса детей, контроль уровня фенилаланина в крови и показателей электроэнцефалограммы.
Атипичные формы фенилкетонурии, не поддающиеся лечению диетой, требуют назначения гепатопротекторов, противосудорожных средств, заместительной терапии леводопой, 5-гидрокситриптофаном.
Прогноз и профилактика фенилкетонурии
Проведения массового скрининга на фенилкетонурию в неонатальном периоде позволяет организовать раннюю диетотерапию и предотвратить тяжелые церебральные повреждения, нарушения функции печени. При раннем назначении элиминационной диеты при классической фенилкетонурии прогноз развития детей хороший. При поздно начатом лечении прогноз в отношении умственного развития неблагоприятный.
Профилактика осложнений фенилкетонурии заключается в проведении массового скрининга новорожденных, раннего назначения и длительного соблюдения диетического питания.
С целью оценки риска рождения ребенка с фенилкетонурией предварительное генетическое консультирование должны пройти супружеские пары, уже имеющие больного ребенка, состоящие в кровнородственном браке, имеющие родственников с данным заболеванием. Женщины с фенилкетонурией, планирующие беременность, должны соблюдать строгую диету до зачатия и во время беременности для исключения повышения уровня фенилаланина и его метаболитов и нарушения развития генетически здорового плода. Риск рождения ребенка с фенилкетонурией у родителей-носителей дефектного гена, составляет 1:4.
Фенилкетонурия

Фенилкетонурия (либо ФКУ) — это наследственное, редко встречающееся заболевание, которое проявляется в нарушении обмена аминокислот. Если точнее, то организм людей с такой болезнью не может расщеплять фенилаланин, поступающий вместе с белковой пищей. Из-за такого дисбаланса в теле накапливаются опасные соединения, способные отравлять нервную систему, в том числе и ткани головного мозга. Эти отравления могут быть настолько сильными, что у ребенка развивается умственная отсталость, включая идиотию.
Несмотря на серьезную опасность болезни, сейчас ее вполне можно нейтрализовать — то есть дети, которые рождаются с такой проблемой, не обречены.
Статистика
Количество детей с таким заболеванием зависит от страны, местности проживания. Так, в России фиксируют рождение одного малыша, страдающего фенилкетонурией, на 10 000 человек. В Великобритании этот показатель в два раза выше, а у африканских детей подобная проблема почти не встречается. Девочки страдают этим недугом чаще — почти в два раза по сравнению с мальчиками.
Симптомы
У детей с ФКУ при рождении нет характерных симптомов, которые позволят сразу понять, что с малышом что-то не так. Ребенок с такой проблемой выглядит абсолютно здоровым. И если такой малыш употребляет в пищу белковую еду с большим количеством фенилаланина, начинаются первые симптомы. По этой причине диагностика проводится массово, всем детям сразу после рождения (см. ниже).
Если по какой-то причине диагностика не была проведена, и ребенок с болезнью получает белок, со временем у него начнутся тревожные симптомы. Первыми будут слабость, беспокойство, отсутствие у малыша улыбки, ярких реакций на окружающий мир. Дальше идут симптомы медленного развития: например, когда приходит время, ребенок не пытается сесть, перестает узнавать маму и т. д.

По мере развития болезни могут проявляться такие симптомы фенилкетонурии:
- Изменение цвета волос и глаз к более светлым. Это связано с тем, что в организме недостаточно меланина.
- Прибавление веса — малыш начинает быстро поправляться.
- Высыпания, экзема, сухость и шелушение кожи.
- Частая рвота.
- Неприятный («мышиный») запах мочи
К двум-трем годам основные диагностические признаки фенилкетонурии усиливаются и выглядят уже так:
- Спазмы и судороги, тремор пальцев рук.
- Постоянно зажатая поза. Ребенок не может расслабиться из-за сильного напряжения в мышцах.
- Неадекватные действия. Так, малыш может резко засмеяться, закричать — то есть просто ведет себя неадекватно ситуации.
- Деформация ушей, уменьшение черепа в отношении размеров тела.
- Выступающая нижняя челюсть.
- Недержание.
Причины
Поскольку речь идет о генетическом заболевании, причины фенилкетонурии сводятся исключительно к мутации гена 12-й хромосомы. Именно этот ген отвечает за определенный фермент, помогающий перерабатывать аминокислоту фенилаланин. Из-за мутации количество фермента становится меньше, поэтому сама аминокислота накапливается в тканях, отравляя их. Все это влияет и на нейромедиаторы, работу нервных проводников.
Заболевание возникает тогда, когда патологические гены матери и отца совпадают, оно не зависит от пола ребенка.
Названная причина фенилкетонурии определяет развитие болезни в 98% случаев, однако есть еще 2%, когда проблема заключается в других генетических дефектах. Если в первом случае (почти всегда) назначается лечение диетой — и оно очень эффективно, то во второй ситуации оно будет бесполезным.
Диагностика
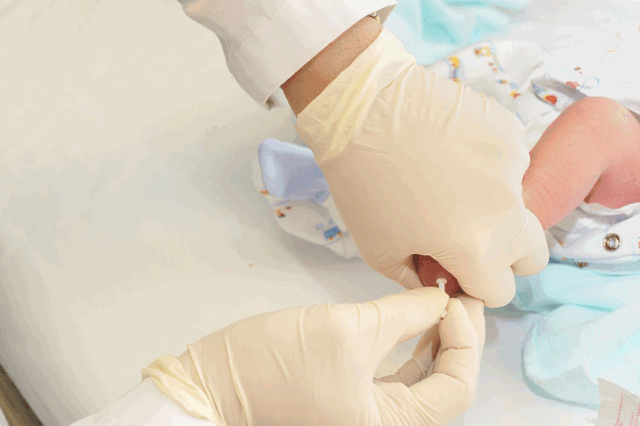
Определить риски появления этого заболевания можно еще до зачатия ребенка — если оба родителя пройдут генетическую экспертизу. Но после рождения малыша его обязательно обследуют на наличие фенилкетонурии. В России это обязательная процедура, которая входит в неонатальный скрининг. Анализ обязательно нужно взять в течение первых трех недель жизни, так что, если малыш появился на свет не в роддоме, родителям обязательно нужно об этом позаботиться. Результаты анализа можно получить через сутки.
Если в анализе обнаружен ген с изменениями, то малыша и родителей обследуют в медико-генетическом центре. Есть ситуации, когда диагноз после тщательного изучения всех данных опровергается. Но чтобы подтвердить его или убрать, необходимо провести дополнительную диагностику фенилкетонурии:
- изучить сыворотку и сухое пятно крови,
- провести потовый тест,
- сделать копрограмму,
- провести ДНК-диагностику.
Затягивать с рекомендациями врачей нельзя ни в коем случае. Занимаются лечением педиатры и эндокринологи.
Лечение
Основное лечение фенилкетонурии сводится к тому, чтобы убрать из рациона ребенка животные белки. Если это будет сделано в первые недели жизни, малыш будет развиваться нормально — и умственная отсталость ему не грозит. Чем позже будет пересмотрен рацион, тем выше риски, что процесс будет запущен, а потому его можно будет только затормозить.
Строгая диета соблюдается больными в среднем до 18 лет — после этого возраста белки допускаются, но их количество необходимо контролировать. Если в последующем девочка с таким диагнозом вырастет и захочет родить, до зачатия, а также во время беременности и лактации ей нужно будет вернуться к строгой диете без белка. Чтобы восполнить питательные вещества, которые ребенок не может получить из пищи, ему нужно заменить белковую еду специальными продуктами с пептидами и свободными аминокислотами. Для этого есть целенаправленно разработанные решения, с которыми родителей ознакомят врачи. Также при лечении фенилкетонурии можно кормить малышей грудным молоком, но маме придется тоже следить за питанием и сидеть на специальной диете.
Диета ребенка зависит и от возраста. Если сначала важно исключить животный белок, то в дошкольном и школьном возрасте из рациона убирается любой белок. Строго необходимо соблюдать и возрастные нормы фенилаланина.
Поскольку основные диагностические признаки фенилкетонурии нельзя определить визуально, а только по анализам крови, детям с таким диагнозом нужно регулярно сдавать кровь и контролировать количество фенилаланина. Нормой в данном случае являются показатели 180-240 мкмоль/л либо 3-4 мг%. Регулярность анализов также зависит от возраста. До трех месяцев ребенка проверяют каждую неделю, затем постепенно количество визитов к врачу снижается.
Если у вашего ребенка выявлена классическая фенилкетонурия, и вы хотите получить консультацию опытного эндокринолога, а также сдать очередные анализы, клиника АО «Медицина» в Москве — место, где вам обязательно помогут. Большой опыт лечения детей с самыми разными недугами позволяет профессионалам подбирать оптимальные программы восстановления и поддержания для каждого малыша.
![Профилактика фенилкетонурии]()
Профилактика
Поскольку речь идет о генетическом заболевании, специфической профилактики фенилкетонурии просто не существует. Родители могут сдать специальный анализ до зачатия и посмотреть, каковы риски, что у них родится ребенок с таким недугом. Но независимо от того, был ли пройден генетический тест, всех новорожденных малышей в роддоме все равно проверяют.
Единственная профилактическая мера касается тех родителей, которые по каким-то причинам приняли решение рожать в домашних условиях или в странах, где проверка на фенилкетонурию не проводится обязательно. Им необходимо в течение первых трех недель жизни малыша сдать анализы крови и проверить новорожденного на наличие искаженного 12-го гена.
Вопросы и ответы
Как влияет фенилкетонурия на умственное развитие ребенка?
Если вовремя сесть на диету (с первых недель жизни малыша), то заболевание никак не повлияет на развитие. При грамотном лечении ребенок вырастет полноценным и сможет учиться, социализироваться — то есть не почувствует на себе никаких ограничений кроме тех, что связаны с диетой.
Что будет, если начать диету значительно позже?
К сожалению, задержка в развитии в этом случае не компенсируется. В ряде случаев ее можно задержать — и ребенок будет жить достаточно комфортно. Но очень часто это лишь замедление патологических процессов, так что своевременное лечение просто необходимо.
Можно ли избежать фенилкетонурию?
Поскольку заболевание обусловлено генетически, избежать его, когда встречаются два «поломанных» гена, невозможно. Родители могут только предотвратить проблемы, вызванные болезнью. Но сделать так, чтобы малыш точно не заболел, на данном этапе развития медицины невозможно.
Читайте также:

