Лактация и галакторея. Регуляция секреции пролактина
Обновлено: 26.04.2024
Гиперпролактинемия – усиленная выработка гормона пролактина в организме. Диагноз ставят на основании клинического анализа крови. Повышение уровня пролактина говорит о нарушении в работе отделов головного мозга, вызванном стрессами, физическими перегрузками, различными физиологическими факторами. Чаще всего патологию диагностируют у молодых женщин, реже – у мужчин в возрасте до 40 лет.
Особенности секреции и функции пролактина
Пролактин – это гормон, поддерживающий репродуктивную функцию, отвечающий за становление лактации. Вещество участвует в процессах формирования железистой ткани груди. У мужчин пролактин отвечает за синтез тестостерона и поддерживает активность сперматозоидов.
Роль гормона в работе других органов:
- надпочечники – стимуляция синтеза активных веществ, обеспечивающих устойчивость организма к повышенным нагрузкам во время кормления грудью (альдостерона, эпинефрина, андрогенов);
- поджелудочная железа – производство инсулина;
- щитовидная железа – снижение секреции тиреокальцитонита для повышения содержания минералов в грудном молоке;
- иммунная система – подавление процессов отторжения плода.
Выработка гормона происходит в гипофизе. Контролирует процесс гипоталамус. Изменение уровня пролактина у женщин связано с менструальным циклом, поэтому гиперпролактинемия у мужчин диагностируется значительно реже.
Секреция гормона происходит импульсно. В поздней фолликулярной фазе цикла производится не менее 14 импульсов, в поздней лютеиновой – не более 9. Уровень пролактина также изменяется в течение суток. После засыпания концентрация гормона нарастает и достигает максимума через 1,5-2 часа, после чего начинается снижение.
Во время менструального цикла количество пролактина в плазме крови может составлять от 5 до 27 нг/мл.
На выработку гормона влияют многие факторы, поэтому забор материала для анализа проводят в строго определенное время, не после процедур.
Причины патологии
Существует множество провоцирующих факторов.
Можно выделить основные причины гиперпролактинемии:
- опухоли гипоталамуса;
- инфекционные поражения головного мозга;
- туберкулез, другие патологии, сопровождающиеся гранулематозными и инфильтративными изменениями;
- травмы головы, кровоизлияния;
- синдром пустого турецкого седла гипофиза;
- беременность и первая неделя послеродового периода (основная причина гиперпролактинемии у женщин);
- эмоциональный стресс;
- стимуляция сосков, в том числе во время кормления грудью;
- повреждения грудной клетки, например, ожоги, опоясывающий лишай;
- синдром Кушинга;
- заболевания щитовидной железы;
- нарушения в работе печени и почек;
- прием некоторых лекарств и т. д.
Причиной гиперпролактинемии у мужчин часто становится цирроз печени. Функциональные клетки железы заменяются соединительной тканью, в результате чего снижается скорость выведения пролактина из организма.
Виды гиперпролактинемии
В зависимости от причины различают несколько форм заболевания.
Физиологическая гиперпролактинемия
В ряде случаев такое состояние является нормой:
- Во время беременности. При вынашивании плода уровень пролактина повышается для подготовки женского тела к лактации. Секреция гормона усиливается уже с 5-7 недели беременности. Содержание пролактина приходит в норму после окончания лактации. Если женщина не кормит грудью, то гормональный фон стабилизируется в течение месяца;
- Во время лактации. Пролактин стимулирует и контролирует выработку молока. Когда ребенок сосет грудь, гипоталамус получает сигнал на синтез либеринов, которые, в свою очередь, заставляют гипофиз увеличить секрецию гормона. Гиперпролактинемия во время лактации также подавляет овуляцию и снижает риск новой беременности в период грудного вскармливания;
- Во время сна. Гиперпролактинемия наблюдается через 1-2 часа после засыпания;
- Во время стресса. У ряда пациентов с обморочным состоянием и гипотонией повышен пролактин;
- Во время полового акта. От количества пролактина в крови напрямую зависит вероятность получения оргазма;
- В период новорожденности. Гиперпролактинемия характерна для младенцев первой недели жизни.
Патологическая гиперпролактинемия
Причины патологии – нарушение функции гипоталамо-гипофизарной системы. Два отдела мозга, ответственные за синтез пролактина, теряют связь между собой. В результате секреция увеличивается многократно.
Анатомическая гиперпролактинемия
Болезнь чаще всего развивается на фоне роста опухоли гипофиза – пролактиномы. Гиперпролактинемию также вызывают гормонально не активные новообразования головного мозга, например, метастазы, сифилис, туберкулез и другие. Одна из причин анатомической патологии – травмы головы.
Функциональная гиперпролактинемия
- заболевания органов эндокринной системы: надпочечников, яичников, щитовидной железы;
- раз почки или легкого;
- хроническая почечная недостаточность, простатит;
- климакс.
Фармакологическая гиперпролактинемия
Уровень пролактина повышается от приема лекарств, угнетающих выработку дофамина - нейромедиатора, влияющего на функцию гипофиза. Таким действием, например, обладают некоторые нейролептики, оральные контрацептивы, противорвотные и успокоительные препараты, антигистамины, амфетамины.
Идиопатическая гиперпролактинемия
Состояние неясной этиологии. Обследование пациента показывает увеличение уровня пролактина, но установить причину невозможно. В случае идиопатической гиперпролактинемии врач последовательно исключает все возможные факторы, влияющие на работу гипофиза и гипоталамуса, проводит тщательные исследования по обнаружению опухолей в ранней стадии развития.
Симптомы гиперпролактинемии
Главным симптомом гиперпролактинемии у женщин является нарушение менструального цикла. Гормон активно влияет на функцию яичников, гипофиза и гипоталамуса. Почти у каждой третьей пациентки с гиперпролактинемией обнаруживают аденому гипофиза в разных стадиях развития. Одним из симптомов заболевания является снижение полового влечения.
Другие признаки гиперпролактинемии у женщин:
- чрезмерный рост волос по мужскому типу;
- угри, проблемы с кожей;
- быстрый набор веса;
- остеопороз;
- галакторея;
- фригидность, гиполипидемия.
У мужчин повышенный уровень пролактина вызывает патологии половых органов и функций, гинекомастию. Наблюдается угасание сексуального влечения, изменяется размер простаты.
Первые признаки гиперпролактинемии врач может заметить во время планового осмотра пациента. Наиболее характерный симптом – выделение молока из грудных желез при надавливании в отсутствие лактации (галакторея).
Диагностика гиперпролактинемии
Определить повышенное содержание пролактина позволяет анализ крови. Забор материала осуществляют в определенный день менструального цикла на голодный желудок. Исследование повторяют несколько раз, чтобы исключить физиологические факторы повышения уровня пролактина. Нормальное содержание гормона в крови у женщины – не более 27 нг/мл, а у мужчины – не более 20 нг/мл (цифры ориентировочные и могут отличаться в разных лабораториях).
Дополнительная диагностика направлена на установление причин и сопутствующих патологий:
- консультация гинеколога или андролога; и органов малого таза;
- анализ крови на гормоны щитовидной железы;
- анализ крови на сахар;
- консультация офтальмолога для оценки полей зрения;
- компьютерная или магнитно-резонансная томография головы с прицелом на турецкое седло.
Во время приема пациент должен сообщить врачу обо всех препаратах, которые он принимает длительно или постоянно. Информация поможет скорректировать план обследования и дальнейшего лечения.
Лечение гиперпролактинемии
Лечение гиперпролактинемии у женщин направлено на снижение уровня гормонов, восстановление регулярных менструаций. Необходимо подавить выработку пролактина до нормальных значений. Дозировку лекарственных средств рассчитывает врач в зависимости от выраженности симптомов гиперпролактинемии, пола и возраста пациента, его общего состояния. Параллельно назначают препараты для лечения сопутствующих патологий. Если гиперпролактинемия вызвана дисфункцией щитовидной железы, проводят тщательную диагностику и планируют соответствующую терапию.
Тактика лечения зависит от причины и проявления патологии:
- Лекарственная гиперпролактинемия устраняется при прекращении приема препаратов. Если пациент не может полностью обходиться без лекарств, необходимо подбирать альтернативу или попросить мнения врачебного консилиума для оценки рисков;
- Гиперпролактинемию с гипогонадизмом и остеопорозом успешно лечат назначением гормональных препаратов. В зависимости от результатов анализов пациенту назначают средства на основе тестостерона или эстрогенов;
- Лечение гиперпролактинемии опухолевого генеза нацелено на уменьшение размеров новообразования, на нормализацию гормонального баланса. Важно предотвратить рецидив аденомы. В ряде случаев больному подбирают дозировку агонистов дофамина. В случае отсутствия динамики на фоне приема лекарств, а также при увеличении аденомы показано хирургическое лечение. Опухоль удаляют. Применение лучевой терапии и химиотерапии не показано.
Препараты – агонисты дофамина:
- Каберголин. Преимущество препарата в пролонгированном действии – принимать лекарство можно 1 раз в несколько дней;
- Бромокриптин. Одно из первых лекарств для лечения гиперпролактинемии. Препараты бромокриптина имеют множество побочных эффектов, поэтому назначаются с большой осторожностью;
- Хинаголид. Назначается редко, имеет строгие показания.
В течение всего периода лечения контролируют уровень пролактина в крови. Пациент должен регулярно сдавать анализы крови и делать томографию головного мозга. При наличии макропролактином обязательно наблюдение у офтальмолога для снижения риска повреждения зрительного перекреста.
Возможны побочные эффекты терапии агонистами дофамина:
- нарушение пищеварения;
- головная боль, сонливость или бессонница;
- постуральная гипотензия.
Снижение дозировки лекарств или полная отмена возможны не ранее чем через 2 года после начала приема. Терапию прекращают после длительной стабилизации уровня пролактина на нормальном уровне, при уменьшении или полном отсутствии опухолей по данным МРТ.
Прогнозы по лечению благоприятные при условии ранней диагностики и правильного лечения. Женщинам после восстановления гормонального баланса рекомендуется не планировать беременность в течение первых 12 месяцев.
Гиперпролактинемия и беременность
Повышение уровня пролактина в крови подавляет овуляцию. Беременность возможна только при незначительной гиперпролактинемии. В остальных случаях зачать ребенка невозможно без предварительного лечения.
В отсутствие терапии развиваются более тяжелые последствия гиперпролактинемии:
- аменорея – полное отсутствие менструации;
- ановуляция – несозревание фолликула и бесплодие;
- недостаточность желтого тела яичников – риск невынашивания плода.
Все указанные осложнения приводят к бесплодию.
При этом гиперпролактинемия, которая возникает уже во время беременности, является нормой.
Диагностика и лечение гиперпролактинемии в Москве
Клиника персональной медицины MedEX приглашает пройти консультацию специалиста и все необходимые обследования в одном месте, что позволит оперативно и точно составить план лечения гиперпролактинемии. Позвоните, чтобы выбрать удобное время для записи.
Дисфункция грудных желез во время вскармливания

Возникновение дисфункции грудных желез, выраженное в проблемах лактации (секреторная и выводящая работа органа), связано с рядом патологических состояний. К ним относятся гипогалактия, галакторея и т.п. Причем перечисленные заболевания могут быть, как связаны с родовой деятельностью, так и полностью независимы от этого фактора. Например, развитие гипогалактии связано с дефицитом образования молока, а галактореи – повышенной выработкой секрета (встречается даже у мужчин). Поэтому первая патология может быть нивелирована техникой кормления и режимом питания, а вторая – исключительно хирургической операцией.
Лактация: физиологический аспект
Выработка молока состоит из 2-х этапов:
- лактогенез – подготовительная фаза, связанная с выработкой плацентарного лактогена, которая прекращается после родов;
- лактопоэз – поддержка работы грудных желез, связанная с выработкой гипофизом пролактина (основного гормона лактации) и осцитоцина (способствует выводу молока из грудной железы).
Регуляция секреции носит эндокринный характер и формируется в третьем триместре.
При лактации нормой считается ежедневное выделение до 1 литра молока. При отсутствии кормления или сцеживания выработка молока прекращается через 7-14 дней.
Причины заболеваний
Наиболее часто встречаются такие патологические состояния, связанные с функцией лактации, как галакторея и гипогалактия.
Галакторея
Может развиваться и у женщин, и у мужчин. Патология связана с нарушением нормальной секреции молока и молозива, выделяемого грудной железой. Причем истечение молока из груди (одной или обеих сразу) не является отдельным заболеванием, но лишь относится к важным симптомам, свидетельствующим о серьезном сбое эндокринной системы. При галакторее наблюдается увеличенное содержание пролактина.
Это связано со следующими факторами:
- новообразования (доброкачественные) в гипофизе;
- травматические и патологические состояния в гипотламусе;
- новообразования (негипофизарные), которые оказывают воздействие на выработку пролактина;
- опухолевые образования в головном мозге;
- печеночная недостаточность;
- почечная недостаточность;
- гормональный сбой в работе щитовидной железы;
- поликистоз яичников;
- нарушения в работе надпочечников;
- патологические состояния нервной системы;
- физические воздействия (регулярная пальпация, кожный зуд на фоне аллергического состояния, тесная одежда и прочие стимулирования грудной железы);
- продолжительное применение медикаментов (анальгетиков, стероидных гормонов, антидепрессантов, оральных контрацептивов, транквилизаторов и т.п);
- чрезмерное употребление в лечебных целях растений с выраженным лактогенным эффектом (анис, укроп и т.п.).
Следует понимать, что при галокторее в половине случаев не удается выявить настоящие причины заболевания. При таком состоянии патология считается идиопатической, когда опасность отсутствует, но пациенту следует постоянно находиться под врачебным наблюдением.
Гипогалактия
Дефицит молочной секреции после родов подразделяется на следующие патологические состояния:
- первичная (10% случаев);
- вторичная (90% случаев);
- ранняя (первая декада после родов);
- поздняя (по истечении первой послеродовой декады).
Причины первичной гипогалактии:
- сахарный диабет;
- аутоиммунный полигландулярный синдром;
- нарушения гипофиза;
- патологические состояния щитовидной железы;
- причины психогенного характера;
- дефицит пролактина;
- дефицит прогестерона и эстрогенов;
- нарушения в развитии молочных желез;
- родовые осложнения; (тяжелая форма);
- инфекционные патологии.
Причины вторичной гипогалактии:
- мастит;
- инфекционные заражения;
- нарушение режима питания матери и новорожденного;
- физическое переутомление;
- стрессовые состояния;
- медикаментозное влияние на лактацию;
- сниженный сосательный рефлекс новорожденного.
Симптоматика
Галакторея зачастую сопровождается единственным проявлением в виде нарушения молочной секреции. Непроизвольные выделения (или при давлении на грудную железу, соски) могут быть как чисто белого цвета, так и с выраженным зеленоватым или желтоватым оттенком. Присутствие в колере молока красной тональности соответствует другой патологии.
У большинства женщин (у 4-х из 5-ти) наблюдается аменорея (нарушение месячного цикла на 6 и более месяцев) или олигоменорея (менструальная функция выражена недостаточными и краткосрочными выделениями).
Кроме того, присутствуют следующие симптомы:
- пониженное либидо;
- сухость влагалища;
- приступы жара;
- увеличение размера сосков;
- болезненные ощущения в сосках.
Для мужчин симптоматика выражена в следующих показателях:
- пониженная эрекция (риск возникновения импотенции);
- гинекомастия.
Вне зависимости от пола:
- кожные поражения в виде угрей, прыщей и т.п.;
- пониженная сексуальная функция;
- головная боль;
- снижено периферическое зрение;
- нарушения волосяного покрова.
Гипогалактия проявляется в неполноценности молочной секреции. Обнаруживается патологическое состояние по характерному поведению и состоянию голодного новорожденного (мало спит, часто плачет, теряет вес) и путем пальпации грудной железы (плохо выделяется молоко, отсутствует огрубение сосков).
Статистика показывает, что у большинства кормящих матерей наблюдается ежемесячный гипогалактический криз, продолжительность которого составляет 2-3 дня. Данная ситуация объясняется цикличностью уменьшения и увеличения гормональной активности родившей женщины.
Диагностика
Галакторея выявляется путем:
- анамнеза;
- внешнего осмотра;
- пальпации;
- анализа органа и выделений на основе лабораторных и аппаратных исследований (определение структурных изменений, а также гормонов щитовидной железы и пролактина).
Аппаратные исследования включают в себя:
- КТ и МРТ головного мозга;
- рентген легких, груди (маммография) и турецкого седла;
- УЗИ брюшной полости, печени, почек, щитовидной железы и яичников.
Гипогалактия выявляется путем определения количества выделяемого грудной железой молока.
Существует 2 способа:
- путем взвешивания новорожденного (до и после кормления);
- определения суточного объема выделяемого молока путем суммирования порций сцеживания перед каждым кормлением.
Расчет необходимого количества молока для ребенка на первой неделе после родов производится по формуле Финкельштейна:
Объем молока (суточный) = Возраст новорожденного в днях х 70 / 80 (70 – при массе тела ребенка менее 3 200 гр., 80 – при весе более 3 200 гр.)
Например, вес ребенка при рождении 3 500 гр. Возраст – 7 дней. Число ежедневных кормлений – 8.
Суточный объем молока = 7 х 80 = 560 мл.
Разовый объем молока = 560 / 8 = 70 мл.
Расчет ежедневного потребления молока младенцем:
- на 1-м месяце жизни – 1/5 текущей массы тела;
- на 2-м месяце жизни – 1/6 текущего веса тела;
- на 3-5 месяцах жизни – 1/7 текущего веса тела;
- на 6-12 месяцах жизни – 1/8 текущей массы тела.
Градация дефицита молока предполагает 4 степени гиполактии (до 25%, до 50%, до 75% и свыше 75%).
Способы диагностирования гипогалактии:
- оценка уровня пролактина и эстрогена в крови (начальная стадия);
- цитологический анализ молока;
- УЗИ грудных желез (выявление структурных изменений);
- термография (выявление сосудистого рисунка).
Лечение и профилактика
Гипогалактия на начальной стадии развития может быть подвергнута консервативной терапии, которая способна осуществить стимуляцию лактации.
К группе актуальных медикаментов относятся в первую очередь лактин и дезаминоокситацин, которые эффективно повышают секрецию пролактина. К очевидному недостатку данной методологии относится привыкание организма, из-за которого со временем приходится увеличивать дозировку, что может привести к серьезному сбою гормонального фона.
При недостаточном количестве молока обычно рекомендуются такие гомеопатические препараты, как млекоин, апилак и т.п. Из-за нейтрального воздействия на гормональный фон их использование возможно в течение всего периода лактации.
При вторичной гипогалактии необходимо внести соответствующие изменения в режим и технику кормления. Рацион питания женщины должен предусматривать молочную продукцию с высоким уровнем калорийности и большое количество жидкости.
При развитии патологии 3-й и 4-й стадий следует проходить следующие физиотерапевтические процедуры:
- ультрафиолетовое облучение;
- электрофорез;
- массаж.
Лечение галактореи
Нарушение секреции грудных желез является симптомом серьезного заболевания.
В зависимости от конкретной этиологии могут применяться следующие варианты лечения:
- тугое перетягивание бинтом грудных желез для снижения стимуляции сосков (легкая степень заболевания с неясной этиологией);
- медикаментозная терапия – коррекция секреции пролактина (например, бромкриптин снижает уровень гормона и восстанавливает месячный цикл);
- выявление медикаментов, оказавших влияние на несанкционированную молочную секрецию, и корректировка их дозировки и режима употребления;
- хирургическая операция (иссечение опухолевых новообразований);
- лучевая терапия (злокачественные образования).
Профилактика гипогалактии в первую очередь подразумевает исключение анестезии и стимуляции родов в качестве мер вспоможения.
Кроме того, важно учесть следующие рекомендации:
- самостоятельный массаж сосков;
- качественное питание матери;
- позитивный психологический фон, исключающий стрессы;
- соблюдение режима питания матери и ребенка;
- первое кормление должно произойти не позднее 6 часов после родов.
Важно применять меры предупреждения гипогалактии с первого триместра и продолжать их осуществлять в течение всего периода лактации, что станет гарантией полноценного кормления.
Профилактика галактореи не имеет специфичных правил.
Поэтому для предупреждения заболевания следует придерживаться общих рекомендаций:
Лактация и галакторея. Регуляция секреции пролактина
Лактация и галакторея. Регуляция секреции пролактина
Лактация — один из важнейших физиологических процессов, необходимый для выживания детенышей млекопитающих в отсутствии человеческого вмешательства. Молоко матери содержит видоспецифичные питательные вещества, необходимые для нормального роста и развития новорожденных. Для того чтобы кормление грудью стало возможным, соответствующие железы млекопитающего должны развиться и преобразоваться в производящие молоко органы с помощью регулируемого гормонами процесса, называемого лак-тогенезом. В последние два десятилетия стало широко известно об огромной пользе грудного вскармливания, поэтому все более важным становится понимание процесса лактогенеза.
Галакторея, в самом широком ее смысле, обозначает самопроизвольное выделение молока из сосков в любое время, кроме момента кормления грудью. Греческое слово «галакторея» буквально переводится как «поток молока». Физиологическая галакторея возникает у многих женщин как на позднем сроке беременности, так и в первые недели или месяцы после деторождения, когда грудное вскармливание не осуществляется или же после его прекращения.
Клинически термин «галакторея» используют для определения нарушенной или несвоевременной секреции материнского молока или молозива. Этот термин часто применяют, если секреция материнского молока не прекращается через 6 мес после прекращения грудного вскармливания или после родов, если кормление грудью не осуществляется, или же в случае секреции молока у женщины, никогда не имевшей беременности. Однако важно помнить, что до настоящего времени не существует общепринятого определения нефизиологической (патологической)галактореи.
Нефизиологическая галакторея может варьировать от случайной находки при осмотре до существенной социальной проблемы для пациентки. Выделение молока может быть односторонним или двусторонним, самопроизвольным или только при стимуляции молочных желез. Необходимо отличать галакторею от других выделений из молочных желез. Галакторея может быть идиопатической или иметь серьезные причины, в том числе ятрогенные.
В этой и последующих статьях мы начнем с обзора нормальной физиологии молочных желез и лактации. За освещением различных причин галактореи следует обсуждение диагностики, лечения и долгосрочного прогноза для женщин с данной проблемой.

Для понимания процесса лактации и галактореи необходим полный объем знаний о пролактине. Пролактин отвечает за первичный контроль эндокринной системой секреции молочных желез, несмотря на то что множество других гормонов влияет на секрецию молочными железами молока.
Период полураспада пролактина короткий (20 мин), он существует в гетерогенных формах, включая «большой» пролактин, димерную гликозилированную форму пролактина, так называемый «очень большой пролактин». Секреция пролактина происходит в циркадном ритме, наиболее высокие средние концентрации пролактина соответствуют периоду сна, особенно фазе быстрого сна.
Рецепторы пролактина относятся к семейству цитокиновых. Пролактиновый рецептор — однокомпонентный (ковалентный) трансмембранный полипептид, который обнаружен не только в молочной железе, но и во многих других тканях, в том числе в печени, надпочечниках, легких, яичках, яичниках. Действие пролактина во многих из этих тканей остается неизученным.

Контроль секреции пролактина передней долей гипофиза осуществляется гипоталамусом и носит преимущественно ингибиторный характер. В то же время гипоталамус синтезирует как пролактии-ингибирующие факторы, так и пролактин-рилизинг-гормон, который и модулирует секрецию пролактина.
Пролактин-ингибирующие факторы синтезируются гипоталамусом и воздействуют на гипоталамо-гипофизарную портальную систему. Наиболее важную роль в составе пролактин-ингибирующих факторов играет дофамин, хотя и другие химические соединения проявляют ингибиторную активность. Прерывание тубероинфундибулярного пути (цереброспинальной системы), как и блокада дофаминовых рецепторов с помощью «генного нокаута», приводит к повышению содержания пролактина. К пролактин-ингибирующим факторам также относятся гонадотропин-ассоциированный пептид и ГАМК.
Секреция пролактина регулируется отрицательной обратной связью, где пролактин, воздействуя на пролактиновые рецепторы в срединном возвышении, стимулирует секрецию дофамина. Дофамин, действуя через аденилатциклазный путь метаболизма, уменьшает секрецию пролактина лактотрофами гипофиза. Основным дофаминовым рецептором в аденогипофизе является D2 (DRD2 — от англ. dopamine receptor D2). Связывание дофамина с этим рецептором уменьшает клеточную активность аденилатциклазы и содержание цАМФ.
Несмотря на то что основной механизм контроля пролактина носит ингибирующий характер, гипоталамус также синтезирует пролактин-рилизинг-гормон, который стимулирует секрецию пролактина лактотрофами. Первичный физиологический пролактин-рилизинг-гормон — вазоактивный интестинальный пептид. В то же время существует еще два клинически связанных пролактин-рилизинг-гормона. Считают, что способность ТРГ действовать как пролактин-рилизинг-гормон, — основа связи между гипотиреозом и гиперпролактинемией, такое состояние преодолевают при помощи заместительной терапии тиреоидными гормонами.
Другим пролактин-рилизинг-гормоном служит серотонин; использование любого препарата из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) обычно связано с гиперпролактинемией.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лактация и галакторея. Регуляция секреции пролактина
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» Минздрава Московской области, Москва, Россия
МГУ им. М.В. Ломоносова, Москва;
ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Взаимодействие пролактина и кисспептина в условиях нормо- и гиперпролактинемии
Журнал: Российский вестник акушера-гинеколога. 2020;20(2): 35‑40
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» Минздрава Московской области, Москва, Россия
Гиперпролактинемия является распространенным эндокринным синдромом у людей репродуктивного возраста и встречается у 15—20% женщин с нарушениями менструального цикла и бесплодием. Недавние исследования показали, что пролактин влияет на репродуктивную систему не напрямую, а опосредованно, через сеть гипоталамических KISS-нейронов, вырабатывающих кисспептин — мощный активатор нейронов, продуцирующих гонадотропин-рилизинг гормон (ГнРГ). Известно, что пролактин непосредственно ингибирует секрецию кисспетина и таким образом приводит к прекращению пульсирующей секреции ГнРГ и, следовательно, к снижению уровня лютеинизирующего гормона и ановуляции. В свою очередь, кисспептин воздействует на дофаминергические нейроны и снижает их активность, таким образом обеспечивая повышение уровня пролактина. Оба эти механизма регуляции являются эстрогензависимыми. В исследованиях было показано, что введение кисспептина пациенткам с патологической гиперпролактинемией приводит к восстановлению пульсирующей секреции ГнРГ, что обеспечивает овуляцию. В обзоре проанализированы последние данные о взаимодействии кисспептина и пролактина, сделан акцент на взаимодействии между ними в экспериментальных моделях животных и у человека. Область взаимодействия этих биологически активных соединений представляется обширной и требующей дальнейших исследований, в том числе для полного понимания патогенеза репродуктивной дисфункции при гиперпролактинемии.
ГБУЗ МО «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского» Минздрава Московской области, Москва, Россия
МГУ им. М.В. Ломоносова, Москва;
ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Пролактин
История пролактина начинается в 30-х годах прошлого века, когда этот полипептидный гормон был обнаружен Оскаром Ридли у млекопитающих. Спустя примерно 40 лет гормон был выделен и у человека [1]. Пролактин синтезируется и выделяется преимущественно лактотрофами передней доли гипофиза. Классическая роль гормона у млекопитающих — лактация, но в настоящее время насчитывается более 300 функций этого гормона как у женщин, так и у мужчин [2—4]. Помимо лактации он также участвует в формировании полового и родительского поведения, в процессах нейрогенеза, сна, обучения, памяти [5—9]. Рецепторы к нему были найдены во многих тканях: костях, жировой ткани, коже, тимусе, селезенке, матке и яичниках [10—14]. Не так давно рецепторы пролактина были обнаружены в различных областях мозга, таких как кора, обонятельная луковица, гипоталамус, гиппокамп и миндалина [15—19]. Результаты изучения механизмов влияния пролактина на нейропротекцию могут быть использованы для лечения нейродегенеративных заболеваний [20].
У человека пролактин кодируется геном, расположенным на 6-й хромосоме. Рецептор гормона относится к классу цитокиновых, и связывание с ним пролактина приводит к активации экспрессии генов в ядре клетки. У здоровых женщин увеличение секреции пролактина происходит во время стимуляции сосков молочных желез, при стрессе, половом акте, физических нагрузках, а также во время сна. ГнРГ, эстрогены, серотонин, окситоцин, вазопрессин, эндогенные опиоиды и некоторые другие вещества стимулируют секрецию гормона, а дофамин, вырабатываемый несколькими популяциями нейронов гипоталамуса, ингибирует [21]. Дофамин через гипофизарную портальную систему активирует D-дофаминовые рецепторы лактотрофов, что приводит к снижению экспрессии гена пролактина и, соответственно, снижению его секреции [22]. При этом пролактин способен осуществлять гипоталамический контроль своей собственной регуляции через прямое воздействие на клетки некоторых дофаминсекретирующих популяций нейронов: было показано, что нейроны одной из этих популяций имеют рецепторы к пролактину. Синтез и высвобождение дофамина увеличиваются в ответ на увеличение уровня пролактина в крови (одномоментное или длительное), тогда как гипопролактинемия приводит к подавлению секреции дофамина; таким образом, замыкается гомеостатическая регуляторная система [23, 24].
Кисспептин
Кисспептин был открыт в 1996 г. как супрессор метастазирования меланомы, в связи с чем поначалу получил название «метастатин». мРНК новой субстанции была выделена из тканей неметастазирующей меланомы, в то время как в тканях метастазирующей опухоли ее выявлено не было. Последующие эксперименты показали, что этот пептид подавляет метастазирование рака молочной железы, а также была выявлена обратная связь между экспрессией гена метастатина и метастазированием и/или прогрессированием меланомы, феохромоцитомы, плоскоклеточного рака пищевода, рака мочевого пузыря, молочной железы, желудка и поджелудочной железы [25]. В дальнейшем была открыта важнейшая роль этого пептида в половом созревании и репродукции, что привело к его переименованию. Свое романтичное название пептид и его ген получили в честь знаменитых шоколадных конфет под названием Kiss (поцелуй), фабрика по производству которых «The Hershey company» находилась в том же городе Херши, где и лаборатория.
Кисспептин кодируется геном Kiss, расположенным на 1-й хромосоме. Этот ген кодирует 145-аминокислотный пропептид (кисспептин-1), который затем расщепляется на четыре части: 54-аминокислотный кисспептин-54 и три более коротких — кисспептин-14, кисспептин-13 и кисспептин-10, содержащие соответствующее количество аминокислот; все эти пептиды проявляют примерно одинаковое сродство к общему рецептору KISS1R. Этот рецептор известен также как GRP54 (галанинподобный G-белоксвязанный рецептор-54), и до открытия кисспептина считался орфанным. Несмотря на то что все перечисленные пептиды биологически активны, наиболее изучена роль кисспептина-54, который и является основной активной формой кисспептина у человека.
Расположение кисспептиновых нейронов в гипоталамусе у человека ограничено преоптической зоной и инфундибулярными ядрами [26—28]. Связывание кисспептина с рецептором KISS1R активирует систему G-белков и вторичных посредников фосфолипазы С, что приводит к дальнейшему воздействию на клетку. В настоящее время кисспептин больше известен как непосредственный стимулятор ГнРГ и важнейший регулятор репродуктивной системы человека [29].
Так как напрямую в крови измерить содержание ГнРГ технически сложно, стимулирующее влияние кисспептина на ГнРГ оценивают по изменению уровня лютеинизирующего гормона (ЛГ). В исследовании с участием здоровых мужчин было продемонстрировано значительное дозозависимое увеличение уровня ЛГ при введении им кисспептина-10 (0,3 мкг/кг внутривенно болюсно и 4 мкг/кг/ч в течение 11 ч), а также — в меньшей степени — прирост уровней фолликулостимулирующего гормона (ФСГ) и тестостерона [30].
В инфундибулярных ядрах гипоталамуса расположены также KNDy-нейроны, которые помимо кисспептина коэкспрессируют нейрокинин В и динорфин. Аутосинаптически они регулируют секрецию кисспептина. Так, нейрокинин В является стимулятором, а динорфин — ингибитором секреции кисспептина. KNDy-нейроны играют важнейшую роль в обеспечении обратной связи — как отрицательной, так и положительной — между секрецией ГнРГ, ЛГ, ФСГ и половых стероидов у человека [31, 32]. Аксоны этих нейронов и нейронов ядер преоптической зоны идут к нейронам, вырабатывающим ГнРГ, обеспечивая его импульсную секрецию. Имеются данные о том, что KNDy-нейроны могут играть роль в обеспечении преовуляторной эстрогензависимой положительной обратной связи у человека [31, 33, 34].
Увеличение импульсной секреции кисспептина знаменует собой начало пубертатного периода у человека [35]; то же самое было показано в исследованиях на крысах и обезьянах [34, 36]. Инактивирующие мутации гена KISS1 или гена, кодирующего рецептор KISS1R, приводят к нарушению становления пубертатного периода и идиопатическому гипогонадотропному гипогонадизму как у животных, так и у человека. Активирующие мутации рецептора KISS1R, напротив, приводят к преждевременному половому развитию [37—39].
Секреция кисспептина, как и стимуляция выработки ГнРГ, зависит от концентрации периферических половых стероидов (эстрогены и прогестерон стимулируют активность Kiss-нейронов в обоих ядрах гипоталамуса) [34]. Наличие подобной регуляции свидетельствует о посреднической роли кисспептина в обеспечении механизма отрицательной обратной связи внутри гипоталамо-гипофизарно-яичниковой оси [32]. Согласно данным литературы, эстрадиол регулирует экспрессию гена рецептора кисспептина (KISS1R), а также синтез мРНК гена KISS1. Это также указывает, что кисспептин действует как регулятор в механизме обратной связи между периферическими половыми стероидами и ГнРГ-нейронами [40].
Гиперпролактинемия
Гиперпролактинемия — стойкое повышенное содержание пролактина в сыворотке крови, которое может быть физиологическим (например, у женщин во время беременности и лактации) или патологическим (например, при наличии пролактин-секретирующей аденомы гипофиза). Физиологическая гиперпролактинемия ведет к подавлению импульсов секреции ГнРГ, снижению продукции ЛГ, ФСГ и, как следствие, — к ановуляции. Вероятно, этот механизм эволюционно обоснован блокированием повторной беременности во время лактации для предупреждения дополнительных энергозатрат [21].
Секрецию пролактина регулируют три популяции гипоталамических дофаминергических нейронов: тубероинфундибулярные (TIDA), туберогипофизарные (THDA) и перивентрикулярные гипофизарные дофаминергические (PHDA). Дофамин, секретируемый этими нейронами, транспортируется в аденогипофиз посредством коротких портальных сосудов, и здесь способствует базальной регуляции секреции пролактина; при возрастании концентраций дофамина секреция пролактина подавляется [41]. В то же время исследования показали, что пролактин способен стимулировать синтез и обмен гипоталамического дофамина и его секрецию в систему портальных сосудов гипофиза, воздействуя главным образом на TIDA-нейроны [42]. Таким образом, между дофамином и пролактином существует короткая петля механизма обратной связи. Патологическая гиперпролактинемия приводит к нарушению в системе упомянутой короткой петли.
Патологическая гиперпролактинемия приводит к гипогонадизму и ановуляторному бесплодию. Характерными симптомами патологической гиперпролактинемии у женщин являются нарушения менструального цикла (аменорея, олигоопсоменорея, ановуляторные циклы, недостаточность лютеиновой фазы), галакторея, бесплодие, снижение полового влечения, фригидность. У мужчин в подобном состоянии часто наблюдается снижение либидо и потенции, бесплодие вследствие патоспермии. Наиболее часто — около половины всех случаев выявления гиперпролактинемии — причиной этого синдрома служит пролактинсекретирующая опухоль гипофиза пролактинома [43]. Пациенты также могут предъявлять жалобы, связанные со значительными размерами опухоли, на головные боли, сужение полей зрения [41, 44, 45]. Фармакологическое лечение больных с пролактинóмами в настоящее время осуществляется агонистами дофамина: бромокриптином и каберголином. Зная механизмы взаимного влияния пролактина и кисспептина, можно воздействовать на другие звенья патогенеза гиперпролактинемии, а также изучить возможность использования кисспептина в лечении больных с дофаминрезистетными пролактиномами.
Влияние пролактина на кисспептин
В исследованиях было показано, что очень небольшое число ГнРГ-нейронов экспрессируют рецепторы к пролактину; кроме того, пролактин не влияет на мембранную возбудимость ГнРГ-нейронов [46, 47]. Из этого следует, что пролактин оказывает влияние на секрецию ГнРГ опосредованно, а именно — через кисспептин [48]. Исследования на животных продемонстрировали, что большинство аркуатных Kiss-нейронов ко-экспрессируют рецепторы пролактина [12, 13, 24]. Данные иммуногистохимических исследований показывают, что высокий уровень пролактина подавляет экспрессию кисспептина [11]. У лактирующих крыс, а также нерожавших овариэктомированных крыс после введения овечьего пролактина фиксируются сниженные уровни экспрессии кисспептина нейронами аркуатного ядра и снижение уровня ЛГ в плазме крови. Индуцированная бромокриптином блокада действия пролактина в обеих упомянутых группах крыс значительно увеличивала экспрессию киссептина в аркуатном ядре и ЛГ в плазме, но не восстанавливала ее до уровней, которые фиксируются у этих животных вне лактации [11]. Аналогичные результаты были получены в исследованиях на овцах [13, 49, 50]. На основании этих данных можно детерминировать кисспептин-опосредованный путь, через который гиперпролактинемия блокирует секрецию ГнРГ и ЛГ и вызывает бесплодие [51].
Влияние кисспептина на пролактин
Имеются противоречивые данные об изменении уровня пролактина в плазме крови в ответ на введение кисспептина у человека и животных [24, 50—53]. В одной из работ [54] было продемонстрировано, что подкожное введение в течение недели кисспептина-54 здоровым женщинам в дозе, стимулирующей секрецию гонадотропинов (37 мкг/кг2 раза в день с 7-го по 14-й день менструального цикла), не вызывало увеличения уровня пролактина в периферической крови. Возможно, способность кисспептина стимулировать секрецию пролактина напрямую зависит от уровня эстрогенов [48, 50]. Было показано, что кисспептин-10 в дозе 0,6 и 3 нмоль увеличивал плазменный уровень пролактина и снижал уровень 3,4-дигидроксифенилацетиловой кислоты (основного метаболита дофамина) у овариэктомированных крыс, которым вводился эстрадиол. В то же время у овариэктомированных крыс в условиях дефицита эстрогенов подобный эффект отсутствовал, что демонстрирует эстрогензависимый механизм регуляции [24]. Наличие рецептора эстрогенов на нейронах TIDA было также подтверждено иммуногистохимически [55, 56].
Известно, что дофамин ограничивает избыточное выделение пролактина и снижает родительскую мотивацию. Кисспептин же снижает активность тубероинфундибулярных дофаминергических нейронов у мышей, уменьшая секрецию дофамина и вызывая увеличение секреции пролактина лактотрофами аденогипофиза [24]. Увеличение секреции пролактина лактотрофами в ответ на воздействие кисспептина было также продемонстрировано на культуре клеток аденогипофиза крупного рогатого скота [57].
Таким образом, для обеспечения репродуктивной функции необходим нормальный базальный уровень пролактина, который, по всей вероятности, обеспечивается кисспептином посредством ингибирующего влияния последнего на дофаминергические нейроны. В условиях же гиперпролактинемии снижается продукция кисспептина, что приводит к активации дофаминергических нейронов [24]. Секреция пролактина закономерно должна снижаться и ослаблять ингибирующее влияние на репродуктивную ось, однако этого не происходит. Возможно, что в условиях гиперпролактинемии ингибирующее влияние пролактина на Kiss-нейроны оказывается больше, чем влияние кисспептина на нейроны TIDA. Следовательно, есть вероятность, что ингибирующее действие пролактина на аркуатные/инфундибулярные нейроны кисспептина может быть также вовлечено в регуляцию своей собственной секреции через обратную связь [11].
Перспективы использования кисспептина при лечении пациенток с бесплодием
Гиперпролактинемия стала первым клиническим синдромом, при котором были изучены терапевтическое влияние кисспептина на организм человека [48]. В ряде исследований было продемонстрировано увеличение уровня ЛГ в ответ на введение кисспептина пациенткам как с нормальным (при гипоталамической аменорее), так и повышенным уровнем пролактина [54, 58—61]. Количество работ, подтверждающих эту взаимосвязь, неуклонно растет. В работе [58] было зафиксировано 10-кратное увеличение уровня ЛГ и 2,5-кратное увеличение уровня ФСГ в ответ на подкожное введение 6,4 нмоль/кг кисспептина-54 у женщин с аменореей на фоне гиперпролактинемии. После введения кисспептина-54 пациенткам с гипоталамической аменореей также получены позитивные результаты — выявлен преовуляторный уровень ЛГ [59].
Полученные данные о стимулированных уровнях гонадотропинов разнятся в зависимости от способов введения кисспептина (подкожно или внутривенно), его доз, кратности и длительности лечения. У женщин с патологической гиперпролактинемией уровень ЛГ в ответ на введение кисс-пептина увеличивается примерно в 5 раз по сравнению с таковым у здоровых женщин в раннюю фолликулярную фазу [61], что было подтверждено во всех исследованиях вне зависимости от кратности и доз введения, а также длительности терапии. Возможно, длительный дефицит кисспептина в условиях хронической гиперпролактинемии приводит к компенсаторному повышению чувствительности к нему.
Исследования влияния кисспептина и пролактина на репродукцию открывают большие возможности в лечении больных с бесплодием вследствие овариальной дисфункции, в том числе на фоне гиперпролактинемии [62]. Лечение пролонгированными агонистами дофамина в условиях современной клинической практики позволяет у большинства пациенток с гиперпролактинемией различного генеза нормализовать уровень пролактина в крови, что сопровождается восстановлением овуляторной функции. Тем не менее в случаях гиперпролактинемии, полностью или частично резистентной к лечению агонистами дофамина, возможность применения кисспептина с целью восстановления овуляции может дать шанс пациентке забеременеть вне зависимости от уровня пролактина.
Заключение
Активность Kiss-нейронов является важной составной частью влияния пролактина на репродуктивную ось. Изучение взаимного влияния пролактина и кисспептина расширило знания о регуляции репродуктивной функции, позволило более точно понять механизмы овариальной дисфункции на фоне гиперпролактинемии, и в перспективе может дать новые медикаментозные методы стимуляции овуляции.
Достинекс®: Эффективная терапия полного спектра симптомов гиперпролактинемии
Патологическая гиперпролактинемия – одна из наиболее распространенных нейроэндокринных проблем, связанных с гипоталамо-гипофизарной дисфункцией. Основа терапии – применение агонистов дофамина, наибольшее предпочтение среди которых отдается каберголину.
Пролактин – гормон, который синтезируется лактотрофными клетками передней доли гипофиза. В его уникальный спектр входит более 80 биологических эффектов и 300 функций, что превышает суммарный показатель всех гормонов гипофиза 1 . В первую очередь гормон регулирует функционирование половой системы, как у мужчин, так и у женщин, отвечая за либидо, возможность зачатия, поддержание беременности и лактации. Кроме того, пролактин является модулятором жирового метаболизма, массы тела и плотности костной ткани.
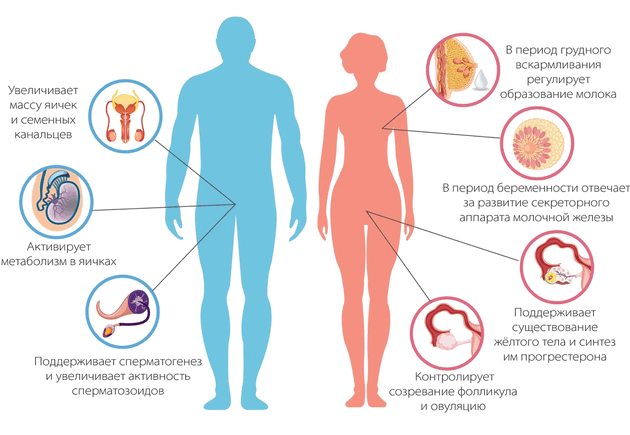
Таким образом, любые патологические изменения уровня пролактина неизбежно отражаются на состоянии как женского, так и мужского организма. Наиболее распространенным нарушением является гиперпролактинемия, то есть стойкое повышение уровня пролактина выше нормального.
Причины и эпидемиология гиперпролактинемии
Повышение уровня пролактина может быть связано с физиологическими причинами, к которым относятся беременность и грудное вскармливание, половой акт, стрессовые состояния, физические упражнения, прием белковой пищи или гипогликемия. В отличие от преходящего характера физиологической гиперпролактинемии, патологическое повышение уровня гормона всегда продолжительно и свидетельствует об имеющихся системных нарушениях.
Патогенетические механизмы гиперпролактинемии связаны с нарушением дофаминингибирующего влияния на продукцию и высвобождение пролактина. Постоянная стимуляция секреции гормона приводит к гиперплазии лактотрофов гипофиза, а потенциально и к формированию микро- или макроаденомы 2 .
Чаще всего гиперпролактинемия является симптомом аденомы гипофиза. Реже сбор анамнеза или результаты клинических исследований выявляют другие причины увеличения уровня гормона: механические или инфекционные изменения в ножке гипофиза или гипоталамусе, перенесенные операции с применением общей анестезии, цирроз печени, почечную недостаточность, заболевания щитовидной железы или яичников. Иногда гиперпролактинемия носит и ятрогенный характер и выявляется после систематического приема некоторых лекарственных препаратов или медицинских манипуляций 3 .
Высокий уровень пролактина может сопровождать некоторые гинекологические заболевания: аднексит, эндометриоз, миому матки или синдром поликистозных яичников.
Увеличение концентрации лактотропных гормонов, как биохимический маркер гипоталамо-гипофизарной дисфункции, является наиболее распространенной нейроэндокринной патологией. У мужчин патологическая гиперпролактинемия наблюдается в 20 случаях на 100 000, у женщин – в 90 1 . Распространенность же гормонально-активных опухолей передней доли гипофиза, пролактином, по разным данным составляет от 6-10 до 50 случаев на 100 000 населения 4 . Пик заболеваемости гиперпролактинемией у женщин приходится на наиболее активный период жизни – 25-34 года 5 .

Симптомы гиперпролактинемии
Практикующие врачи-гинекологи имеют дело со множеством патологических состояний, связанных с гиперпролактинемией. В связи с обилием функций пролактина и мощным влиянием на репродуктивную систему, патологическое повышение его концентрации можно заподозрить при любых дисфункциях естественного цикла, от аномального маточного кровотечения до гонадотропной аменореи, особенно если они сопровождаются остеопеническим или метаболическим синдромами.
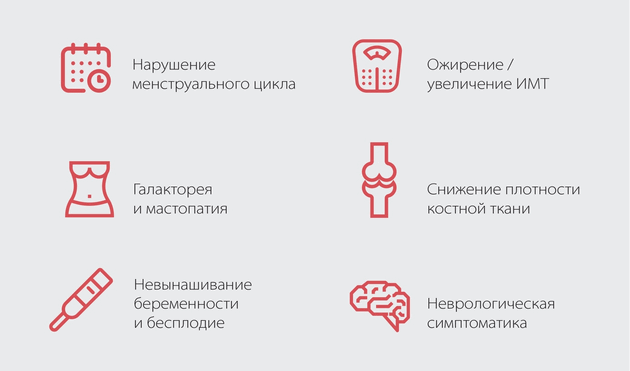
Так, к частым симптомам гиперпролактинемии можно отнести:
• Нарушение менструального цикла. У 30-60% пациенток с гиперпролактинемией отмечаются те или иные сбои цикла: аменорея, олиго- и опсоменорея, ановуляторные циклы, недостаточность лютеиновой фазы 1,6 . Выраженность этих нарушений прямую коррелирует с концентрацией гормона в крови: чем она выше, тем больше вероятность хронической ановуляции. Изучение функции яичников показывает, что у подавляющего большинства (80%) пациенток с гиперпролактинемией нарушение менструального цикла сопровождается именно хронической ановуляцией. Только у 20%, в основном с сохранным циклом или олигоменореей, диагностируется недостаточность лютеиновой фазы 6 .
• Галакторея и мастопатия. Галакторея – патологический процесс выделения молозива из молочных желез вне связи с процессом кормления – варьирует от единичных капель молозива до струйного выделения молока. Объем выделений также напрямую коррелирует с уровнем пролактина в крови. На фоне гиперпролактинемии галакторея встречается у 30-80% пациенток 7 . Повышенный уровень пролактина действует как индуктор гиперпролиферации эпителия протоков молочной железы и повышает восприимчивость клеток к эстрадиолу, что приводит к развитию мастопатии. У мужчин в 6-23% случаев гиперпролактинемии проявляется гинекомастия, которая определяется визуально или при пальпации. Она также может сопровождаться наличием выделений из сосков 8 .
• Невынашивание беременности и бесплодие. Гиперпролактинемия становится причиной бесплодия у женщин в 33% случаев, а у мужчин – до 15% случаев 9 . У женщин, вне зависимости от причины гиперпролактинемии, избыточная секреция пролактина приводит к нарушениям пульсаторного выброса ЛГ, ФСГ, и, как следствие, к гипогонадизму и бесплодию 10 . К тому же, пролактин в высоких концентрациях блокирует эффекты гонадотропинов на уровне органов-мишеней, снижает содержание эстрогена и прогестерона. У мужчин же отмечается олигозооспермия, низкая активность и качество сперматозоидов. Стоит также отметить, что высокий уровень пролактина приводит к снижению мужского либидо и потенции 8 .
Согласно рекомендациям ВОЗ, первым исследованием, которое проводится женщине из бесплодной пары после исключения мужского фактора бесплодия, должно быть определение концентрации пролактина 11 . Именно патологическое повышение уровня этого гормона в большом проценте случаев и является причиной невозможности зачатия.
• Ожирение / увеличение ИМТ. Избыточная масса тела диагностируется у 60% пациенток с гиперпролактинемией, ожирение – у 20%. Высокая концентрация пролактина приводит к формированию инсулинорезистентности и ухудшению липидного обмена 11 . Кроме того, набор веса провоцируется уменьшением допаминергического влияния, возникновением лептинорезистентности и снижением уровня адипонектина.
• Снижение плотности костной ткани. Гиперпролактинемия индуцирует целый каскад метаболических нарушений, приводящих, в частности, к подавлению стероидогенеза в яичникахи и остеопеническому синдрому. В клинических рекомендациях Международного эндокринологического общества «Диагностика и лечение гиперпролактинемии» (Diagnosis and Treatment of Hyperprolactinemia: Аn Endocrine Society Clinical Practice Guideline, 2011) приводятся данные, согласно которым плотность костной ткани позвоночника у женщин с повышенным пролактином уменьшается примерно на 25% и после нормализации уровня гормона не всегда восстанавливается.
• Неврологическая симптоматика. Если причиной гиперпролактинемии является пролактинома, пациент может предъявлять неврологические жалобы, свидетельствующие об опухолевом росте: головная боль, головокружение, нарушение сна, снижение памяти, нарушение зрения. У 20-30% пациентов отмечаются психоэмоциональные расстройства, а у 15-25% – неспецифические жалобы на общую утомляемость и тянущие боли в сердце. Пациенты с гиперпролактинемией часто демонстрируют раздражительность, тревожность, эмоциональную лабильность и аутизацию 1,9 .
Таким образом, оптимальная терапия гиперпролактинемии должна достигать следующих целей:

Регуляция секреции пролактина и основы патогенетической терапии
Секреция пролактина носит импульсный характер, который подчиняется циркадным ритмам, и находится под контролем гипоталамуса. Однако в отличие от других гормонов гипофиза, на синтез пролактина гипоталамус оказывает в основном тоническое ингибирующее воздействие.
Регуляция происходит преимущественно с помощью двух гормонов гипоталамуса: дофамина, который ингибирует синтез пролактина, и ТТГ, который ее стимулирует.
Центральная регуляция пролактина обеспечивается также и другими стимуляторами его синтеза – серотонином и эндорфинами.
Дофамин занимает ключевую позицию в цикле секреции пролактина. Он высвобождается непосредственно в портальную систему гипофиза и прямо ингибирует лактотрофы. Через дофамин осуществляется и собственная регуляция продукции пролактина: он корректирует уровень своей секреции с помощью регуляции уровня дофамина в гипоталамусе. Механизма же отрицательной обратной связи у пролактина нет.
Именно поэтому, воздействие на метаболизм дофамина является наиболее действенным и перспективным направлением патогенетической терапии гиперпролактинемии.
Первая линия терапии гиперпролактинемии
Наиболее содержательными источниками по диагностике и лечению гиперпролактинемии на сегодняшний день являются клинические рекомендации Международного эндокринологического общества (International Society of Endocrinology?–?ISE, 2011) и Федеральные клинические рекомендации по пролактинемии Российской ассоциации эндокринологов (2015). Рекомендации детально описывают доказательные подходы к оценке этиологии гиперпролактинемии, тактики лечения различных ее видов, включая лекарственно-индуцированную, и аденом гипофиза.
Согласно всем действующим руководствам, основная роль в медикаментозной терапии симптоматических пролактин-секретирующих микроаденом или макроаденом принадлежит агонистам дофамина. При выборе конкретного препарата этой группы предпочтение отдается каберголину (оригинальный препарат Достинекс®), благодаря его высокой эффективности в отношении нормализации уровня пролактина и высокой частоте случаев уменьшения размера опухоли.

Клинические исследования показали, что при макропролактиномах уменьшение размеров опухоли на фоне приема отмечается в 82,1% случаев, а при микропролактиномах – в 90% 12 . Полное исчезновение пролактиномы диагностируется у 57,5% пациентов 13 . Восстановление овуляторного менструального цикла достигается более чем у 90% больных 14 .

Достинекс® является синтетическим производным эрголина. Механизм его действия основан на прямом взаимодействии на дофаминовые рецепторы лактотрофов. Однократный прием 0,3-0,6 мг каберголина уже через 3 часа вызывает снижение уровня пролактина в сыворотке крови, а максимальное действие наблюдается со вторых по пятые сутки. В более высоких дозах препарат действует до 14 суток 15 .
Таким образом, помимо быстрого развития эффекта и его стойкости, еще одним преимуществом Достинекс® является его редкий прием, всего 2 раза в неделю, что с одной стороны позволяет избежать резких колебаний концентрации препарата в крови, а с другой, увеличивает комплаентность к лечению и снижает стоимость курса в пересчете на сутки.
Прием Достинекс® очень быстро приводит к нормализации показателей пролактина (550 мЕд/л для женщин, 400 мЕд/л для мужчин), возвращению естественного менструального цикла у женщин и регрессии симптомов сексуальной дисфункции у мужчин. К сожалению, достижение целевых показателей становится причиной для многих клиницистов сразу же отменить препарат, в то время как контроль уровня пролактина до отмены терапии должен продолжаться как минимум еще 6 месяцев. Такая ошибка нередко приводит к возвращению патологической пролактинемии и росту опухоли. Немаловажным условием эффективности терапии Достинекс® непременно является ее долговременность. При пролактиномах, когда существует возможность ремиссии, плановая отмена Достинекс® сроком на 1-2 месяца возможна 1 раз в 2 года под контролем уровня пролактина и клинической симптоматики. При наступлении беременности у пациенток с гиперпролактинемией, что случается часто, так как является одной из целей лечения, терапию агонистами дофамина отменяют, но при наличии симптомов прогрессивного роста опухоли, назначают снова. В большинстве же случаев медикаментозная терапия пролактином назначается на длительный срок (до 2-4 лет), а иногда пожизненно 15 .
Клиническая эффективность
Эффективность каберголина (Достинекс®) была показана в исследовании 2008 года Vilar и соавт. Из 1234 пациентов с гиперпролактинемией различной этиологии у 388 была диагностирована пролактинома. Авторы проанализировали уменьшение размера опухоли в двух группах: Достинекс®, в дозе 1,0-3,5 мг/нед и бромокриптина 5-15 мг/сут. В среднем после года терапии значительное уменьшение размера опухоли зафиксировано у 80% принимавших Достинекс® и у 58,7% принимавших бромокриптин (p=0,048). Полное же исчезновение опухоли было отмечено у 57,5% и 34,7% пациентов соответственно (p=0,034) 16 .
Согласно результатам сравнительного исследования Sarno и соавт. 2001 года, включившего 207 пациенток с гиперпролактинемией, разница в показателях уменьшения размеров опухолей на фоне терапии в группах каберголина и бромокриптина была значительной. При макропролактиномах опухоль уменьшилась у 82,1% женщин в группе Достинекс® против 46,4% в группе бромокриптина, а при микропролактиномах – у 90% против 56,8% соответственно 12 .
Профиль безопасности Достинекс® подвергся сравнительному анализу в работе Webster и соавт. (1997). На группе из 459 пациенток с гиперпролактинемией было достоверно доказано, что частота побочных реакций от приема Достинекс® (тошнота и рвота) значительно ниже (31% и 4%), чем от приема бромокриптина (50% и 10%). Кроме того, из-за нежелательных явлений от лечения отказались 3% пациентов из группы Достинекс® и 12% пациентов из группы бромокриптина 17 .
Применение агонистов дофамина в корне изменило роль нейрохирургии в лечении аденомы гипофиза, снизив число операций по удалению опухоли в три раза всего за 10 лет. Хирургия окончательно уступила место консервативной терапии, и если в 2004 году оперативному лечению подвергались 16,5% больных с этим диагнозом, то в 2014 году их доля составляла всего 5,8% 1 . На сегодняшний день Достинекс® является терапией выбора у пациентов с гиперпролактинемией, в том числе ассоциированной с пролактиномой. В последнем случае Достинекс® позволяет добиться значительного уменьшения или полного исчезновения опухоли гипофиза, нарушений менструального цикла и бесплодия без хирургического вмешательства у большинства пациентов. Агонисты дофаминовых рецепторов, в частности препарат последнего поколения – каберголин, можно считать прорывом в области лечения опухолей головного мозга.
Читайте также:
