Нарушения моторики
Обновлено: 01.05.2024
Цель исследования: оценка некоторых показателей периферической электрогастроэнтерографии (ЭГЭГ) желудочно-кишечного тракта (ЖКТ) (суммарной мощности, мощности различных отделов ЖКТ и коэффициента ритмичности) у пациентов с неалкогольной жировой болезнью печени (НАЖБП) и определение влияния метаболической терапии основного заболевания препаратами урсодезоксихолевой кислоты (УХДК) на моторно-эвакуационную функцию ЖКТ.
Дизайн: проспективное обсервационное аналитическое (типа «случай — контроль») открытое рандомизированное исследование.
Материалы и методы. Обследованы 124 человека: 49 больных с верифицированной НАЖБП (группа 1), 47 — с синдромом раздраженного кишечника (СРК) (группа 2), 18 — с НАЖБП и СРК (группа 3), 10 здоровых добровольцев (группа 4). У всех участников оценивали показатели периферической ЭГЭГ (показатели суммарной мощности и мощностей каждого из отделов пищеварительного тракта) и относительный коэффициент ритмичности. Тридцать пациентов группы 1 получали препараты УДХК в дозе 15 мг/кг массы тела в течение 3 месяцев с последующим повторным исследованием моторно-эвакуаторной функции ЖКТ.
После лечения у 30 больных группы 1 отмечена тенденция к увеличению прироста суммарной мощности в постпрандиальном периоде: до лечения — 1,27 (0,47; 2,89), после лечения — 2,74 (1,67; 4,57), а также тенденция к росту мощности во всех отделах ЖКТ.
Заключение. Изменение ритма работы кишечника после пищевой нагрузки у пациентов с НАЖБП (группа 1) более значительно, чем у участников других групп. На фоне терапии препаратами УДХК отмечена гармонизация моторно-эвакуационной функции ЖКТ. Результаты исследования открывают перспективы для понимания патогенеза НАЖБП и моторно-эвакуаторных нарушений работы пищеварительного тракта при данном заболевании.
Авторы заявляют об отсутствии возможных конфликтов интересов.
Неалкогольная жировая болезнь печени (НАЖБП) на протяжении последних десятилетий занимает лидирующие позиции по распространенности среди диффузных заболеваний печени [1]. Чаще всего НАЖБП носит доброкачественный характер, однако с жировой дистрофией печени ассоциированы воспалительные процессы в гепатоцитах с развитием неалкогольного стеатогепатита (20-30%) и в последующем фиброза печени [2].
Обычно клинически бессимптомная НАЖБП представляет собой фенотипически полиморфное заболевание, которое по своей системной природе имеет переменные клинические проявления и широкий спектр лабораторных признаков. Понимание фенотипического полиморфизма НАЖБП является ключевым в диагностическом процессе, так как в повседневной клинической практике большинство пациентов, у которых в последующем выявляется НАЖБП, часто обращаются за медицинской помощью либо в связи с появлением симптомов желудочной или кишечной диспепсии, либо из-за других необъяснимых для них нарушений работы гастроинтестинального тракта или его моторики, которые, по данным УЗИ печени, ассоциируются с жировым гепатозом 5.
В последнее время активно изучаются состояние и значимость органов пищеварения в развитии НАЖБП. Особенно интересными представляются изменения моторики пищеварительного тракта у больных с избыточным питанием [6]. Известно, что моторика, опорожнение желудка и тонкой кишки играют важную роль в регуляции растяжения желудка и интестинальной экспозиции нутриентов, а соответственно, в контроле ощущений насыщения и пресыщения [7]. В одном из исследований показано, что у мышей, накормленных пищей с высоким содержанием жира, наблюдается снижение холецистокинин- и олеат-индуцированного ингибирования желудочной моторики [8]. В нескольких исследованиях получены данные о замедленном опорожнении желудка в постпрандиальном периоде у лиц с ожирением 11.
Моторика тонкой кишки также влияет на абсорбцию нутриентов, и это может играть определенную роль в развитии ожирения. Исследование N.P. Hyland и соавт. подтвердило наличие нарушений интестинальной моторики, модификацию функции подслизистых нервных окончаний и снижение электрогенного транспорта глюкозы у мышей с ожирением [12].
Несмотря на то что ожирение — один из наиболее важных этиологических факторов развития метаболического синдрома и НАЖБП, лишь небольшое количество исследований посвящены нарушению интестинальной моторной функции при данной патологии. В подобных работах установлено, что при НАЖБП и циррозе печени неалкогольной этиологии имеют место пролонгирование ороцекального транзита и увеличение суммарной мощности ЖКТ [13, 14]. Это свидетельствует об изменениях моторики пищеварительного тракта при НАЖБП и метаболическом синдроме и вероятных нарушениях интестинального барьера, в то время как системное воспаление и нейрональная сигнализация, по-видимому, являются ключевыми факторами, поддерживающими данные нарушения.
Ожирение и накопление жира в печени предположительно связаны с возникновением или развитием моторно-эвакуационных нарушений органов пищеварения. Существует много ассоциированных с НАЖБП явлений, таких как дисгармонизация кишечной микробиоты, нарушение кишечного барьера, моторики кишечника и дисфункция со стороны нервной системы, которые играют существенную роль в возникновении заболевания и связаны с иммунной активацией и воспалением. В работе Я.М. Вахрушева и М.В. Ляпиной [15] при исследовании электрической активности отделов ЖКТ методом периферической электрогастроэнтерографии (ЭГЭГ) у пациентов с метаболическим синдромом установлена недостаточная реакция моторики желудка в ответ на пищевую стимуляцию. В этой работе авторы также показали, что характерные для метаболического синдрома отклонения в гормональном статусе коррелируют с выявленными нарушениями моторики ЖКТ — снижением скорости эвакуации из двенадцатиперстной кишки и уменьшением электрической активности тонкой кишки.
Исследования по так называемой оси «печень — кишка» свидетельствуют о роли микробиоты кишечника, избыточного бактериального роста и дисфункции кишечной проницаемости в патогенезе НАЖБП [16]. В работах P. Brun и соавт. показано, что печеночные клетки чувствительны к бактериальным эндотоксинам, а у генетически тучных мышей наблюдается нарушение кишечной проницаемости, приводящее к увеличению портальной эндотоксемии [17].
Изучение моторно-эвакуаторной функции пищеварительного тракта посредством определения миоэлектрической активности (МЭА) начато более 40 лет назад. В 1963 г. А.М. Bilgutay и соавт. использовали электрическую стимуляцию — интралюминальные электроды, введенные через назогастральный зонд после лапаротомии, для стимуляции и укорочения периода восстановления функции подвздошной кишки при парезах в постоперационном периоде [18, 19]. В настоящее время существуют неинвазивные методы исследования МЭА желудка с помощью накожных электродов, например ЭГЭГ [20].
С учетом вышесказанного изучение моторной функции пищеварительного тракта у пациентов с НАЖБП и ее возможная модификация посредством определенных лекарственных воздействий представляют научный и клинический интерес.
Цель нашего исследования: оценка некоторых показателей периферической ЭГЭГ ЖКТ (суммарной мощности, мощности различных отделов ЖКТ и коэффициента ритмичности) у пациентов с НАЖБП и определение влияния метаболической терапии основного заболевания препаратами урсодезоксихолевой кислоты (УХДК) на моторно-эвакуационную функцию ЖКТ.
МАТЕРИАЛЫ И МЕТОДЫ
В проспективное обсервационное аналитическое (типа «случай — контроль») открытое рандомизированное исследование путем сплошной выборки отобраны 124 человека. Обследование проводилось с 2014 по 2017 г. амбулаторно и в условиях стационара на базе клиники кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии имени С.М. Рысса ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И.И. Мечникова» Минздрава России.
Участники были разделены на 4 группы. При включении в исследование проводили стандартное клиническое обследование, периферическую ЭГЭГ. Характеристика групп представлена в таблице 1 .
Характеристика участников исследования
В исследование не включали лиц моложе 18 лет и пациентов с тяжелой коморбидной патологией, с острыми гепатитами любой этиологии, хроническими заболеваниями печени иной этиологии, чем НАЖБП (вирусными, алкогольными, аутоиммунными гепатитами и проч.). Диагноз НАЖБП был установлен на основании результатов комплексного обследования в соответствии с существующими международными и российскими стандартами [21]. Диагноз синдрома раздраженного кишечника (СРК) ставили в соответствии с Римскими критериями III пересмотра, которые были актуальны на момент формирования групп [22].
Электрическую активность ЖКТ оценивали с помощью периферической ЭГЭГ. Она проводилась с использованием электроэнтерографа ГЭМ-01-«Гастроскан-ГЭМ» (ЗАО НПП «Исток-Система»). Данный прибор позволяет определить электрическую активность и моторно-эвакуаторную функцию желудка, двенадцатиперстной, тощей, подвздошной и толстой кишки. В настоящем исследовании использован стандартный вариант периферической ЭГЭГ: 45-минутная съемка тощаковой фазы и 45-минутная съемка постпрандиальной фазы. Стандартный завтрак для исследования в постпрандиальном периоде включал в себя черный чай с 5 г сахара, 100 г гречневой каши и 30 г белого хлеба.
Оценивали показатели суммарной мощности P(s), мощностей каждого из отделов пищеварительного тракта P(i) и относительный коэффициент ритмичности:
После включения в исследование и выполнения первичной периферической ЭГЭГ 30 пациентов из группы 1 получали метаболическую терапию препаратом УДХК в дозе 15 мг на 1 кг массы тела в течение 3 месяцев с последующим повторным определением моторно-эвакуаторной функции ЖКТ. Регистрацию клинических показателей и периферическую ЭГЭГ у них производили в 1-й и 90-й дни исследования.
Все участники подписали информированное согласие, а также согласие на обработку персональных данных. Исследование одобрено локальным этическим комитетом ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России.
Для статистической обработки полученных данных использована программа SPSS 17.0 (SPSS Inc., США). Вследствие выраженных отличий распределения вариационных рядов от нормального, выявленных тестами Колмогорова — Смирнова и Фишера, для описательной статистики выбраны медиана и квартили, а для анализа данных — непараметрические статистические критерии. Сравнение групп по номинальным показателям проводилось с помощью критерия χ 2 , по количественным показателям — с помощью критерия Манна — Уитни. Различия считали статистически значимыми при р < 0,05.
Миоэлектрическая активность желудочно-кишечного тракта
Показатели МЭА ЖКТ в исследованных группах представлены в таблице 2 .
Показатели миоэлектрической активности желудочно-кишечного тракта (ЖКТ), Ме (Q1; Q3)

Значения, полученные при измерении показателей, были статистически неоднородными и разнонаправленными при сравнении медианы показателей мощностей как в тощаковой фазе, так и в постпрандиальном периоде (коэффициент вариации составил более 33%). С учетом этого факта и того, что важным в оценке функции отделов пищеварительного тракта стало изменение именно суммарной мощности ЖКТ и мощности каждого из его отделов, нами был разработан и введен показатель нарастания мощности в ЖКТ — коэффициент нарастания мощности в постпрандиальном периоде — coefficient of postprandial growth (kPG). Он рассчитывался как частное показателя электрической активности после стандартной пищевой стимуляции и показателя электрической активности тощаковой фазы (kPG = Pпосле еды/Рнатощак).
Если kPG был больше 1,0, у пациента в постпрандиальном периоде имело место нарастание мощности, меньше 1,0 — снижение мощности. kPGP(s) свидетельствовал об изменении суммарной мощности, kPGP(i) — об изменении мощности отделов ЖКТ.
Анализ kPGP(s) показал, что у пациентов группы 1 в постпрандиальном периоде отсутствовал прирост суммарной мощности: kPGP(s) у них — 0,58 (0,27; 2,14). У участников групп 2, 3 и 4 kPGP(s) был выше 1,0 и составил 1,54 (1,0; 3,04), 2,11 (1,20; 14,27) и 1,66 (1,59; 1,92) соответственно (р < 0,05 для отличия группы 1 от каждой из других групп). У больных группы 3 выявлено более значительное повышение суммарной мощности по сравнению с участниками других групп.
При оценке kPGP(i) в различных отделах ЖКТ у пациентов группы 1 в постпрандиальном периоде отмечался неадекватный ответ на стандартную пищевую нагрузку в виде снижения мощности во всех отделах, кроме двенадцатиперстной кишки; у участников групп 2, 3 и 4 ответ на пищевую стимуляцию во всех отделах ЖКТ был нарастающим — kPGP(i) у них во всех отделах превышал 1,0 ( табл. 3 ). При сравнении kPGP(i) в двенадцатиперстной кишке выявлено, что в группе 1 этот показатель был значимо ниже, чем в группах 3 и 4 (в обоих случаях р < 0,05) (см. табл. 3 ).
Коэффициент прироста мощности kPGP(i) различных отделов желудочно-кишечного тракта (ЖКТ), Ме (Q1; Q3)

Наименьшее нарастание мощности в постпрандиальном периоде отмечено у пациентов группы 1 в толстой кишке: kPGP(i) у них был самым низким, прирост мощности в данном отделе ЖКТ составил 0,52. У больных группы 2 (СРК) и группы 3 (сочетание НАЖБП и СРК) ответ на пищевую нагрузку в толстой кишке по сравнению с показателем группы 4 имел тенденцию к гиперкинетической активности (р2-4 > 0,05) или превышал показатель у здоровых лиц (р3-4 < 0,01) (см. табл. 3 ).
Показатели нарастания Kritmотн% в постпрандиальном периоде представлены в таблице 4 . У пациентов группы 1 во всех отделах пищеварительного тракта он был снижен, в то время как в других группах после приема пищи ритмичность отделов ЖКТ возрастала. Kritmотн% в тощей кишке у пациентов групп 1, 2 и 3 не достигал уровня группы 4 (здоровые добровольцы). В группе 3 отмечено нарастание Kritmотн%, но в тощей кишке оно было значимо ниже, чем в группе 4, а в толстой кишке Kritmотн% превышал таковой в группе 4.
Нарастание коэффициента ритмичности (Kritmотн%) отделов желудочно-кишечного тракта (ЖКТ) у пациентов в постпрандиальном периоде, %

Результаты исследования периферической электрогастроэнтерограммы пациентов с неалкогольной жировой болезнью печени после терапии урсодезоксихолиевой кислотой
Тридцать больных с НАЖБП (из группы 1) в течение 3 месяцев получали препараты УДХК в дозе 15 мг/кг массы тела. После лечения у них отмечена тенденция к увеличению прироста суммарной мощности в постпрандиальном периоде: до лечения — 1,27 (0,47; 2,89), после лечения — 2,74 (1,67; 4,57) ( рис. ), а также тенденция к увеличению мощности во всех отделах ЖКТ ( табл. 5 ).
Рис. Показатель нарастания суммарной мощности всех отделов гастроинтестинального тракта после пищевой стимуляции на фоне терапии

Коэффициент прироста мощности kPGP(i) различных отделов желудочно-кишечного тракта (ЖКТ) у пациентов с неалкогольной жировой болезнью печени до и после терапии, Ме (Q1; Q3) (n = 30)

У пациентов, получавших препарат УДХК, при сравнении показателей Kritmотн% в динамике выявлена некоторая гармонизация работы всех отделов ЖКТ в ответ на пищевую стимуляцию, но статистически значимых изменений не было.
Требует дальнейшего анализа и изучения электрическая активность ЖКТ у пациентов с НАЖБП, страдающих СРК, необходимы исследования большего числа больных с подобной патологией, так как, несмотря на однонаправленность изменений суммарной мощности и мощности, например, тощей кишки в постпрандиальном периоде, многие данные требуют дальнейшего осмысления.
Показанные изменения моторно-эвакуационных нарушений в ЖКТ при НАЖБП могут свидетельствовать о более значимом вовлечении пищеварительного тракта в патогенез жировой дегенерации печени и улучшить понимание роли нарушений эвакуаторной функции ЖКТ и дисфункции кишечной проницаемости при данной патологии. Мы полагаем, что дискоординация работы ЖКТ, в частности возможное уменьшение скорости эвакуации пищевого химуса по тонкой кишке, низкий тонус и снижение ритмичности толстой кишки у больных НАЖБП после пищевой нагрузки, нарушает соотношение питательных веществ в составе кишечного потока, тем самым изменяя темп их переноса из энтеральной во внутреннюю среду, нарушая гомеостаз и усугубляя метаболические нарушения, в том числе в обмене липидов.
В ходе нашего исследования у пациентов с НАЖБП установлена гармонизация моторно-эвакуационной функции ЖКТ на фоне терапии препаратами УДХК в течение 3 месяцев, что может являться темой дальнейших исследований — не только эффективности данного средства для улучшения метаболизма гепатоцитов, но и определения перспективы влияния на моторику ЖКТ, в первую очередь отделов тонкой кишки.
Проведенное исследование является перспективным для понимания моторно-эвакуаторных нарушений в пищеварительном тракте и патогенеза неалкогольной жировой болезни печени (НАЖБП). Данные, полученные в результате работы, могут дополнить существующую концепцию патогенеза НАЖБП и способствовать оптимизации терапии этой патологии.
Нарушения моторики пищевода и кишечника
Что такое нарушения моторики пищевода и кишечника?
Пищевод и кишечник нарушения моторики это проблемы с глотанием или пищеварением, которые возникают, когда нервы или мышцы пищеварительного тракта или кишечника не работают должным образом.
Существует множество различных типов нарушений моторики пищевода и кишечника, которые могут поражать различные отделы пищеварительного тракта. Некоторые примеры этих расстройств включают, но не ограничиваются:
ахалазия
ахалазия это расстройство, которое затрудняет прохождение пищи и жидкости в желудок из-за повреждения нервов в пищеводе. Симптомы могут включать затрудненное глотание, изжогу, грудная боль, срыгивание или потеря веса.
Дисфагия
Дисфагия описывает трудности с глотанием пищи или жидкости. Люди с этим заболеванием могут кашлять или задыхаться во время еды или питья, срыгивать пищу, иметь постоянное слюнотечение или ощущение, будто пища застряла в горле или груди.
Диффузный пищеводный спазм (ДЭС)
Это расстройство моторики пищевода, которое вызывает нескоординированные сокращения пищевода. Из-за этого проглоченная пища или питье не проталкиваются должным образом в желудок. Симптомы включают сжимающую боль в груди, трудности с глотанием пищи или ощущение, будто пища застряла в горле.
Гастроэзофагеальной рефлюксной болезни (ГЭРБ)
Это заболевание пищеварения, при котором желудочная кислота или желчь раздражают слизистую оболочку трубки, соединяющей рот и желудок. Симптомы включают изжогу, тошноту, регургитацию или затрудненное глотание.
Запор
Запор описывает движения кишечника, которые затруднены, болезненны или происходят реже, чем обычно. У людей с запорами может возникать стул менее трех раз в неделю, напряжение при дефекации или ощущение, что они не могут полностью опорожнить стул.
Гастропарез
Гастропарез это состояние, которое влияет на мышцы желудка и препятствует правильному опорожнению желудка, влияя на пищеварение. Симптомы могут включать расстройство желудка, рвоту, потерю веса, вздутие живота и изжогу.
Болезнь Гиршпрунга
Это состояние также известно как врожденный мегаколон и представляет собой состояние толстого кишечника, которое затрудняет прохождение стула. Симптомы могут включать вздутие живота, запор, рвоту и метеоризм.
Как диагностируются нарушения моторики пищевода и кишечника?
Не существует одной основной причины, приводящей к развитию нарушений моторики пищевода и кишечника. Многие различные факторы могут играть роль, в том числе слабые мышцы пищевода, неврологические расстройства, нервно-мышечные расстройства, стриктуры или спазмы. Если вы испытываете симптомы, связанные с нарушением моторики пищевода или кишечника, врач проведет медицинский осмотр, а также расскажет вам о вашей истории болезни. Также может быть рекомендовано дальнейшее тестирование, в том числе манометрия пищевода, Рентгеновские лучи, верхняя эндоскопия и т.д.
Все было замечательно, начиная с расписания и людей, с которыми я общалась до, во время и после процедуры.
Все эти люди были чрезвычайно профессиональны и добры. Поведение всего персонала у постели больного было отличным, и они подробно предоставили всю информацию. С медицинскими вещами трудно иметь дело, но с такими людьми дискомфорт облегчался. Я очень рекомендую эту контору всем, кто нуждается в такой помощи.
С Питером было очень легко разговаривать, и он дал понять, что понимает мои проблемы. Он предложил ожидаемое решение. Он был очень эффективным.
Варианты лечения нарушений моторики пищевода и кишечника
Лечение будет зависеть от типа и причины нарушения моторики пищевода или кишечника. Ваш врач примет во внимание ваши симптомы, историю болезни и результаты анализов, чтобы обеспечить наилучшее лечение в вашем случае. Варианты могут включать:
Лекарственные препараты
В некоторых случаях могут помочь лекарства, отпускаемые по рецепту, для контроля мышечных спазмов.
Изменения в питании
Расширение воздушного шара
Во время этой процедуры в сфинктер пищевода с помощью эндоскопии вводят баллон и надувают его, чтобы расширить отверстие. Однако эту процедуру может потребоваться повторить, если сфинктер пищевода не остается открытым.
Миотомия Хеллера
Во время миотомии Геллера мышца на нижнем конце пищеводного сфинктера перерезается, чтобы пища могла легче проходить в желудок.
Инъекции Ботокса®
Ботокс® можно вводить в сфинктеры ЖКТ для облегчения спазмов и уменьшения симптомов.
Ваша команда GI Южного Денвера
В South Denver GI наша команда врачей и поставщиков передовых практик обладает опытом, чтобы предоставить вам превосходную помощь. Если вы хотите узнать больше о расстройствах моторики пищевода и кишечника или вам необходимо записаться на прием в нашем офисе, свяжитесь с нами сегодня!
Функциональная диспепсия как проявление нарушений моторики желудочно-кишечного тракта
Раздел только для специалистов в сфере медицины, фармации и здравоохранения!

И.Г. ПАХОМОВА, к.м.н., доц. кафедры пропедевтики внутренних болезнейСеверо-Западный государственный медицинский университет им. И.И. Мечникова
Рассматривается актуальность функциональной диспепсии, современные представления, основные этиопатогенетические аспекты, алгоритмы диагностики и терапии с акцентом на моторные нарушения верхних отделов желудочно-кишечного тракта как ключевого механизма развития функциональной диспепсии.
Диспепсические жалобы являются одной из наиболее частых причин обращения к врачу. Понятие «диспепсия» может включать в себя как симптом, появляющийся при различных заболеваниях органической природы, так и функциональное расстройство желудочно-кишечного тракта. Впервые термин «диспепсия» (в переводе с греческого – «расстройство пищеварения») был введен еще в конце XIX в. венским педиатром Видерхофером. В отечественной медицине нередко под диспепсией подразумевают «алиментарную» диспепсию, что может быть обусловлено возросшим ритмом жизни, к которому не всегда успевают приспособиться функциональные системы организма, некачественной пищей, нарушением диетического режима и ритма питания.
Функциональная диспепсия, как и прочие функциональные нарушения органов пищеварения, широко распространена в популяции во всем мире. Так, среди европейцев функциональной диспепсией страдают около 20% лиц, в США 29%, с преобладанием лиц женского пола, пик обращаемости с диспепсическими жалобами приходится в среднем на возраст 35–45 лет [1]. По данным Всемирной организации здравоохранения, за последние 60 лет заболеваемость этими расстройствами возросла в 24 раза.
Функциональная диспепсия в соответствии с последними Римскими критериями III определяется как комплекс клинических симптомов (боли или ощущение жжения в эпигастрии, чувство переполнения в подложечной области и раннего насыщения), возникших не менее чем за 6 мес. до постановки диагноза и отмечающихся в течение последних 3 мес. [2].
В то же время постановка диагноза «функциональная диспепсия» – задача для врача общетерапевтического звена непростая. Во-первых, диагноз любого функционального заболевания это диагноз исключения, который надо уметь поставить, обладая достаточными знаниями. Во-вторых, для полноценного обследования пациента необходимо иметь достаточные диагностические возможности. Вместе с тем важно подчеркнуть, что синдром функциональной диспепсии включен в Международную классификацию болезней 10-го пересмотра под шифром К30 «Диспепсия».
Основными этиопатогенетическими факторами возникновения функциональной диспепсии являются:
- нарушение моторной функции желудка,
- изменение чувствительности висцерального аппарата желудка,
- наследственность – GN β3 СС (ТТ, ТС); SERT-P; SERT-SL; TRPV1; MIF-173C и другой генотип,
- психосоциальные факторы,
- инфекция Н. рylori,
- кислотно-пептический фактор.
В отношении нарушения секреции соляной кислоты существует несколько точек зрения. Так, в ряде исследований было показано, что желудочная секреция при ФД у большинства больных не нарушена (Collen M.J., Loebenberg M.J., 1989; Omar E. et al., 1995; Nyren O., 1991). У части пациентов нельзя исключить повышенную чувствительность к нормальным значениям кислотности в желудке, что и обуславливает болевую симптоматику (Simren M., Vos R., 2003; Di Stefano M. et al., 2009; Ishii M. et al., 2008). Также имеются работы, где было показано, что выработка HCL выше нормальных значений, однако нет корреляции между изменением уровня рН в желудке и появлением симптомов (Lee K.J., 2004).
В последние годы активно рассматривается возможность генетической предрасположенности к развитию функциональной диспепсии. Известен ген, кодирующий бета-3 субъединицу внутриклеточного мессенджера G-протеина (GNB3 CС). Кроме того, обсуждается возможная роль полиморфизма промотора гена транспортера серотонина (SERT-P), причем генотип SERT-SL ассоциируется с риском постпрандиального дистресс-синдрома. В общей сложности изучено более 6 генов, влияющих на развитие данного заболевания, которые связаны с нейрогуморальными регуляторными структурами и их взаимодействием с органами пищеварительного тракта [3].
Связь функциональной диспепсии с расстройствами психоэмоциональной сферы хорошо установлена. Так, показано, что при данном заболевании отмечается более высокий уровень тревоги и депрессии по сравнению со здоровыми людьми, а также описывается взаимосвязь диспепсических симптомов с данными нарушениями [4].
Вместе с тем среди различных причин формирования функциональной диспепсии, ключевая роль принадлежит нарушениям двигательной функции верхних отделов желудочно-кишечного тракта, к которым относятся) [5]:
- нарушение рецептивной и адаптивной релаксации желудка (нарушение аккомодации желудка),
- снижение частоты и амплитуды перистальтики желудка, нарушение циклической активности желудка (изменение миоэлектрической активности): тахи-, брадигастрия, антральная фибрилляция,
- замедление эвакуаторной функции желудка,
- нарушение антродуоденальной координации (синхронного расслабления привратника при сокращении антрального отдела желудка),
- ослабление постпрандиальной моторики антрального отдела желудка.
Данные моторные нарушения обусловлены дискоординацией работы регуляторных звеньев различного уровня.
Нельзя не отметить и тот факт, что ключевую роль в развитии функциональной диспепсии играет висцеральная гиперчувствительность, которая связана с нарушением рецепторного восприятия обычных раздражителей. Именно данным феноменом объясняется нарушение аккомодации желудка и изменений его эвакуаторной функции.
Нарушенная аккомодация желудка к поступающей пище встречается в среднем у 40% больных функциональной диспепсией [6] и может привести к несостоятельности нижнего пищеводного сфинктера. Возможно, данное обстоятельство объясняет нередкое сочетание у пациентов функциональной диспепсии и гастроэзофагеальной рефлюксной болезни (ГЭРБ) (в 23–41% случаев) [7].
Нарушенная аккомодация желудка нередко возникает при неритмичном приеме пищи, приеме пищи в больших объемах, при приеме раздражающей пищи для данного больного и ответственна за такие симптомы, как быстрое насыщение, чувство переполнения желудка и боль после еды (табл. 1). Чувство быстрого насыщения при приеме пищи может быть также обусловлено задержкой опорожнения антрального отдела желудка [8], хотя у части больных функциональной диспепсией данный процесс может быть ускорен [9]. При ослаблении моторики антрального отдела и задержке опорожнения желудка у больного наблюдаются тошнота, рвота, боли после еды [10].
В зависимости от преобладания у пациентов тех или иных симптомов согласно Римским критериям III функциональную диспепсию классифицируют на два варианта течения заболевания (табл. 2) [2]:
1. В1а – постпрандиальный дистресс-синдром (ПДС), прежнее название – дискинетический вариант;
2. В1в – синдром боли в эпигастральной области (ЭБС), соответствующий прежнему язвенноподобному варианту.
При этом хотелось еще раз подчеркнуть, что соответствие критериям должно соблюдаться в течение не менее 3 дней в месяц на протяжении последних 3 мес. с начала проявлений и общая продолжительность должна быть не менее 6 мес. перед диагностикой [2].
Cледует отметить тот факт, что в России диагноз функциональной диспепсии, несмотря на наличие данной нозологической единицы в МКБ-10, ставится достаточно редко. К сожалению, если у пациента в процессе обследования не выявляются заболевания, входящие в группу органической диспепсии (например, язвенная болезнь, ГЭРБ, опухоли желудка), то ему, как правило, «по привычке» выставляется диагноз хронического гастрита без морфологического исследования гастробиоптатов. При этом врачи не учитывают тот факт, что т. н. «клинические проявления» гастрита – это, как правило, диспепсические жалобы функционального характера, не сопровождающиеся морфологическими изменениями.
В настоящее время согласно принципам доказательной медицины для впервые обратившихся пациентов с диспепсическими жалобами используется соблюдение следующих подходов:
- получение доказательств связи симптомов с верхними отделами желудочно-кишечного тракта;
- исключение «симптомов тревоги» (лихорадка; немотивированное похудание; дисфагия; рвота кровью; мелена; анемия; лейкоцитоз; увеличение СОЭ);
- пациентам с «симптомами тревоги» или в возрасте старше 40–45 лет обязательна ЭГДС;
- исключение приема НПВП, в первую очередь ацетилсалициловой кислоты;
- при наличии типичных проявлений рефлюкс-эзофагита устанавливается предварительный диагноз «ГЭРБ», назначается обследование и лечение;
- определение инфекции H.рylori, и при положительном ответе необходимо провести эрадикацию пилорического хеликобактера – стратегия «test and treat».
В 2010 г. в Таиланде на международной конференции по вопросам гастроэнтерологии и гепатологии международной группой экспертов с участием российских специалистов были разработаны и предложены к использованию алгоритмы ведения пациентов с функциональной диспепсией, в основу которых и легли описанные выше подходы [11]. Так, для гастроэнтерологов, терапевтов и хирургов был предложен расширенный вариант данного алгоритма (рис. 1).
Несмотря на тот факт, что в литературе встречаются достаточно противоречивые мнения о значимости инфекции H.рylori в развитии нарушений моторики и появления симптомов функциональной диспепсии (De Groot G.N., de Both P.S.M., 1999; Nandurkar S., Talley N.J., Xia H. et al., 1998, Васильев Ю.В., 2008), проведение антихеликобактерной терапии способствует исчезновению последней у 25% пациентов с данным страданием. Согласно Маастрихтскому консенсусу 4 пересмотра эрадикация H.pylori вызывает длительное облегчение диспепсии у 1 из 12 пациентов, инфицированных H. pylori и функциональной диспепсией, и превосходит другое лечение (1а, А) [12].
Учитывая основные этиопатогенетические факторы в развитии функциональной диспепсии, в качестве основной медикаментозной терапии в зависимости от варианта заболевания назначают антисекреторные препараты (ингибиторы протонного насоса) или прокинетики, либо их комбинацию.
По результатам метаанализа, проведенного P. Moayyedi и соавт., в которое вошли 3 347 больных из 10 рандомизированных исследований, была показана эффективность блокаторов протонного насоса в 34% случаев, по сравнению с 25% среди больных, получавших плацебо. Показатель, характеризующий число пациентов, у которых достигнут эффект от лечения, по сравнению с плацебо (Number Needed to Treat NND) составил 10 [13]. Следует отметить, что положительный ответ на прием ингибиторов протонной помпы наблюдается чаще у пациентов с явлениями эпигастрального болевого синдрома.
Наиболее высокой активностью обладают прокинетики различных групп, что является еще одним доказательством ключевой роли в развитии функциональной диспепсии нарушений моторики верхних отделов желудочно-кишечного тракта, в основном по гипокинетическому типу. Метаанализ 14 работ (1 053 пациента с функциональной диспепсией) по изучению эффективности данной группы препаратов показал, что эффективность прокинетиков по сравнению с плацебо составляет 61% и 41% соответственно, при этом NNT = 4 [14]. Важно подчеркнуть, что на эффективность прокинетиков при функциональной диспепсии не влияет наличие или отсутствие у больного хеликобактерной инфекции.
Среди препаратов с прокинетическим действием в настоящее время наиболее широкое распространение получили:
- антагонисты допаминовых рецепторов (метоклопрамид, домперидон),
- стимуляторы 5-НТ4-рецепторов (мозаприд),
- препараты комбинированного действия: антагонисты допаминовых рецепторов и блокаторы ацетилхолинэстеразы (итоприда гидрохлорид).
Фармакологические эффекты домперидона и метоклопрамида связаны с блокадой допаминовых рецепторов, что предотвращает расслабление гладкой мускулатуры желудка и верхних отделов кишечника. Тем самым повышается тонус сфинктеров пищевода желудка и верхних отделов кишечника, ускоряется их опорожнение за счет усиления холинергических влияний. В то же время применение метоклопрамида (обладает как центральным, так и периферическим антидопаминергическим действием) в настоящее время, особенно в педиатрической и геронтологической практике, ограничено в связи с возможными серьезными побочными эффектами (1025%): экстрапирамидные нарушения (мышечный гипертонус, спазм лицевой мускулатуры, гиперкинезы), нежелательные эффекты со стороны центральной нервной системы (головная боль, головокружение, сонливость, беспокойство и др.), гормональный эффект (гиперпролактинемия, галакторея, нарушение менструального цикла) [15]. При применении домперидона приведенные побочные эффекты встречаются редко и выражены в меньшей степени.
К группе агонистов 5-НТ4-рецепторов относится цизаприд, тегасерод, мозаприд. Цизаприд оказывает выраженное стимулирующее действие на моторику пищевода и желудка, повышая тонус нижнего пищеводного сфинктера, усиливая сократительную активность желудка и нормализуя антродуоденальную координацию. Вместе с тем из-за выраженных побочных эффектов (желудочковые аритмии, остановка сердца, внезапная смерть в связи с синдромом удлиненного интервала QT) в настоящее время запрещен к применению в ряде стран, в т. ч. и России. Применение тегасерода при функциональной диспепсии и ГЭРБ показало хорошие результаты, однако в марте 2007 г. реализация данного препарата на фармацевтическом рынке США была приостановлена из-за увеличения риска развития острого инфаркта миокарда [16]. Мозаприд присутствует на российском фармацевтическом рынке и используется в терапии функциональных расстройств коротким курсом (в среднем 2 нед.) с учетом возможных нежелательных реакций и лекарственных взаимодействий.
Следует отметить, что нередко у пациентов функциональной диспепсией возникает необходимость длительного применения средств (не менее месяца), регулирующих моторику верхних отделов желудочно-кишечного тракта. В этой связи наиболее предпочтительными являются средства, не обладающие побочными эффектами, свойственными метоклопрамиду, цизаприду или тегасероду. Примером такого препарата может являться прокинетик с двойным комбинированным механизмом действия (антагонист допаминовых рецепторов и блокатор ацетилхолинэстеразы) – итоприда гидрохлорид. Препа¬рат стимулирует сократительную способность желудка, ускоряет его опорожнение, устраняет антродуоденальную дискоординацию, нормализуя тонус и координацию моторики желудочно-кишечного тракта. Итоприда гидрохлорид обладает минимальной способностью проникать через гематоэнцефалический барьер, не влияет на продолжительность интервала QT и не взаимодействует с лекарственными препаратами, метаболизирующимися ферментами системы цитохрома Р–450, в т. ч. ингибиторами протонной помпы.
Сравнительная характеристика фармакологических свойств описанных выше прокинетиков представлена в таблице 3.
Применение антацидных средств как самостоятельных препаратов для лечения функциональной диспепсии малоэффективно, однако возможно их включение в состав комплексной терапии.
При отсутствии эффекта от проводимой терапии целесообразно назначение препаратов с анксиолитическим действием или антидепрессантов.
Моторика кишечника
Большую роль в том, насколько хорошо будут усваиваться пища и выводиться ненужные элементы из организма, играет моторика кишечника. Если она ослаблена, человек может столкнуться не только с запором, но и с другими неприятными симптомами, начиная от усталости и головной боли до сыпи на коже и повышенной температуры.
Чтобы этого не происходило, следует поддерживать в рабочем состоянии свой кишечник, так как ежедневная нагрузка на него высокая (современный человек ест сегодня немало). Ниже мы подробно рассказали про причины нарушения работы этого органа, а также дали список продуктов и упражнений для домашней гимнастики, которые призваны помочь и улучшить его моторику.
Физиология моторики кишечника
Итак, моторика кишечника – что это такое? Моторикой, или перистальтикой, желудочно-кишечного тракта (ЖКТ) называют процесс согласованных сокращений его гладкой мускулатуры, которая представлена совокупностью продольных и циркулярных мышечных волокон.
Данный процесс начинается с попадания кусочка пищи в рот. Пережевывание и глотание приводят к запуску работы пищеварительной системы, что включает и перистальтику ЖКТ. В момент попадания пищевого комка в кишку происходит растяжение ее гладких мышц, ответной реакцией на которое становится их сокращение. Слаженная работа мускулатуры кишечника приводит к тому, что его содержимое и пищеварительные соки смешиваются и перемещаются в нижние отделы ЖКТ для окончательной переработки с последующим выведением из организма тех остатков, которые не переварились.
Перистальтика дополняется ритмической сегментацией, тоническими сокращениями мышц, маятникообразными и пропульсивными движениями кишечника, которые в совокупности и называют моторикой.
Человек не управляет моторикой кишечника, процесс происходит рефлекторно. Сила и частота сокращений мускулатуры кишечника зависят от вегетативной нервной системы, регулирующей работу внутренних органов. Ее парасимпатическая часть воздействует на перистальтику, которая вследствие этого усиливается, а сигналы от симпатической нервной системы приводят к тому, что моторная активность ЖКТ слабеет.

Физиология моторики кишечника
Для прохождения полного процесса пищеварения в норме требуется 1-3 суток, при этом наибольшее время отводится продвижению пищевых масс в толстой кишке.
Только спустя двух-трехчасовой период пища попадет в тонкий кишечник. То есть около суток требуется на наполнение толстой кишки и удаление непереваренных остатков пищи наружу. Если перистальтика нарушена, то данный процесс замедляется или ускоряется, то есть это либо плохая, либо усиленная моторика кишечника.
Симптомы нарушения моторики кишечника
Не только очевидные неприятные явления могут свидетельствовать о заболеваниях пищеварительного тракта и о том, что нарушена моторика кишечника. Симптомы существования болезни могут иметь разные проявления:
Синдром нарушения моторики верхних отделов пищеварительного тракта в практике терапевта: диагностика и лечение
Авторы: Н.И. Швец, зав. кафедрой терапии, д.м.н., профессор; Т.М. Бенца, к.м.н., доцент кафедры терапии. Национальная медицинская академия последипломного образования им. П.Л. Шупика, г. Киев
Версия для печати
Двигательная функция пищеварительного тракта — важный компонент пищеварительного процесса, обеспечивающий захват пищи, ее механическую обработку (измельчение, перемешивание) и продвижение вдоль по пищеварительному тракту в строгом соответствии с периодами химической переработки пищевых продуктов в его отделах. Жевание, акт глотания и перемещение пищевого комка в верхнем отделе пищевода осуществляются при участии поперечно-полосатой мускулатуры. В остальных отделах пищеварительного тракта двигательная деятельность выполняется гладкой мускулатурой. Сокращения гладких мышц стенки желудка осуществляют моторную функцию органа. Она обеспечивает депонирование в желудке принятой пищи, перемешивание ее с желудочным соком в зоне, примыкающей к слизистой оболочке желудка, передвижение желудочного содержимого к выходу в кишечник и, наконец, порционную эвакуацию желудочного содержимого в двенадцатиперстную кишку. Резервуарная, или депонирующая, функция желудка совмещена собственно с пищеварительной и осуществляется в основном в теле и дне желудка, в эвакуаторной функции особенно велика роль привратниковой части.
Для мышц желудка характерны тонические и периодические, фазные сокращения. Тонические сокращения обеспечивают хорошее соприкосновение химуса с его стенками, а периодические сокращения способствуют перемешиванию (тонические волны и перистальтика желудка, маятникообразные сокращения и ритмическая сегментация кишечника) и продвижению содержимого по пищеварительному тракту. Переход содержимого из желудка в двенадцатиперстную кишку определяется также состоянием пилорического сфинктера.
Регуляция моторной функции пищеварительного тракта осуществляется нейрогуморальными механизмами. Активация блуждающего нерва усиливает перистальтику пищевода, моторную активность желудка, а симпатические волокна оказывают противоположный эффект. Большое значение в регуляции моторики желудка имеет внутриорганный отдел вегетативной нервной системы (ауэрбаховское сплетение) за счет местных периферических рефлексов. К возбуждающим рефлексам относятся пищеводно-кишечный, желудочно-кишечный. Возбуждающим действием на сократительную активность гладкой мускулатуры желудка обладают гастрин, гистамин, серотонин, мотилин, инсулин, ионы калия.
Торможение моторики желудка вызывают энтерогастрон, адреналин, норадреналин, секретин, глюкагон, холецистокинин-панкреозимин, вазоактивный интестинальный пептид, бульбогастрон. Механическое раздражение кишечника пищевыми веществами приводит к рефлекторному торможению двигательной активности желудка (энтерогастральный рефлекс). Особенно выражен этот рефлекс при поступлении в двенадцатиперстную кишку жира и соляной кислоты.
Нарушение моторики может выступать ведущим патогенетическим фактором, способствующим развитию многих распространенных заболеваний пищеварительного тракта. К группе заболеваний с первичным нарушением моторной функции верхних отделов пищеварительного тракта относятся: гастроэзофагеальная рефлюксная болезнь (ГЭРБ), различные дискинезии пищевода (диффузный и сегментарный эзофагоспазм, кардиоспазм), функциональная диспепсия.
Кроме заболеваний с первичными нарушениями, выделяют так называемые вторичные нарушения моторики пищеварительного тракта, которые возникают на фоне течения других заболеваний и с которыми нередко сталкиваются в своей практике врачи-терапевты. К этим нарушениям, в частности, относятся:
— нарушения моторики желудка и кишечника, возникающие у больных сахарным диабетом (вследствие диабетической нейропатии, которая приводит к нарушению функции вегетативной нервной системы);
— постваготомические расстройства (пересечение ствола блуждающего нерва обычно повышает тонус проксимальных отделов желудка и одновременно снижает фазную активность дистальных отделов; следствием этого являются ускоренная эвакуация жидкости и замедленная эвакуация твердой пищи из желудка);
— расстройства двигательной функции пищеварительного тракта у больных системной склеродермией в результате разрастания соединительной ткани в стенке пищевода, желудка и кишечника;
— первичное повреждение мускулатуры желудка — наблюдается при полимиозите и дерматомиозите;
— нарушения моторики пищеварительного тракта при некоторых эндо-кринных заболеваниях (тиреотоксикоз, гипотиреоз) и др.
Основные причины задержки опорожнения желудка:
— функциональная диспепсия (дисмоторный вариант);
— кислотозависимые заболевания (пептические язвы, ГЭРБ);
— гастриты (атрофический гастрит, антральный гастрит типа В);
— острые вирусные гастроэнтериты;
— механические причины (рак желудка, препилорические, пилорические, дуоденальные язвы, идиопатический гипертрофический стеноз);
— метаболические и эндокринные расстройства (диабетический гастропарез, гипотиреоз, уремия, гиперкалиемия, гиперкальциемия);
— последствия оперативного лечения заболеваний желудка; — неврологические расстройства (болезни ЦНС, спинного мозга, болезнь Паркинсона);
— лекарства (антихолинергические, опиаты, L-допа, трициклические антидепрессанты, соматостатин, холецистокинин, гидроокись алюминия, прогестерон), высокие дозы алкоголя, никотин;
— псевдообструкция (хроническая, вторичная при амилоидозе, дерматомиозите);
— системная склеродермия;
— идиопатические (желудочная дисритмия, десинхроноз);
— тяжелая физическая нагрузка.
Основные причины ускорения опорожнения желудка:
— синдром Золлингера — Эллисона;
— последствия оперативного лечения заболеваний желудка (демпинг-синдром, ваготомия + пилоропластика (антрумэктомия));
— лекарства (эритромицин, цизаприд, метоклопрамид, домперидон, бета-адреноблокаторы);
— легкие физические упражнения.
Клинические проявления при замедленном опорожнении желудка:
— чувство тяжести и переполнения в эпигастрии после еды;
— эпигастральная боль ± изжога;
— тошнота и рвота;
— чувство быстрого насыщения;
— сонливость после еды;
— отрыжка и регургитация;
— потеря веса.
Клинические проявления при ускоренном опорожнении желудка:
— эпигастральная боль;
— тошнота;
— спазматические боли в животе;
— диарея;
— симптомы гипогликемии;
— симптомы гиповолемии.
ГЭРБ — заболевание, связанное с нарушением двигательной функции верхних отделов пищеварительного тракта, патологическим забросом (рефлюксом) содержимого желудка в пищевод.
Основные нарушения двигательной функции, которые имеют важное значение в патологической физиологии ГЭРБ:
— снижение тонуса нижнего пищеводного сфинктера (НПС) и преходящие его расслабления;
— ослабление клиренса пищевода (способности пищевода удалять обратно в желудок попавшее в него содержимое);
— замедление опорожнения желудка.
Клинические проявления ГЭРБ:
— изжога;
— отрыжка кислым;
— боль (жжение) в эпигастральной области.
Они чаще возникают после еды, при наклоне туловища вперед или в горизонтальном положении, купируются или уменьшаются после приема соды или антацидных препаратов.
Реже наблюдаются дисфагия и одинофагия.
Внепищеводные проявления ГЭРБ наблюдаются часто и интенсивно изучаются:
1) стоматологические проявления (кариес, периодонтит, слюнотечение, халитоз);
2) орофарингеальные проявления (назофарингит, фарингит, ощущение кома в горле);
3) отоларингологические проявления (ларингит и другие поражения гортани, оталгии, отит, ринит);
4) бронхолегочные проявления (хронический рецидивирующий бронхит, бронхоэктазы, аспирационные пневмонии, кровохарканье, пароксизмальный кашель, бронхиальная астма);
5) боль в грудной клетке:
а) связана с нарушением сердечной деятельности (рефлюкс снижает коронарный кровоток, провоцирует приступы стенокардии и нарушения ритма сердца);
б) связана непосредственно с воздействием рефлюктата на пищевод;
6) желудочные проявления (ведущий патогенетический фактор — повышенное внутрижелудочное давление, в клинической картине преобладают жалобы со стороны желудка).
Ахалазия кардиальной части пищевода — хроническое нервно-мышечное заболевание, развитие которого связано с поражением интрамурального нервного сплетения пищевода, в результате чего нарушается последовательная перистальтическая активность стенки пищевода и отсутствует расслабление нижнего пищеводного сфинктера в ответ на глоток (сглатывание). Наиболее вероятно, что это связано с дефицитом ингибирующих медиаторов, в первую очередь оксида азота (NO). Вследствие этого на пути пищевого комка появляется препятствие в виде нерасслабившегося сфинктера и поступление пищи в желудок происходит лишь при дополнительном наполнении пищевода жидкостью, когда вес ее столба оказывает на нижний пищеводный сфинктер механическое воздействие.
Клинические симптомы ахалазии кардиальной части пищевода:
— дисфагия;
— боль за грудиной;
— регургитация (отрыжка, срыгивание);
— пищеводная рвота;
— потеря массы тела;
— гиповитаминоз.
Симптомы появляются или усиливаются при нервно-эмоциональном напряжении. В некоторых случаях симптомы уменьшаются после принятия выпитой залпом жидкости.
Функциональная диспепсия (ФД) — комплекс функциональных расстройств, которые продолжаются более 3 месяцев на протяжении 12 месяцев и включают симптомы диспепсии (боль или дискомфорт строго в эпигастрии, связанные или не связанные с приемом пищи, чувство переполнения в эпигастрии после еды, раннее насыщение, тошноту, отрыжку, изжогу), не связанные с нарушением функции кишечника, при котором в процессе тщательного обследования пациента не удается выявить каких-либо других органических причин диспепсии (пептической язвы, рефлюкс-эзофагита, рака желудка). Одними из основных патофизиологических компонентов ФД, особенно ее дисмоторного варианта, являются нарушения моторики верхних отделов пищеварительного тракта. При этом изменяется миоэлектрическая активность (бради-, тахигастрия) сократительной способности (уменьшение количества перистальтических волн в антральном отделе желудка и снижение их амплитуды). По данным сцинтиграфии и ультрасонографии, это приводит к нарушению опорожнения желудка.
Диагностика
Современные методы оценки моторно-эвакуаторной функции пищевода
1. Рентгеноскопия — отмечается нарушение прохождения бариевой взвеси из пищевода в желудок, наличие натощак в пищеводе большого количества содержимого, расширение пищевода, газовый пузырь желудка не выявляется.
2. Эзофагоманометрия позволяет определить давление нижнего пищеводного сфинктера, выявить отсутствие расслабления его во время глотания (при ГЭРБ).
3 Интраэзофагеальный рН-мониторинг (традиционный зондовый метод или беззондовая система регистрации рН с помощью радиокапсулы «Bravo») — при ГЭРБ с целью определения общего времени, в течение которого уровень рН опускается ниже 4, числа рефлюксов в сутки, длительности наиболее продолжительного рефлюкса.
Современные методы оценки моторно-эвакуаторной функции желудка
1. Рентгенологический (оценивается только время начальной и конечной эвакуации, невозможность повторных многократных исследований, низкая точность (барий не является «пищевым продуктом»)).
2. Ультразвуковой метод (определяется скорость опорожнения желудка, однако в основном определяется эвакуация жидкой пищи, метод непригоден для больных после операций на желудке, зависит от опыта оператора).
3. Эпигастральный импеданс (на результаты четко влияет расположение электродов, непригоден для больных после операций на желудке, гиперсекреция кислоты или дуоденогастральный рефлюкс дают погрешности при измерении).
4. Сцинтиграфия желудка с 99Tc или 111In (после приема больным пищи, меченной радиоактивными изотопами, регистрация показателей датчика позволяет сделать вывод о скорости эвакуации пищи из желудка. Не позволяет дать количественную оценку транспилорического поступления пищи, лучевая нагрузка на пациента, затруднен процесс приготовления пищевой смеси для тестирования).
5. Видеоэндоскопическая капсула (исследование гастродуоденальной моторики).
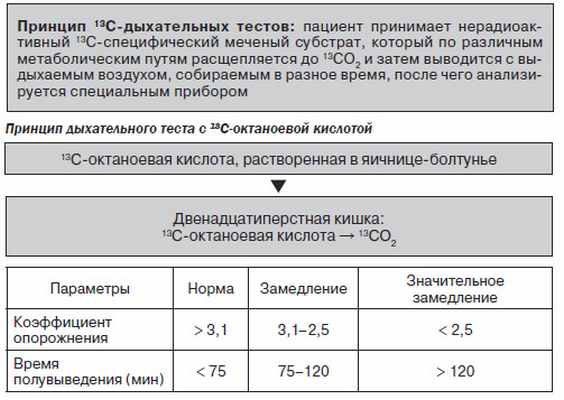
6. Дыхательный тест с 13С-октаноевой кислотой.
13С-дыхательные тесты для исследования моторно-эвакуаторной функции желудка
1. 13С-бикарбонатный дыхательный тест — для исследования эвакуации жидкой и полужидкой пищи из желудка.
2. 13С-ацетатный дыхательный тест — для исследования эвакуации жидкой пищи из желудка.
3. 13С2-глициновый дыхательный тест — для исследования эвакуации пищи из желудка, а также для изучения метаболизма некоторых аминокислот и белков.
4. 13С-октаноевый дыхательный тест — для исследования скорости эвакуации твердой пищи из желудка. Позволяет определить степень нарушения моторно-эвакуаторной функции желудка, осуществить подбор дозы (разовой, суточной и курсовой) прокинетиков, контроль эффективности лечения.
Лечение
Диета с ограничением продуктов, расслабляющих нижний пищеводный сфинктер (томаты, кофе, крепкий чай, шоколад, животные жиры, мята), оказывающих раздражающее действие (лук, чеснок, приправы), газообразующих (горох, фасоль, шампанское, пиво). Необходимо исключить употребление алкоголя, очень острой, горячей или холодной пищи и газированных напитков. Пациенты должны избегать переедания, пищу принимать регулярно, не должны есть за 2–3 часа до сна.
Пациентам с ГЭРБ рекомендуется ввести в свой рацион продукты с высоким содержанием белка: нежирное молоко, сыр, творог, отварное мясо. Дело в том, что белковая пища обладает буферными свойствами, то есть способна связывать кислоту, в результате чего повышается рН желудочного содержимого и увеличивается давление в области нижнего пищеводного сфинктера. То есть уменьшается как агрессивность рефлюксата, так и вероятность самого рефлюкса.
Лекарственные средства, влияющие на тонус и моторику
Блокаторы М-холинорецепторов:
— атропина сульфат — 0,1–0,6 мг в/м;
— скополамина бутилбромид (бускопан, бускоцин, спазмобрю) — 10–20 мг 3–5 раз в сут. внутрь (или ректально);
— метацин — 2–4 мг 2–3 раза в сут. (в табл.) или в/м 1 мг 2–3 раза в сут.
Неселективные миотропные спазмолитики:
— дротаверина гидрохлорид — 40–80 мг внутрь или в/м 2–4 мл 1–3 раза в сут.;
— папаверин — 40–60 мг 3–5 раз в сут. в/м.
Прокинетики — препараты, способные корригировать нарушения моторики пищеварительного тракта: усиливают сократительную способность пищевода, повышают тонус нижнепищеводного сфинктера и двигательную активность желудка, нормализуют соотношение фаз мигрирующего моторного комплекса, улучшают координацию работы желудка и двенадцатиперстной кишки. Подобные фармакологические свойства способствуют их широкому использованию и в качестве курсового лечения, и в виде симптоматической терапии по требованию. При нарушениях моторики верхних отделов пищеварительного тракта применяются прокинетики — блокаторы допаминовых рецепторов:
— неселективные — метоклопрамид;
— селективные I поколения — домперидон;
— селективные II поколения — итоприд.
Прокинетики — препараты выбора для лечения дисмоторного варианта ФД. Проводится монотерапия:
— домперидоном — 10–20 мг 3 раза в сут. за 15–30 мин до еды на протяжении 2–4 недель или
— метоклопрамидом — 10 мг 3 раза в день на протяжении 2 недель.
Препаратами первой линии для лечения ГЭРБ являются ингибиторы протонной помпы (ИПП). После достижения ремиссии необходима поддерживающая терапия с применением ИПП либо блокаторов Н2-рецепторов гистамина.
— ИПП: омепразол 20–40 мг, или ланзопразол 30 мг, или рабепразол 20 мг, или пантопразол 40 мг, или эзомепразол 20–40 мг 1–2 раза в день внутрь 14–30 дней.
— Блокаторы Н2-рецепторов гистамина: наиболее мощный по выраженности антисекреторного эффекта — фамотидин 20 мг 1–2 раза в сутки в течение 8–12 недель до нормализации эндоскопической картины с последующим применением поддерживающих доз — 10 мг в течение 2–3 мес., что позволяет избежать рецидива ГЭРБ.
— Стимуляторы перистальтики (прокинетики): домперидон или мето-клопрамид 10 мг 3–4 раза в день за 10–15 мин до еды и перед сном на протяжении 14–30 дней; итоприд 50 мг 3 раза в день за 15–30 мин до еды 14–21 день.
— Антациды по требованию: алюминия фосфат (фосфалюгель), алюминия гидроксид с магния гидроксидом (алмагель, маалокс) по 1 дозе ( 20 г геля, или 1–2 таблетки, или 15 мл суспензии) 3–4 раза в день через 1–1,5 часа после еды и на ночь не более 14 дней.
Лечение ахалазии кардиальной части пищевода
1. Антациды (алюминия гидроксид и/или магния гидроксид внутрь по 1 дозе за 30 мин до еды) — по требованию (при возникновении боли).
2. Обволакивающие средства (висмута субнитрат 0,5 г за 30 мин до еды, развести в 30 мл воды) — по требованию.
Таким образом, нарушения моторной функции верхних отделов пищеварительного тракта выступают важным патогенетическим фактором многих распространенных заболеваний пищеварительного тракта и часто определяют их клиническую картину. Своевременное выявление двигательных нарушений с помощью современных методов диагностики и применение адекватных препаратов, нормализующих моторику, позволяют значительно улучшить состояние больных.
1. Гастроентерологія / Під ред. Н.В. Харченко, О.Я. Бабака. — К.: Друкар, 2007. — 720 с.
2. Гастроэнтерология и гепатология: диагностика и лечение: Рук-во для врачей / Под ред. А.В. Калинина, А.И. Хазанова. — М.: Миклош, 2007. — 602 с.
3. Основы внутренней медицины: Учеб. для студентов высш. мед. учеб. заведений IV уровней аккредитации, врачей-интернов, врачей общей практики / В.Г. Передерий, С.М. Ткач. — Вінниця: Нова кн., 2009. — Т. 1: Заболевания органов дыхания. Заболевания органов пищеварения. Заболевания системы крови и кроветворных органов. Заболевания эндокринной системы — 780 с.
4. Передерий В.Г., Ткач С.М., Марусанич Б.Н., Чернов А.Ю. Диспепсия как самостоятельный диагноз и неспецифический синдром. — Луганск: ОАО «ЛОТ», 2006. — 340 с.
5. Рациональная диагностика и фармакотерапия заболеваний органов пищеварения / Под ред. О.Я. Бабак, Н.В. Харченко. — 2-е изд. — К.: ТОВ «Доктор-Медиа», 2007. — 308 с.
6. Дорофеев А.Э., Березов В.М., Руденко Н.Н. и др. Синдромная диагностика в гастроэнтерологии (учебное пособие) / Под. ред. проф. А . Э . Дорофеева . — Донецк : Вебер , 2008. — 263 с .
8. De Caestecker J. Prokinetics and reflux: a promise unfulfilled // Eur. J. Gastroenterol. Hepatol. — 2002. — 14 (1). — 5-7.
9. DeVault K.R., Castell D.O. Updated Guidelines for the Diagnosis and Treatment of Gastroesophageal Reflux Disease // Am. J. Gastroenterol. — 2005. — 100. — 190-200.
10. Shenoy K.T., Veenasree, Leena K.B. Efficacy and tolerability of itopride hydrochloride in patients with non-ulcer dyspepsia // J. Indian. Med. Assoc. — 2003. — 101 (6). — 387-388.
Читайте также:
