Ретикулярная формация. Глутамат, ГАМК, глицин, ацетилхолин
Обновлено: 27.04.2024
Так было совершенно определенно показано, что приступы нарколепсии со всеми присущими им проявлениями есть, по сути, не что иное, как “пароксизмы”, т.е. внезапные неадекватные включения нейронного центра парадоксального сна во время бодрствования. Иначе говоря, в нашем мозгу есть тормозной механизм, который не позволяет нам во время бодрствования разом “отключаться” от внешнего мира и видеть сны. Поломка этого механизма по каким-то причинам и приводит к нарколептическим приступам… Однако в чем именно она заключается - оставалось неизвестным.
Со времен Желино патологоанатомы искали изменения в головном мозгу нарколептиков, которые можно было бы связать с развитием этого заболевания. Однако столетние усилия оставались тщетными. В последние 20 лет американские исследователи (Билл Демент, Кристиан Гийемино и Эммануэль Миньё) и французские специалисты из лаборатории Демента в Лос-Анджелесе, а также группа Томаса Килдаффа в Стенфордском университете (Сан-Диего) обнаружили повышенное содержание основных нейропередатчиков и их рецепторов в различных отделах головного мозга у собак-нарколептиков. Наконец, в начале 90-х годов подобные же биохимические и морфологические изменения нашли и в мозге больных людей при посмертном вскрытии…
Рецепторные белки представляют собой “молекулярные замочки”, расположенные на клеточной поверхности. А ключи к этим замочкам - нейропередатчики (медиаторы), называемые лигандами. Если ключ подходит (т.е. происходит лиганд-рецепторное взаимодействие), то либо резко меняется состояние клеточной мембраны - открываются одни и закрываются другие каналы, регулирующие потоки ионов (Na + , K ++ , Ca ++ , Cl - ) внутрь и наружу клетки, либо изменяется состояние ее генетического аппарата - усиливается или ослабевает синтез какого-то специфического белка. Соответственно меняется способность нейрона отвечать на сигналы, поступающие от других клеток: они посылают свои импульсы третьим клеткам.
Служат ли выявленные изменения причиной или следствием заболевания? Невозможно было ответить на эти вопросы, пока в нейробиологии не произошла революция, связанная с появлением молекулярно-генетических методов. После публикации частично раскрытого генома собаки Миньё и его сотрудники сумели найти в одной из хромосом мутацию, предположительно ответственную за нарколепсию [2]. Однако и это еще не раскрывало ее механизм. Разгадка, как всегда, пришла неожиданно и стала последней сенсацией в ряду выдающихся открытий нейробиологии XX в.
В 1998 г. большая группа авторов, первые среди которых Луис Делиси и уже упоминавшийся Том Килдафф, опубликовала статью о присутствии в гипоталамусе матричной РНК (мРНК), кодирующей белок, содержащий два сходных пептида с неизвестными ранее аминокислотными последовательностями [3]. Их назвали гипокретинами ( ГИПО таламическими се КРЕТИНАМИ ), так как поначалу приняли за представителей группы кишечных гормонов секретинов (в дальнейшем это сходство опровергли). Одновременно группа японских исследователей из Техасского университета, занимавшаяся поиском лигандов к “сиротским” рецепторам (т.е. “подбором ключей к найденным замкам”), нашла в гипоталамусе два близких по строению пептида и назвала их орексинами А и Б (от греч. orex - аппетит). Оказалось, что гипокретины 1 и 2 и орексины А и Б - одни и те же вещества. Были обнаружены два рецептора к орексинам/гипокретинам и кодирующие их гены. Рецептор 1-го типа связывается избирательно с орексином-А, а 2-го - с обоими пептидами. Вначале считали, что эти пептиды играют важную роль в регуляции пищевого поведения, так как тела нейронов, аксоны которых выделяют орексин/гипокретин, располагаются в глубине головного мозга, вблизи так называемого “пищевого центра”. Там находятся клетки, участвующие в регуляции голода и насыщения. Однако сейчас эта роль поставлена под сомнение [4].
Орексины-гипокретины представляют собой олигопептиды; в орексине А - 33 аминокислотных остатка, а в орексине Б - 28. У первого (А) свернутая (петлеобразная) пространственная структура, которая удерживается дисульфидными мостиками. Второй (Б) имеет линейную структуру. Оба пептида образуются в организме в результате расщепления одного белка-предшественника, пре-прогипокретина. Подобно аминергическим нейронам (например, клеткам синего пятна), орексинергические нейроны весьма немногочисленны (в полутораграммовом мозге крысы их всего 1700, а в тысячу раз большем по весу мозге человека - около 80 тыс.). Однако их длинные отростки - аксоны - сильно ветвятся, иннервируя множество клеток в самых разных отделах мозга, выделяющих все основные медиаторы: ацетилхолин, глутамат, ГАМК, мозговые амины… Интересно, что с ГАМК-ергическими нейронами “центра медленного сна” в вентролатеральном преоптическом ядре, расположенном в непосредственной близости от орексиновых нейронов латерального и вентро-медиального гипоталамуса, орексиновые нейроны оказались совсем не связаны [5]!
В большинстве нейронов орексин присутствует вместе с другим пептидом - динорфином . Во всех орексиновых клетках гипоталамуса имеется особый секретируемый нейрональный белок NARP (“пентраксин, регулирующий нейронную активность”). Он связан с регуляцией синапсов и кодируется одним из “немедленных ранних генов”, которые быстро экспрессируются (активируются) в нейронах при повышении их метаболической активности. В числе прочих орексинергические нейроны проецируются и на норадренергические клетки синего пятна, вызывая их деполяризацию - активацию, “подбуживание”. При недостаточной активации нейроны синего пятна могут внезапно “замолкать” не только во время парадоксального сна (как им положено), но и при бодрствовании, вызывая приступы нарколепсии [6].
Миньё и его команда обнаружили, что у собак из-за мутации гена, кодирующего один из двух рецепторов орексина, молекула белка NARP теряет способность связываться с своим лигандом. В это же время группа исследователей из Медицинского института Говарда Хьюза при Техасском университете в Далласе, используя опубликованную карту генома мышей, сумела вывести линию, у которой с рецепторами орексина было все в порядке, но сам лиганд - орексин - не выделялся. Эти искусственно выведенные мыши также послужили моделью нарколепсии - у них отмечались сходные явления.
Хотя проявления нарколепсии у человека и у собаки в целом почти тождественны, в отношении сходства их механизмов возникли серьезные сомнения. Достаточно сказать, что “собачья нарколепсия” - чисто генетическое заболевание, а человеческая - отнюдь нет! Она не передается по наследству, ее нельзя назвать семейным или родственным заболеванием. Если один из однояйцовых близнецов страдает нарколепсией, то у второго подобная болезнь наблюдается лишь в 25% случаев! Значит, у человека, в отличие от собаки, наследственность лишь определяет некоторую предрасположенность к болезни, но вовсе ее не гарантирует [7]. Следовательно, имеется еще какой-то ключевой фактор, не связанный с генетическими явлениями, разрушающий орексиновую систему у человека и таким образом имитирующий вышеописанные мутации у животных.
Посмертное изучение мозга нарколептиков с помощью новейших иммуногистохимических методов антигенного восстановления, проведенное в лаборатории известного сомнолога Джерома Зигеля из Лос-Анджелеса, выявило катастрофическую потерю 90% орексинергических нейронов и их аксонов, особенно в тех областях, где наблюдалась высокая насыщенность рецепторов 2-го типа. Анализ крови нарколептиков также показал, что концентрация орексина у них ниже уровня чувствительности метода (0,5 пг/мл), тогда как у здоровых людей в бодрствовании она составляет 50 пг/мл. Стало ясно, что, в отличие от экспериментальной нарколепсии у собак, вызываемой определенной точечной мутацией гена рецептора орексина 2-го типа, у человека нарколепсия - аутоиммунное заболевание [8]. Но какое вещество служит тем антигеном, против которого “восстает” иммунная система мозга человека, попутно поражая орексиновые клетки - остается неизвестным. Однако эта задача уже не нейрофизиологии, нейрохимии и нейроанатомии, а нейроиммунологии. Представители первых трех наук в ближайшие годы, видимо, продолжат изучение орексиновой системы “по вертикали и горизонтали”, т.е. ее формирование в ходе онтогенеза (индивидуального развития) и сравнительное ее изучение у животных, стоящих на разных уровнях развития, для реконструкции возможного хода эволюции этой системы мозга.
Открытие орексиновой системы - крупнейшее достижение нейробиологии, которым она завершила XX век, столь богатый для нее революционными успехами. Природа нарколепсии, болезни, остававшейся загадкой на протяжении 120 лет, было раскрыта всего за 2.5 года, продемонстрировав всю мощь и гибкость современной науки. Эта история еще раз (уже в который!) доказывает, что самые, казалось бы, далекие от практических задач работы в фундаментальной науке способствуют значительным достижениям в медицине: раскрытию истинных причин тяжелых заболеваний, новым методам диагностики и лечения, принципиально новым лекарственным средствам. И наоборот, “экономия” на фундаментальных исследованиях, которые кажутся невеждам слишком “абстрактными”, приводит к полному прекращению всякого прогресса в прикладных исследованиях, к их полной остановке “в бессильи умственного тупика”…
1. Ковальзон В.М. Природа сна // Природа. 1999. №8. С.172-179.
2. Mignot E. // Sleep Medicine. 2000. V.1. №1. P.87-90.
3. Kilduff T.S., Peyron C. //TINS. 2000. V.23. №8. P.359-365.
4. John J. et al. // Neuron. 2004. V.42. №5. P.619-634.
5. Scammel T.E. // Current Biology. 2001. V.11. P.R769-R771.
6. Ferguson A.V., Samson W.K . // Frontiers in Neuroendocrinology. 2003. V.24. №1. P.141-150.
7. Siegel J.M. // Annual Review of Psychology. 2004. V.55. №2. P.125-148.
8. Siegel J.M. et al. // Neuropsychopharmacology. 2001. V.25. №S5. P.S14-S20.
Ретикулярная формация. Глутамат, ГАМК, глицин, ацетилхолин
Ретикулярная формация. Глутамат, ГАМК, глицин, ацетилхолин
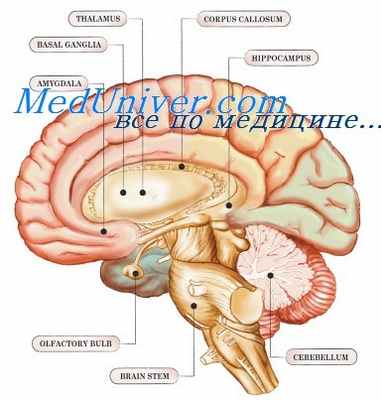
Ретикулярная формация имеет неспецифическую сигнальную функцию приведения в готовность и вносит вклад в моторную, сенсорную (болевую) и автономную функции.
Ретикулярная формация — сеть нейронов с разбросанными дендритными связями, которая занимает середину ствола мозга и простирается вверх от субстанции интермедиа до спинного мозга к интраламинарным ядрам таламуса. Она свободно организована в три продольных ядерных столба (медиальный, средний и латеральный), каждый из которых подразделяется на три вентрокаудальных (мезенцефальный, варолиевый и медуллярный).
Ретикулярная формация имеет вход от восходящих сенсорных нейронов, мозжечка, базальных ядер, гипоталамуса и коры мозга и выходы к гипоталамусу, таламусу и спинному мозгу.
Неспецифическая функция ретикулярной формации приведения в готовность может быть связана с восходящими ретикулоталамокортикальными путями (восходящая ретикулярная активирующая система). Ретикулярная формация также вносит вклад в моторную, сенсорную (болевую) и автономную функции, особенно действуя на дыхание и вазомоторную функцию.
Глутамат — главный возбуждающий нейромедиатор в ЦНС. Глутамат — аминокислота, действующая на NMDA-рецепторы и He-NMDA-рецепторы. Это первичный нейромедиатор в таламокортикальной, пирамидальной клетке, кортикостриарных путях и важный нейромедиатор в гипоталамусе. Когда обнаружили, что некоторые лекарства, воздействующие на NMDA-рецепторы, вызывают психические симптомы, было высказано предположение, что в основе психических заболеваний могут лежать нарушения глутаматной системы.
ГАМК — главный тормозной нейромедиатор в ЦНС. ГАМК — аминокислота, действующая прежде всего на ГАМКд- и ГАМКв-рецепторы. ГАМКд-рецепторы присутствуют на 40% нейронов. Сl-канал зависит от ГАМКа-рецептора, в то время как ГАМКв-рецепторы соединены с G-белками.
Бензодиазепины и большинство антиконвульсантов действуют через ГАМК-рецепторы:
• бензодиазепины связываются с определенными бензодиазепиновыми рецепторами, расположенными на соответствующем участке ГАМК-рецепторного комплекса, что увеличивает эффекты ГАМК;
• некоторые антиконвульсанты имеют схожие эффекты с бензодиазепинами, но большинство действуют непосредственно на ГАМК-рецептор.
С нарушениями ГАМК-системы, как полагают, могут быть связаны невротические расстройства. По результатам недавних исследований было высказано предположение о роли ГАМК в этиологии шизофрении.
Глицин — необходимый нейромедиатор для действия глутамата. Глицин необходим для реализации эффектов глутамата. Кроме того, глицин действует на собственные рецепторы, связанные с Сl--каналом и ингибирующие нервные функции.
Ацетилхолин — главный периферический нейромедиатор. АХ действует как нейромедиатор в ЦНС так же, как и на периферии.
Центральное первичное АХ-содержащее ядро — базальное ядро, которое расположено в переднем мозге и идет к коре головного мозга и лимбической системе. Холинергические волокна в ретикулярной системе поступают к коре головного мозга, лимбической системе, гипоталамусу и таламусу.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Медиаторы
Медиаторы (от лат. mediator — посредник; синонимы — нейромедиаторы, нейротрансмиттеры) — биологически активные вещества, секретируемые нервными окончаниями и обусловливающие передачу нервных импульсов в синапсах. В качестве медиаторов могут выступать самые различные вещества. Всего насчитывается около 30 видов медиаторов, однако лишь семь из них (ацетилхолин, норадреналин, дофамин, серотонин, гамма-аминомасляную кислоту, глицин и глутаминовую кислоту) принято относить к «классическим» медиаторам. Вещество, из которого синтезируется медиатор, попадает в нейрон или его окончание из крови или ликвора, в результате биохимических реакций под действием ферментов превращается в соответствующий медиатор, затем транспортируется в соответствующие везикулы. Медиаторы также синтезируются в пресинаптических окончаниях.
В зависимости от их функции нейромедиаторы можно разделить:
- • на возбуждающие: этот тип нейромедиаторов оказывает возбуждающее воздействие на нейрон. Они увеличивают вероятность того, что нейрон будет генерировать потенциал действия. К основным возбуждающим нейротрансмиттерам причисляют адреналин и норадреналин;
- • ингибирующие: эти нейротрансмиттеры оказывают тормозящее действие на нейрон; они уменьшают вероятность того, что будет выработан потенциал действия. К основным тормозным нейромедиаторам относятся серотонин и гамма-аминомасляная кислота (ГАМК).
По химическому строению медиаторы можно разделить на несколько групп, главными из которых являются амины, аминокислоты, полипептиды.
Ацетипхопин — достаточно распространенный медиатор, уксуснокислый эфир холина. Ацетилхолин — медиатор а-мотонейронов спинного мозга, ствола мозга, нейронов коры, ретикулярной формации, нейронов сетчатки. Он известен, в основном, как возбуждающий медиатор. В ретикулярной формации ствола мозга, в гипоталамусе обнаружены М- и Н-холинорецепторы. Ацетилхолин активирует как возбуждающие, так и тормозные нейроны. Тормозное влияние ацетилхолин оказывает с помощью М-холинорецепторов в глубоких слоях коры больших полушарий, стволе мозга, хвостатом ядре.
- • Амины (норадреналин, дофамин, серотонин, гистамин) в значительных количествах содержатся в нейронах ствола мозга, в меньших количествах выявляются в других отделах ЦНС.
- • Дофамин — медиатор черной субстанции, покрышки мозга, гипоталамуса, симпатических ганглиев и сетчатки.
- • Норадреналин — медиатор голубого пятна ствола мозга, ганглионарных нейронов симпатической нервной системы.
- • Серотонин — медиатор серотонинэргических нейронов, расположенных в ядрах шва ствола мозга и сетчатке.
- • Гистамин — медиатор нейронов сосцевидных телец гипоталамуса.
- • Амины обеспечивают возникновение процессов возбуждения и торможения.
Аминокислоты. Кислые аминокислоты (глицин, гамма-аминомасляная кислота) являются тормозными медиаторами в синапсах ЦНС.
- • Глицин — медиатор тормозных нейронов, расположенных в спинном мозге и сетчатке.
- • Гамма-аминомасляная кислота (ГАМК) — медиатор тормозных нейронов коры мозга, мозжечка, ствола мозга, сетчатки.
Нейтральные аминокислоты (альфа-глутамат, альфа-аспартат) передают возбуждающие влияния.
Глутамат — медиатор возбуждающих нейронов, расположенных в различных отделах коры больших полушарий, таламусе, базальных ганглиях, мозжечке, гипоталамусе, стволе мозга, спинном мозге и сетчатке.
Полипептиды также выполняют медиаторную функцию в ЦНС. Эта группа нейроактивных веществ, присутствующих в ЦНС в большом количестве, выделена сравнительно недавно. Так, субстанция Р является медиатором нейронов, передающих сигналы боли. Особенно много этого полипептида содержится в дорсальных корешках спинного мозга. Энкефалины и эндорфины — медиаторы нейронов, блокирующих болевую импульсацию. Они реализуют свое влияние посредством соответствующих опиатных рецепторов, которых особенно много в клетках лимбической системы, черной субстанции, ядрах промежуточного мозга.
Ангиотензин участвует в передаче информации о потребности организма в воде, люлиберин — в половой активности.
Нейромедиаторы, часть вторая: аденозин, ацетилхолин, глутамат и гамма-аминомасляная кислота
Первую часть рассказа о нейромедиаторах «Атлас» посвятил молодежным дофамину, норадреналину и серотонину. Во втором посте речь пойдет о менее известных медиаторах, которые выполняют важную невидимую работу: стимулируют и тормозят другие нейромедиаторы, помогают нам учиться и запоминать.

Ацетилхолин
Это первый нейромедиатор, который открыли ученые. Он отвечает за передачу импульсов двигательными нейронами — а значит, за все движения человека. В центральной нервной системе нейромедиатор берет на себя стабилизирующие функции: выводит мозг из состояния покоя, когда необходимо действовать, и наоборот, тормозит передачу импульсов, когда необходимо сосредоточиться. В этом ему помогают два типа рецепторов — ускоряющие никотиновые и тормозящие мускариновые.
Ацетилхолин играет важную роль в процессе обучения и формирования памяти. Для этого требуется как способность фокусировать внимание (и тормозить передачу отвлекающих импульсов), так и способность переключаться с одного предмета на другой (и ускорять реакцию). Активная работа мозга, например, при подготовке к экзамену или годовому отчету, приводит к повышению уровня ацетилхолина. Если мозг долгое время бездействует, специальный фермент ацетилхолинэстераза разрушает медиатор, и действие ацетилхолина слабеет. Идеальный для учебы, ацетилхолин будет плохим помощником в стрессовых ситуациях: это медиатор размышления, но не решительных действий.
Переизбыток ацетилхолина в организме вызывает спазм всех мышц, судороги и остановку дыхания — именно на такой эффект рассчитаны некоторые нервно-паралитические газы. Недостаток ацетилхолина приводит к развитию болезни Альцгеймера и других видов старческой деменции. В качестве поддерживающей терапии пациентам назначают препарат, блокирующий разрушение ацетилхолина — ингибитор ацетилхолинэстеразы.
Ген CHRNA3 кодирует никотиновый рецептор ацетилхолина, на который может воздействовать никотин. На первом этапе вещество действует на симпатическую систему организма, которая отвечает за спазм гладкой мускулатуры и сокращение сосудов. Поэтому у начинающих курильщиков сигареты вызывают скорее тошноту и бледность кожи, чем восторг. Но со временем никотин достигает клеток головного мозга и активизирует рецепторы ацетилхолина. Так как этим занимается и никотин, и ацетилхолин одновременно, мозг пытается скорректировать «двойную подачу», и через некоторое время нейроны головного мозга сокращают нормальное производство ацетилхолина. С этого момента никотин будет нужен курильщику по каждому поводу — с утра чтобы взбодриться, после совещания наоборот, чтобы успокоиться, после обеда — чтобы хоть немного подумать о вечном.
Полиморфизм гена CHRNA3 влияет на скорость формирования никотиновой зависимости и, как следствие, на риск развития рака лёгких, вызванного курением.

Аденозин
Все химические реакции в организме требуют затраты энергии. В качестве валюты в этом процессе используется молекула аденина с несколькими основаниями фосфорной кислоты. Сразу после «зарплаты» у вас на карточке окажется «триста рублей» — молекула аденозинтрифосфат с тремя остатками фосфорной кислоты. На каждую транзакцию уходит по сто рублей, соответственно, после первой «покупки» на счету останется всего двести рублей (аденозиндифосфат), после второй — сто рублей (аденозинмонофосфат), после третьей — ноль рублей.
Купюра в ноль рублей — и есть аденозин. Как нейромедиатор он отвечает за чувство усталости и засыпание. Во время сна купюрам в ноль-ноль рублей дорисовывают троечки, аденозин трансформируется в аденозинтрифосфат, и мы с новыми силами готовы вернуться к работе.
Есть способ обмануть «банковскую систему»: заблокировать рецепторы аденозина и уйти в кредит. Именно этим и занимается кофеин — позволяет игнорировать усталость и продолжать работать. При этом он не приносит настоящей энергии, а только дает тратить деньги, как если у вас всё ещё есть триста рублей. Как и за любой кредит, за перерасход приходится расплачиваться — большей усталостью, заторможенностью внимания, привыканием. Тем не менее, кофеиносодержащие кофе, чай и шоколад — самый популярный стимулятор в мире.
Всего известно четыре вида рецепторов аденозина, которые активируются и блокируются аденозином. Ген ADORA2A кодирует рецепторы аденозина второго типа, которые участвуют в активации противовоспалительных процессов, формировании иммунного ответа, регуляции боли и сна. От работы этого рецептора зависит скорость реакции организма на ранение и травму.

Глутамат
Глутаминовая кислота в форме глутамата — пищевая аминокислота, которая содержится в продуктах животного происхождения. Вкусовые рецепторы воспринимают глутамат как индикатор белковой пищи — а значит питательной и полезной — и оставляют заметку, что было вкусно, и надо повторить. В двадцатом веке японские ученые выяснили принцип восприятия этого вкуса (они назвали его «умами» — вкусный), и со временем глутамат натрия стал популярной пищевой добавкой. Именно благодаря ему иногда сложно устоять перед соблазном съесть лапшу доширак. Как пищевая добавка глутамат не влияет напрямую на работу нейронов, поэтому его «передозировка» в худшем случае обойдется головной болью.
Глутамат — это не только пищевая аминокислота, но и важный нейромедиатор, рецепторы которого есть у 40% нейронов головного мозга. Он не имеет собственной «смысловой нагрузки», а только ускоряет передачу сигнала другими рецепторами — дофаминовыми, норадреналиновыми, серотониновыми и т.д. Эта функция позволяет глутамату формировать синаптическую пластичность — способность синапсов регулировать свою активность в зависимости от реакции постсинаптических рецепторов. Этот механизм лежит в основе процесса обучения и работы памяти.
Снижение активности глутамата приводит к вялости и апатии. Переизбыток — к «перенапряжению» нервных клеток и даже их гибели, как если бы на электрическую сеть дали большую нагрузку, чем она способна выдержать. «Перегорание» нейронов — эксайтотоксичность — наблюдается после приступов эпилепсии и при нейродегенеративных заболеваниях.
Две группы генов кодируют белки-транспортеры глутамата. Гены группы EAAT отвечают за натрий-зависимые белки — те самые, которые участвуют в процессе запоминания. Мутации в генах этой группы повышают риск инсульта, болезни Альцгеймера, болезни Гентингтона, бокового амиотрофического склероза. Мутации в генах везикулярных белков-транспортеров группы VGLUT ассоциированы с риском шизофрении.

Гамма-аминомасляная кислота
У каждой инь есть свой ян, и у глутамата есть вечный его противник, с которым он тем не менее неразрывно связан. Речь идет о главном тормозном нейромедиаторе — гамма-аминомасляной кислоте (ГАМК или GABA). Так же как и глутамат, ГАМК не вносит новых цветов в палитру мозговой активности, а только регулирует активность других нейронов. Так же как и глутамат, ГАМК охватил сетью своих рецепторов около 40% нейронов головного мозга. И глутамат, и ГАМК синтезируются из глутаминовой кислоты и по существу являются продолжением друг друга.
Для описания эффекта ГАМК идеально подходит поговорка «тише едешь — дальше будешь»: тормозящий эффект медиатора позволяет лучше сосредоточиться. ГАМК снижает активность самых разных нейронов, в том числе связанных с чувством страха или тревоги и отвлекающих от основной задачи. Высокая концентрация ГАМК обеспечивает спокойствие и собранность. Снижение концентрации ГАМК и нарушение баланса в вечном сопротивлении с глутаматом приводит к синдрому дефицита внимания (СДВГ). Для повышения уровня ГАМК хорошо подходят прогулки, йога, медитации, для снижения — большинство стимуляторов.
У гамма-аминомасляной кислоты два типа рецепторов — быстрого реагирования GABA-A и более медленного действия GABA-B. Ген GABRG2 кодирует белок рецептора GABA-A, который резко снижает скорость передачи импульсов в головном мозге. Мутации в гене связаны с эпилепсией и фебрильными судорогами, которые могут возникать при высокой температуре.

Если дофамин, серотонин и норадреналин — голливудские актеры большой нейронной киноиндустрии, то герои второй части рассказа о нейромедиаторах скорее работают за кадром. Но без их незаметного вклада большое кино было бы совсем другим.
В следующей части «Атлас» расскажет о пептидах и опиодиах — эта тема требует отдельного разговора.
Физиология человека и животных Лекция 5 Физиология возбудимых клеток Медиаторы. - презентация
Презентация на тему: " Физиология человека и животных Лекция 5 Физиология возбудимых клеток Медиаторы." — Транскрипт:
1 Физиология человека и животных Лекция 5 Физиология возбудимых клеток Медиаторы
2 Основные медиаторы: 1. Ацетилхолин 2. Дофамин 3. Норадреналин 4. Серотонин 5. Глутамат 6. ГАМК 7. Глицин 8. SP 9. Опиоиды 10. Нитроксид (NO) 11. Пурины (АТФ, Аденозин) и др. катехоламины биогенные амины Принцип Дейла: нейрон представляет собой единую метаболическую систему и выделяет один и тот же медиатор во всех терминалях. аминокислоты Нейропептиды (десятки) Обычно выделяться несколько медиаторов совместно, либо медиатор и несколько модуляторов. Роль модуляторов: Изменяют выброс медиатора Изменяют чувствительность рецепторов
3 Требования к веществу для отнесения его к классу «медиаторы» 1. Вещество и его предшественники должны обнаруживаться в теле нейрона, окончаниях и везикулах (в больших концентрациях) 2. В нейроне должна быть система синтеза вещества 3. Вещество должно выбрасываться в щель при ПД путем Са++ зависимого экзоцитоза 4. В щели должна быть система инактивации вещества 5. На постсинаптической мембране должны быть рецепторы (в высокой плотности), имеющие специфические блокаторы 6. Идентичность эффектов аппликации вещества на синапс и стимуляции нейрона, его содержащего 7. Вещество не должно проходить ГЭБ Модуляторы: в наличии только часть свойств (нет собственных эффектов, высвобождаются не из нейронов, не инициируется ПД) Нейрогормоны: вещество секретируется в кровь
4 Ацетилхолин Синтез из холина и ацетила-КоА в ЦНС (кора, таламус, хвостатое ядро, ретикулярная формация), вегетативных ганглиях мотонейронах. Рецепторы: Н (никотиновые): Н1- мышечные, Н2- нейронные. Действие на катионный канал, Блокируются Д-тубокурарином. М (мускариновые): М1,М2,М5 – действие на ИФ3 путь М2 – действие на Gi (открытие К+ канала) Блокатор – атропин (беладона) Роль: движение (миастения гравис ), мнестические процессы (старческое слабоумие)
5 Дофамин Синтез: из ДОФА (источник - тирозин) тирозингидроксилазой в ЦНС ядра: дугообразное – в гипоталамус (выработка РФ), черная субстанция – в хвостатое ядро (двигательный контроль), В-Л покрышка – в лимбическую систему (эмоции). вне ЦНС: иммунные клетки, ЖКТ Рецепторы: Д1,Д5: увеличивают синтез цАМФ (Gs) Д2, Д3,Д4: подавляют синтез цАМФ (Gi) Агонист: бромкриптин ( алкалоид спорыньи: тормозит синтез пролактина, лечение бесплодия ) Блокатор- галоперидол ( антипсихотик ) Синтез из аминокислот в ядре, далее аксонный транспорт Большую роль играет механизм обратного захвата Роль: контроль произвольных движений (паркинсонизм), пищевое поведение, положительные эмоции (шизофрения )
6 Норадреналин Синтез из дофамина д офамин-в-гидроксилазой в ЦНС (голубое пятно ок.1000 нейонов), симпатических нервах Рецепторы: ИФ3 – путь, агонист: фенилэфрин, блокатор: празосин Gi белок, агонист: клонидин, блокатор: йохимбин Gs белок, агонист: изопротеренол, блокатор: пропранолол Синтез из аминокислот в ядре, далее аксонный транспорт Большую роль играет механизм обратного захвата (кокаин) Роль: обучение, эмоции, настроение, подавление боли бодрствование (МДП) Антагонисты нейролептики с седативным эффектом (резерпин, аминазин), Агонисты (амфетамин) психостимуляторы. =
7 Для катехоламинов показана общая система регуляции синтеза и инактивации Расщепление: МАО (А и Б), КОМТ. Мягкие блокаторы и модуляторы- антидепрессанты (прозак), сильные (CS2) вызывают гиперактивацию
8 Серотонин (5-НТ) Синтез из 5- окситриптофана (источник- триптофан) в ЦНС (ядра шва), мозговом слое надпочечников, ЖКТ Рецепторы: 5НТ1: Gi белок 5НТ2: ИФ3-путь 5НТ3 катионный канал 5НТ4-7 Gs белок Блокаторы: ципрогептадин Роль: терморегуляция, сон, циркадные ритмы, тревожность, депрессия и агрессия, сенсорное восприятие (LSD=ДЛК диэтиламид лизергиновой к-ты из спорыньи; синестезия )
9 Глутамат Синтез из глюкозы (цикл Кребса) в коре, гиппокампе, стриатуме, гипоталамусе, таламусе и др. Инактивация: захват глутамата глией в синаптической щели Рецепторы: NMDA, AMPA: Са канал mGluR1-5: ИФ3 путь Антагонист: кетамин (наркоз) Агонист: каинат Роль: основной возбуждающий медиатор ЦНС, память (эпилепсия)
10 ГАМК Синтез из глутатмата В коpе, черной субстанции, гиппокампе, стриатуме, мозжечке, спинном мозге, и обонятельной луковице (до 30% нейронов) Рецепторы: ГАМКа, ГАМКс: Cl- канал ГАМКб: Gi-белок Роль: моторная и эмоциональная активность (анксиолитическая - модулятор дофаминеpгических нейpонов ), сон (седация), память (эпилепсия) Агонисты: мусцимол (а), бензодиазепины, барбитураты, баклофен (б) - анксиолитики. Антагонисты: бикукулин (а), пикротоксин (а и с), пенициллин - судороги. Инактивация: обратный захват
11 Глицин Синтез из ацетил-КОА в спинном мозге,(клетки Реншоу) мосте, продолговатом мозге, гиппокампе Рецепторы: GlyR: анионный канал агонист: таурин, антагонист: стрихнин Роль: регуляция рефлекторной деятельности, питание мозга
12 Субстсанция П (SP) Белковый синтез (11 а.к.) в спинномозговых ганглиях, стенках полых органов (болевой вход в спинной мозг). Часто бывает модулятором (при Д, НА) (5НТ+SP – угнетающее действие на выброс 5НТ, сам 5НТ стимулирует секрецию SP) Рецептор: Gs- белок Роль: восприятие болевого сигнала, сокращение гладких мышц Пептидные медиаторы (признано около 10 видов)
13 Опиоидные пептиды (группа из 13 шт) b-эндорфин H-Y-G-G-F-L-M-T-S-E-K-S-Q-T- P-L-V-T-L-F-K-N-A-I-V-K-N- A-H-K-K-G-Q-OH Синтез: В соме на рибосомах в ЭПР предшественники, (далее распад, гликозилирование, S-S мостики), в АГ (фосфорилирование, сульфатирование), далее медленный аксонный транспорт. В ЦНС (ствол, гипоталамус, кора) Рецепторы: Gi белок : торможение Са тока Агонист: морфин Антагонист: налоксон Роль: система положительного подкрепления, сон, обезболивание Действуют в концентрациях (в 1000 раз ниже, чем низкомолекулярные медиаторы)
14 Гистамин Синтез из гистидина в заднем гипоталамусе, волокна – по всему мозгу, характерен несинаптический выброс медиатора Рецепторы: Н1: ИФ3 путь (+) Н2: Gs-белок Н3: Gi-белок (пресинаптический) Роль: регуляция общего метаболизма - повышает уровень бодрствования, мышечный тонус, пищевое и половое поведение (см.антигистаминовые препараты) Кроме медиаторной роли выполняет функцию расширения сосудов, фактора воспаления, секреции желудочного сока
15 Adenosine ATP CNS, periperal nerves ATP sympathetic, sensory and enteric nerves
Читайте также:
