Строение аминокислот. Классификация аминокислот.
Обновлено: 26.04.2024
ОМСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ
КАФЕДРА ХИМИИ
ОРГАНИЧЕСКАЯ ХИМИЯ
Лекция
Аминокислоты. Классификация.
Реакционная способность.
1.Строение, номенклатура, изомерия.
2. Физические и химические свойства.
Лектор: кандидат биологических наук, доцент
Атавина Ольга Васильевна
2. Цели лекции:
1. Обучающая - Сформировать знания о
строении, номенклатуре и реакционной
способности аминокислот.
2. Развивающая – Расширять кругозор
обучающихся на основе интеграции знаний;
развивать логическое мышление.
3. Воспитательная – Содействовать
формированию у обучающихся устойчивого
интереса к изучению дисциплины
«Органическая химия»
Аминокислоты, строение, номенклатура, изомерия
Аминокислотами называют гетерофункциональные
соединения, содержащие одновременно -NH2 и - СООН группы
в составе одной молекулы.
Г
Аминокислоты, строение, номенклатура, изомерия
• Аминокислоты находят широкое применение в синтетической
и аналитической химии (например, трилон Б ). На основе
ароматических аминокислот синтезируют диазокрасители, из
антраниловой кислоты получают краситель индиго, из
капролактама (циклического внутримолекулярного амида ε –
аминокапроновой кислоты) – синтетическое волокно капрон,
сложные эфиры антраниловой кислоты имеют приятный
запах и используются в парфюмерии.
Аминокислоты, строение, номенклатура, изомерия
Строение аминокислот
Алифатические аминокислоты подразделяются на α, β, γ,
δ, ε - аминокислоты и т.д.
C C C C COOH
Аминокислоты, строение, номенклатура, изомерия
Номенклатура алифатических аминокислот
1. Тривиальная номенклатура в основном используется для
широко распространённых аминокислот.
2. Рациональная
Аминогруппа обозначается префиксом амино-, а карбоксильная группа
3. IUPAC как старшая — суффиксом -овая кислота.
CH2 CH
COOH
OH NH2
серин
-амино- -гидроксипропионовая кислота
2-амино-3-гидроксипропановая кислота
9
Аминокислоты, строение, номенклатура, изомерия
Ароматические аминокислоты существуют в виде орто-,
мета- и пара-изомеров. В названиях ароматических
аминокислот в качестве родоначальной структуры используется
бензойная кислота.
12. Классификация -аминокислот
13. Аминокислоты, строение, номенклатура, изомерия
Аминокислоты, строение, номенклатура, изомерия
По количеству карбокси- и аминогрупп -аминокислоты
классифицируют на:
• Моноаминомонокарбоновые кислоты (глицин, аланин,
валин, лейцин, изолейцин, серин, треонин, цистеин,
фенилаланин, тирозин, метионин, триптофан и т.д.)
• Моноаминодикарбоновые кислоты (аспарагиновая кислота,
глутаминовая кислота)
• Диаминомонокарбоновые кислоты (лизин, аргинин)
• Диаминодикарбоновые кислоты (цистин)
14
Аминокислоты, строение, номенклатура, изомерия
Классификация по встречаемости в белках :
В составе белков человека открыто 20 α – аминокислот. Все
белковые аминокислоты отличаются друг от друга
радикалами (исключение – пролин - иминокислота , у
которой вместо аминогруппы –NH2 - =NH).
15
16. Алифатические АК
Аминокислоты, строение, номенклатура, изомерия
Алифатические АК
CH3 CH
CH2 COOH
NH2
NH2
Тривиальноe
Рациональноe
IUPAC
Обозначниe
COOH
глицин, гликокол
Аминоуксусная кислота
Аминоэтановая кислота
Gly, Гли
Аланин
-аминопропионовая кислота
2-аминопропановая кислота
Ala, Ала
CH3
CH
CH3
CH
COOH
NH2
Валин
-аминоизовалeриановая кислота
2-амино-3-мeтилбутановая кислота
Val, Вал
Аминокислоты, строение, номенклатура, изомерия
CH3
CH CH2 CH
CH3
COOH
NH2
Лeйцин
-аминоизокапроновая кислота
2-амино-4-мeтилпeнтaновая кислота
Leu, Лeй
CH3
CH
CH3 CH2
CH
COOH
NH2
Изолeйцин
-амино- -мeтилвалeриановая кислота
2-амино-3-мeтилпeнтaновая кислота
Ile, Илe
18. Содержащие ОН-группу
Аминокислоты, строение, номенклатура, изомерия
Содержащие ОН-группу
CH2 CH
OH
COOH
NH2
Ceрин
-амино- -оксипропионовая кислота
2-амино-3-гидроксипропановая кислота
Ser, Сeр
CH3 CH
OH
CH
COOH
NH2
Трeонин
-амино- -оксимасляная кислота
2-амино-3-гидроксибутановая кислота
Thr, Трe
19. Серосодержащие АК
Аминокислоты, строение, номенклатура, изомерия
Серосодержащие
АК
S
CH2 CH
SH
COOH
2
NH2
CH2 CH
SH
COOH
-2e, -2H+
NH2
S
CH2 CH2 CH
COOH
NH2
Цистeин
Цистеин
-амино- -тиопропионовая кислота
2-амино-3-сульфанилпропановая кислота
(2-амино-3-тиопропановая кислота,
2-амино-3-мeркаптопропановая кислота – устаревш.)
Cys, Цис
CH3 S
CH2 CH
CH2 CH
NH2
Цистин
COOH
NH2
Мeтионин
-амино- -мeтилтиомасляная кислота
2-амино-4-метилсульфанилбутановая кислота
(2-амино-4-метилтиобутановая кислота – устаревш.)
Met, Мет.
COOH
20. Моноаминодикарбоновые кислоты и их амиды
Аминокислоты, строение, номенклатура, изомерия
Моноаминодикарбоновые кислоты и их амиды
HOOC
CH2 CH
COOH
HOOC CH2 CH2 CH
NH2
NH2
Аспарагиновая кислота
Аминоянтарная кислота
Аминобутандиовая кислота
Asp, Асп
O
Глутаминовая кислота
-aминоглутаровая кислота
2-аминопентандиовая кислота
Glu, Глу
O
C
H2N
COOH
CH2 CH
COOH
NH2
Аспарагин
Амид аспарагиновой кислоты
2,4-диамино-4-оксобутановая кислота
Asn, Асн
H2N
C CH2 CH2 CH COOH
NH2
Глутамин
Амид глутаминовой кислоты
2,5-диамино-5-оксопентановая кислота
Gln, Глн
21. Содержащие аминогруппу
Аминокислоты, строение, номенклатура, изомерия
Содержащие аминогруппу
CH2 CH2 CH2 CH2 CH
NH2
COOH
NH2
Лизин
, -диаминокапроновая кислота
2,6-диаминогексановая кислота
Lys, Лиз
NH
H2N
C
NH
CH2 CH2 CH2 CH
COOH
NH2
Аргинин
-амино- -гуанидилвалериановая кислота
2-амино-5-[амино(имино)метил]аминопентановая к-та
Arg, Арг
22. Ароматические АК
Аминокислоты, строение, номенклатура, изомерия
Ароматические АК
CH2 CH
COOH
NH2
Фенилаланин
-амино- -фенилпропионовая к-та
2-амино-3-фенилпропановая к-та
Phe, Фен
HO
CH2 CH
COOH
NH2
Тирозин
-амино- -(п-оксифенил)пропионовая к-та
2-амино-3-(4-гидроксифенил)пропановая к-та
Tyr, Тир
23. Гетероциклические АК
Аминокислоты, строение, номенклатура, изомерия
Гетероциклические АК
CH2
CH
COOH
NH2
N
H
COOH
Триптофан
-амино- -индолилпропионовая к-та
2-амино-3-(1H-индол-3-ил)пропановая к-та
Trp, Три
N
N
H
CH2
CH
COOH
NH2
Гистидин
-амино- -имидазолилпропионовая к-та
2-амино-3-(1H-имидазол5-ил)пропионовая к-та
His, Гис
N
H
Пролин
Пирролидин- -карбоновая к-та
2-пирролидинкарбоновая к-та
Pro, Про
Аминокислоты, строение, номенклатура, изомерия
По пищевой ценности для человека аминокислоты делятся на:
заменимые и незаменимые.
• Основным источником α - аминокислот для организма
человека служат пищевые белки. Многие α -аминокислоты
синтезируются в организме, некоторые же необходимые для
синтеза белков α-аминокислоты не синтезируются в
организме и должны поступать извне. Такие аминокислоты
называют незаменимыми вал, лиз, фен, лей, иле, тре, три,
мет.
• При некоторых, чаще всего врожденных, заболеваниях
перечень незаменимых кислот расширяется. Например, при
фенилкетонурии человеческий организм не синтезирует еще
одну аминокислоту — тирозин , которая в организме
здоровых людей получается при гидроксилировании
фенилаланина.
24
Аминокислоты, строение, номенклатура, изомерия
По характеру катаболизма (биохимической роли):
1). глюкогенные – при распаде дают метаболиты, не
повышающие уровень кетоновых тел, способные легко
становиться субстратом для глюконеогенеза (процесс
образования в печени молекул глюкозы из молекул
других органических соединений) -Гли, Ала, Тре, Вал,
Аск, Глк, Apr, Гис, Мет. и др.
2). кетогенные - повышающие уровень кетоновых тел в
крови животных и человека - Лей, Лиз
Аминокислоты, строение, номенклатура, изомерия
Изомерия
1. Структурная изомерия
CH3
CH3
CH CH2 CH
CH3
COOH
NH2
лейцин
CH
CH3 CH2
CH
COOH
NH2
изолейцин
CH3 CH COOH
NH2
аланин
CH2 CH2 COOH
NH2
-аланин
27. Аминокислоты, строение, номенклатура, изомерия
2. Стереоизомерия
α - Аминокислоты - хиральные соединения. Исключение
составляет глицин
Относительная конфигурация - аминокислот
определяется по положению –NН2 группы. Расположение
аминогруппы слева соответствует L - конфигурации, справа D - конфигурации.
Почти все природные - аминокислоты принадлежат к
L - ряду.
28. Аминокислоты, строение, номенклатура, изомерия
29. Аминокислоты, строение, номенклатура, изомерия
30. Физические и химические свойства
Физические свойства
-Аминокислоты - кристаллические вещества. Имеют
высокие температуры плавления (выше 200 С), нелетучие,
растворимые в воде и нерастворимые в неполярных
органических растворителях. Способность - аминокислот
растворяться в воде является важным фактором
обеспечения их биологического функционирования - с нею
связаны всасываемость - аминокислот, их транспорт в
организме и т.п.
31. Физические и химические свойства
Физические свойства
-Аминокислоты - кристаллические вещества. Имеют
высокие температуры плавления (выше 200 С), нелетучие,
растворимые в воде и нерастворимые в неполярных
органических растворителях. Способность - аминокислот
растворяться в воде является важным фактором
обеспечения их биологического функционирования - с нею
связаны всасываемость - аминокислот, их транспорт в
организме и т.п.
32. Физические и химические свойства
В твердом состоянии и водных растворах при
нейтральных значениях pH -аминокислоты существуют
преимущественно в виде внутренних солей. В
сильнокислой среде преобладает катионная форма, в
сильнощелочной - анионная.
+
CH3 CH
COOH
+
NH3
Сильнокислая среда
-H
+
+H
CH3 CH
COO -
+
NH3
Почти нейтральная
+
-H
+
CH3 CH
+H
Сильнощелочная среда
NH2
COO-
33. Физические и химические свойства
Положение равновесия аминокислоты в водном растворе
при определенном значении pH существенно зависит от
строения радикала.
Значение pH, при котором концентрация диполярных
ионов максимальна, а минимальные концентрации
катионных и анионных форм -аминокислоты равны,
называется изоэлектрической точкой (pI).
В изоэлектрической точке суммарный заряд молекулы
кислоты равен 0.
35. Физические и химические свойства
Химические свойства
1. Кислотно-основные свойства.
-Аминокислоты - амфотерные соединения, вступают в
реакции как с кислотами, так и со щелочами с
образованием солей:
а) Кислотные свойства. Реакция со щелочами:
б) Основные свойства.
Реакция с сильными минеральными кислотами:
36. Физические и химические свойства
37. Физические и химические свойства
3. Образование дикетопиперазинов.
-аминокислоты при нагревании дают
дикетопиперазины (диоксопиперазины):
38. Физические и химические свойства
39. Физические и химические свойства
4. Образование лактамов.
- и -аминокислоты при нагревании отщепляют воду,
циклизуются с образованием лактамов – циклических амидов:
O
CH2
C
OH
t
CH2
CH2 N H
H
-аминомасляная кислота
O
CH2 C
CH2
N H
+
H2O
CH2
-бутиролактам
39
40. Физические и химические свойства
Физические и химические свойства
1. Реакция элиминирования.
-аминокислоты при нагревании отщепляют аммиак, образуя
ненасыщенные кислоты:
t
NH3
CH2 CH COOH +
. CH2 CH2 COOH
NH2
42. Физические и химические свойства
2. Ацилирование (защита аминогруппы)
O
CH3 CH
COOH
NH2
+
CH3 C
Cl
CH3 CH
COOH
+
HCl
NH
C O
CH3
аланин
ацетилхлорид
N-ацетилаланин
42
43. Физические и химические свойства
3. Арилирование
O2N
F
+
NH2 CH
COOH
CH3
NO2
O2N
NH CH
COOH
+
HF
CH3
NO2
N-(2,4-динитрофенил)аланин
Реакция используется для определения N-концевой аминокислоты в пептидах и
белках по Сэнджеру
43
44. Физические и химические свойства
4.Взаимодействие с карбонильными соединениями
H
R
CH
NH2
COOH
+
C O
H
R
CH
COOH
NH
CH2 O H
Данная реакция используется в формольном титровании по
Сёренсену: метилольные производные являются гораздо более
сильными кислотами чем аминокислоты и они легко
оттитроввываются щёлочью. Реакция с формальдегидом лежит
в основе количественного определения α-аминокислот
44
45. Физические и химические свойства
5. Взаимодействие с азотистой кислотой
R
CH
COOH
+
NH2
-аминокислота
HNO2
R
CH
COOH
+
N2
+
H2O
OH
-гидроксикислота
Реакция с азотистой кислотой используется определения
аминокислот по Ван-Сляйку: по объему выделившегося азота
легко найти количество аминокислоты.
45
46. Физические и химические свойства
6. Дезаминирование - это реакция удаления аминогруппы
путем окислительного, восстановительного,
гидролитического или внутримолекулярного
дезаминирования.
В организме преобладает путь окислительного
дезаминирования с участием ферментов дегидрогеназ и
кофермента - НАД+:
- На первой стадии процесса осуществляется
дегидрирование -звена с образованием -иминокислоты.
- На второй стадии происходит неферментативный
гидролиз, приводящий к образованию -кетонокислоты и
сопровождающийся выделением аммиака,
включающегося в цикл образования мочевины.
47. Физические и химические свойства
48. Физические и химические свойства
7.Переаминирование (трансаминирование)
- это путь синтеза необходимых АК из -кетонокислот.
При этом донором аминогруппы является -АК,
находящаяся в избытке, а акцептором аминогруппы
-кетонокислоты (ПВК, ЩУК, -кетомаслянная кислота).
Процесс происходит с участием фермента - трансаминазы и
кофермента – пиридоксальфосфата.
49. Физические и химические свойства
Процесс переаминирования связывает обмен белков и
углеводов в организме, регулирует содержание АК и синтез
незаменимых -АК.
50. Физические и химические свойства
1. Образование сложных эфиров
Реакция используется для защиты карбоксильной группы в
синтезе пептидов
51. Физические и химические свойства
2. Декарбоксилирование (путь образования биогенных
аминов из - аминокислот).
Процесс идет с участием ферментов декарбоксилаз.
CH2
CH
COOH
NH2
N
CH2
декарбоксилаза
CO2
триптофан
N
H
гистидин
CH
H
триптамин
N
CH2
NH2
N
H
CH2
COOH
декарбоксилаза
N
N
NH2
CO2
CH2
H
CH2
NH2
гистамин
51
52. Аминокислоты и их производные, применяемые в медицине.
Аминокислоты и их производные, применяемые в
медицине
1) Пара-Аминобензойная кислота (т. пл. 187 °С). Получается из
4-нитротолуола путем окисления его в 4-нитробензойную
кислоту, которую затем восстанавливают в п-аминобензойную
кислоту (ПАБК).
53. Ароматические аминокислоты и их производные, применяемые в медицине.
Сложные эфиры ПАБК анестезин и новокаин
используются в качестве местноанестезирующих
ненаркотических препаратов. Они обладают низкой
токсичностью и ценными фармакологическими свойствами.
54. Ароматические аминокислоты и их производные, применяемые в медицине.
2) 4-Амино-2-гидроксибензойная (пара-аминосалициловая)
кислота ПАСК (т. пл. 220 °С). Получается прямым
карбоксилированием мета-аминофенола. Бензольное
кольцо за счет наличия двух сильных электронодонорных
групп очень активно в реакциях электрофильного
замещения, поэтому ПАСК образуется в более мягких
условиях, чем салициловая кислота Используется в качестве
противотуберкулезного средства.
55. Ароматические аминокислоты и их производные, применяемые в медицине.
3) Антраниловая (о-аминобензойная кислота).
Бесцветное кристаллическое вещество (т. пл. 147 °С),
используется для синтеза красителей, например синего
индиго, участвует в биосинтезе гетероциклических
соединений. Ее производные оказывают
противовоспалительное действие.
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ
Из-за разнообразного строения и свойств классификация аминокислот может быть различной, в зависимости от выбранного качества аминокислот. Аминокислоты делятся:
1. В зависимости от положения аминогруппы.
2. По абсолютной конфигурации молекулы.
3. По оптической активности.
4. По участию аминокислот в синтезе белков.
5. По строению бокового радикала.
6. По кислотно-основным свойствам.
7. По необходимости для организма.
По абсолютной конфигурации молекулы
По абсолютной конфигурации молекулы выделяют D- и L-формы . Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в α -положении.
В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию , т.е. L-форма переходит в D-форму. Это обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).
Строение, свойства и классификация аминокислот и белков
В зависимости от положения аминогруппы
Выделяют α, β, γ и другие аминокислоты. Для организма млекопитающих наиболее характерны α -аминокислоты.
По оптической активности
По оптической активности аминокислоты делятся на право- и левовращающие.
Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В
соответствии с углом поворота выделяют правовращающие (+) и левовращающие (–) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других – левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D-форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
По участию аминокислот в синтезе белков
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются α -аминокислотами.
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:
o по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные),
o электрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты,
o физиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг, Гис), т.е.их синтез происходит в недостаточном количестве.
Строение аминокислот. Классификация аминокислот.

А. Протеиногенные аминокислоты
Протеиногенными называются 20 аминокислот, которые кодируются генетическим кодом (см. с. 244) и включаются в белки в процессе трансляции . Строение боковых цепей этих аминокислот приведено на с. 67.
Классификация этих аминокислот основана как на строении , так и на полярности боковых цепей (см. с. 14).
В таблице для каждой из аминокислот приводятся следующие характеристики:
— классификация (семь классов);
— название и принятое сокращение (по трем первым буквам) (например, для гистидина — Нis);
— однобуквенный символ , удобный при записи белковых последовательностей (для гистидина — Н);
— полярность боковой цепи (для гистидина +10,3): чем выше эта величина, тем более полярна молекула аминокислоты.
На схеме по мере увеличения полярности окраска поля с названием аминокислоты меняется от желтых тонов через зеленые к синим. Для ионогенных групп боковой цепи приведены рК a (цифры красного цвета).
К алифатическим аминокислотам относятся глицин, аланин, валин, лейцин и изолейцин . Эти аминокислоты не несут в боковой цепи гетероатомов (N, О или S), циклических группировок и характеризуются отчетливо выраженной низкой полярностью.
Также малополярны серосодержащие аминокислоты — метионин и цистеин , причем цистеин существует лишь в недиссоциированном состоянии. Благодаря образованию дисульфидных мостиков, цистеин выполняет важную функцию стабилизации пространственной структуры белков. Аминокислота цистин состоит из двух остатков цистеина, соединенных дисульфидным мостиком.
Ароматические аминокислоты содержат мезомерные (резонансно стабилизированные) циклы (см. с. 12). В этой группе лишь фенилаланин проявляет низкую полярность. Тирозин и триптофан характеризуются заметной, а гистидин — даже высокой полярностью. Имидазольное кольцо гистидина заметно протонируется уже при слабокислых значениях рН. Поэтому гистидин, обладающий ароматическими свойствами лишь в протонированной форме (см. с. 64), может быть отнесен к основным аминокислотам. Тирозин и триптофан сильно поглощают в УФ-области спектра между 250 и 300 нм.
Нейтральные аминокислоты содержат гидроксильные (серин, треонин) или карбоксамидные группы (аспарагин, глутамин). Хотя амидные группы неионогенны, молекулы аспарагина и глутамина высоко полярны.
Карбоксильные группы боковых цепей кислых аминокислот — аспарагиновой и глутаминовой — полностью ионизированы во всем диапазоне физиологических значений рН. Аналогичным образом, боковые цепи основных аминокислот — лизина и аргинина — полностью протонированы в нейтральной области рН. Сильно основной, а, следовательно, очень полярной аминокислотой, является аргинин, содержащий гуанидиновую группировку.
Особое положение занимает пролин . Боковая цепь пролина состоит из пятичленного цикла, включающего α-углеродный атом и α-аминогруппу. Поэтому пролин, строго говоря, является не амино-, а иминокислотой . Атом азота и кольце является слабым основанием и не протонируется при физиологических значениях рН. Благодаря циклической структуре пролин вызывает изгибы полипептидной цепи , что очень существенно для структуры коллагена (см. сс. 76, 334).
Некоторые из перечисленных аминокислот не могут синтезироваться в организме человека и должны поступать вместе с пищей. Эти незаменимые аминокислоты (см. с. 348) отмечены звездочками красного цвета.
Классификация аминокислот
Все встречающиеся в природе аминокислоты обладают общим свойством – амфотерностью (от греч. amphoteros – двусторонний), т.е. каждая аминокислота содержит как минимум одну кислотную и одну основную группы. Общий тип строения α-аминокислот может быть представлен в следующем виде:
Как видно из общей формулы, аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью.
Классификация аминокислот разработана на основе химического строения радикалов, хотя были предложены и другие принципы. Различают ароматические и алифатические аминокислоты, а также аминокислоты, содержащие серу или гидроксильные группы. Часто классификация основана на природе заряда аминокислоты. Если радикал нейтральный (такие аминокислоты содержат только одну амино- и одну карбоксильную группы), то они называются нейтральными аминокислотами. Если аминокислота содержит избыток амино- или карбоксильных групп, то она называется соответственно основной или кислой аминокислотой.
Современная рациональная классификация аминокислот основана на полярности радикалов (R-групп), т.е. способности их к взаимодействию с водой при физиологических значениях рН (близких к рН 7,0). Различают 5 классов аминокислот, содержащих следующие радикалы: 1) неполярные (гидрофобные); 2) полярные (гидрофильные); 3) ароматические (большей частью неполярные); 4) отрицательно заряженные и 5) положительно заряженные. В представленной классификации аминокислот (табл. 1.3) приведены наименования, сокращенные английские и русские обозначения и однобуквенные символы аминокислот, принятые в отечественной и иностранной литературе, а также значения изоэлектрической точки (рI) и молекулярной массы (М). Отдельно даются структурные формулы всех 20 аминокислот белковой молекулы.


Полярные, незаряженные R-группы

Отрицательно заряженные R-группы
Положительно заряженные R-группы
Перечисленные аминокислоты присутствуют в разных количественных соотношениях и последовательностях в тысячах белков, хотя отдельные индивидуальные белки не содержат полного набора всех этих аминокислот. Помимо наличия в большинстве природных белков 20 аминокислот, в некоторых белках обнаружены производные аминокислот : оксипролин, оксилизин, дийодтирозин, фосфосерин и фосфотреонин (последние две аминокислоты представлены в главе 2):
Первые две аминокислоты содержатся в белке соединительной ткани – коллагене, а дийодтирозин является основой структуры гормонов щитовидной железы. В мышечном белке миозине обнаружен также ε-N-метиллизин; в состав протромбина (белок свертывания крови) входит γ-карбоксиглутаминовая кислота, а в глутатионпероксидазе открыт селеноцистеин, в котором ОН-группа серина заменена на селен (Se):
Помимо указанных, ряд α-аминокислот выполняет важные функции в обмене веществ, хотя и не входит в состав белков, в частности орнитин, цитруллин, гомосерин, гомоцистеин, цистеинсульфиновая кислота, диоксифенилаланин и др.
Строение аминокислот. Классификация аминокислот.
Аминокислоты классифицируют по следующим структурным признакам.
I. Классификация по взаимному положения функциональных групп
В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д.
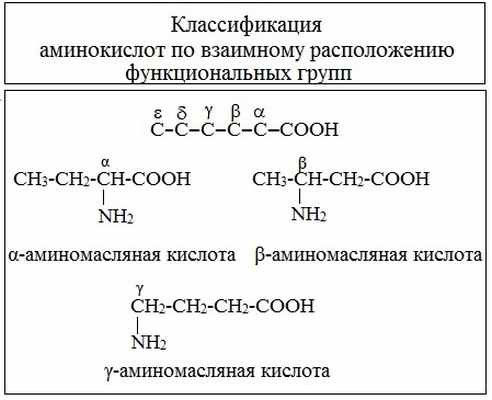
Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы.
II. Классификация по строению бокового радикала (функциональным группам)
Алифатические аминокислоты
Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин.
Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд).
Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин.
Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд).
Ароматические аминокислоты: фенилаланин, тирозин, триптофан.
Гетероциклические аминокислоты: триптофан, гистидин, пролин.
Иминокислоты: пролин.
III. Классификация по полярности бокового радикала (по Ленинджеру)
Выделяют четыре класса аминокислот, содержащих радикалы следующих типов.

Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка.
Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток.
1. Неполярные (гидрофобные)
К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота:
— алифатические: аланин, валин, лейцин, изолейцин
— ароматические: фенилаланин, триптофан.


2. Полярные незаряженные
Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды.
К ним относятся аминокислоты, содержащие:
— полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин
— амидную группу: глутамин, аспарагин
— и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы).


3. Заряженные отрицательно при рН-7 (кислые)
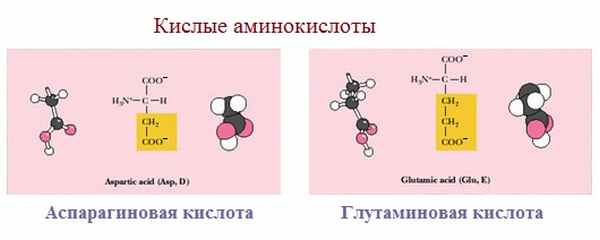
Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам.
Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд:
4. Заряженные положительно при рН-7 (основные)

К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин.
В ионизированном виде они имеют суммарный положительный заряд:
В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные.
IV. Классификация по кислотно-основным свойствам
В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты.
Основные
Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин:
Кислые
Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:
Все остальные аминокислоты относятся к нейтральным.
V. По числу функциональных групп
Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые:

VI.Биологическая классификация (по способности синтезироваться в организме человека и животных)
Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин.
Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи.
Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов.
Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин.
Для детей также незаменимыми являются гистидин и аргинин.

Для человека одинаково важны оба типа аминокислот: и заменимые, и незаменимые. Большая часть аминокислот идет на построение собственных белков организма, но без незаменимых аминокислот организм существовать не сможет.
При недостатке каких-либо аминокислот в организме человека в течение непродолжительного времени могут разрушаться белки соединительной ткани, крови, печени и мышц, а полученный из них «строительный материал» — аминокислоты идут на поддержание нормальной работы наиболее важных органов — сердца и мозга.
Дефицит аминокислот приводит к ухудшению аппетита, задержке роста и развития, жировой дистрофии печени и другим тяжелым нарушениям.
При этом наблюдается снижение аппетита, ухудшение состояния кожи, выпадение волос, мышечная слабость, быстрая утомляемость, снижение иммунитета, анемия.
Избыток аминокислот может вызвать развитие тяжелых заболеваний, особенно у детей и в юношеском возрасте. Наиболее токсичными являются метионин (провоцирует риск развития инфаркта и инсульта), тирозин (может спровоцировать развитие артериальной гипертонии, привести к нарушению работы щитовидной железы) и гистидин (может способствовать возникновению дефицита меди в организме и привести к заболеваниям суставов, ранней седине, тяжелым анемиям).
В условиях нормального функционирования организма, когда присутствует достаточное количество витаминов (В6, В12, фолиевой кислоты) и антиоксидантов (витамины А, Е, С и селен), избыток аминокислот не наносит вред организму.
Читайте также:
