Анатомия: Позвоночные венозные сплетения. Позвоночные вены
Обновлено: 04.05.2024
Сосудистые поражения нервной системы являются важной проблемой современной клинической неврологии. Изучение нарушений венозного кровообращения головного мозга при этом остается одной из актуальных задач современной медицины.
Совершенствование ультразвуковой аппаратуры, а также ее программного обеспечения привело к тому, что при исследовании кровотока в артериях головного мозга удается оценить состояние венозного кровотока на достаточно хорошем уровне.
Однако основная проблема при этом заключается в том, что данные о нормативных значениях скоростей в венозной системе головного мозга крайне разрозненные, обрывочные и не всегда однозначные. В связи с этим часто приходится полагаться на собственный опыт, принимая за основу данные ряда литературных источников (табл. 1), в большей степени соответствующие особенностям данного прибора, качеству получаемого изображения и возрасту больного. Небольшое число ультразвуковых исследований, где содержались бы данные о состоянии венозного кровотока на экстра- и тем более на интракраниальном уровнях, объясняется в первую очередь аппаратными особенностями, и уже только после этого недостаточным объемом информации по данной проблематике в периодической литературе, сложностью пространственно-анатомического трехмерного восприятия интракраниальной венозной системы врачами-диагностами, низкой потребностью в подобных исследованиях со стороны невропатологов.
Таблица 1. Показатели кровотока (Vmax, см/с) во внутренних яремных венах и в основных интракраниальных венах/синусах мозга.
Целью настоящего исследования явилась оценка корреляционных зависимостей у пациентов с признаками венозной дисциркуляции на интра- и экстракраниальном уровнях, церебральной венозной гемодинамики у детей и подростков с клиникой "краниалгии", с уточнением причинно-следственных связей, обуславливающих формирование венозной дисциркуляции.
Материал и методы
В исследование включено 106 детей в возрасте от 2 до 18 лет, средний возраст 9,87 ± 3,9 года (от 2 до 6 лет - 18 человек, средний возраст 3,8 ± 1,43 года; от 7 до 18 лет - 88 человек, средний возраст 11,1 ± 2,99 года), направленных на обследование в диагностический центр г. Калининграда с клиникой головной боли, либо явлениями вертебробазилярной недостаточности. В процессе выполнения обследования у всех были выявлены признаки дисгемии на интра- и экстракраниальном уровнях. Ультразвуковые допплерографические исследования артериального и венозного кровотока на уровне шеи и основания головного мозга выполнялись на приборе Medison Accuvix V10 (Ю. Корея), в В-, С-, PW-режимах, линейным (L5-12 МГц) и секторным фазированным (Р2-4 МГц) датчиками. Оценка корреляционных зависимостей проводилась между 94 клинико-инструментальными показателями.
Результаты
В результате проведенного исследования было установлено, что дисциркуляция в системе позвоночных вен (ПВ), как правило, является следствием выраженных экстравазальных влияний (компрессия сосудов) на кровоток во внутренней яремной вене (ВЯВ) на стороне регистрации дисгемии (r = + 0,67; р 0,05).
Дисгемии в вене Галена справа чаще сопутствует повышение тонуса ПА, ВСА и СМА на ипсилатеральной стороне (как следствие рефлекторных изменений), равно как и первая оказывается связанной с перегибами и S-образной извитостью ВСА справа. Влияние извитости ВСА на венозный отток может быть обусловлено экстравазальной компрессией извитыми артериальными стволами венозных сосудов со значительно большим внутрисосудистым давлением в местах их максимально тесного прилегания.
Связь "синдрома головной боли" с ускоренным венозным кровотоком по венам Галена оказалась крайне низкой (r = +0,22; p 15 см/с, вене Галена > 20 см/с и прямом синусе > 30 см/с)
[1]. Предполагают, что при хронически текущих процессах в поло сти черепа венозное кровообращение страдает значительнее.
Отмечено, что резкое усиление венозного сигнала, изменение физиоло гического направления кровотока по внутренней глазной вене на ретроградное выявляют на стороне "очага" поражения мозга при нарушениях мозгового кровообращения черепно-мозговой травме, сопровождаемых повышением внутричерепного давления [13].

Рис. 2. Средняя мозговая артерия (СМА). Транстемпоральный доступ. Режим ЦДК (цветового допплеровского картирования) на уровне передней мозговой артерии (ПМА) (3), СМА (5), первого (7) и второго (8) сегментов ЗМА, вены Розенталя (9), вены Галена (10), средней мозговой вены (4), нижней желудочковой вены (приток вены Розенталя) (6). Ножки мозга (pedunculi cerebri) (1; 2).
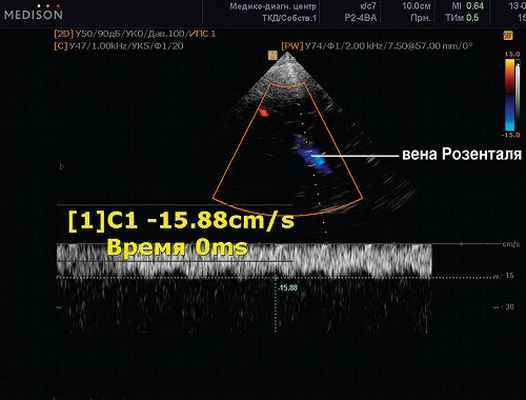
Рис. 3. Средняя мозговая вена (глубокая). Там же. ЦДК, PW-режим. Сканирование потока в вене Розенталя. Vmax 15,88 см/с.
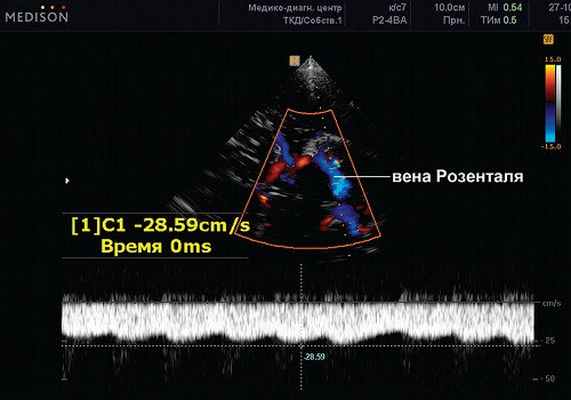
Рис. 4. Задняя мозговая артерия (сегмент Р1) (ЗМА). Транстемпоральный доступ. ЦДК, PW-режим. Сканирование патологического ускоренного потока в вене Розенталя. Vmax 28,59 см/с.

Рис. 5. Базилярное венозное сплетение. Транстемпоральный доступ. ЦДК, PW-режим. СМА (1), ЗМА сегмент Р1 (4), ножки мозга (6; 7), средняя мозговая вена (2), вена Розенталя (5). Сканирование потока в нижней желудочковой вене (приток вены Розенталя) (3).
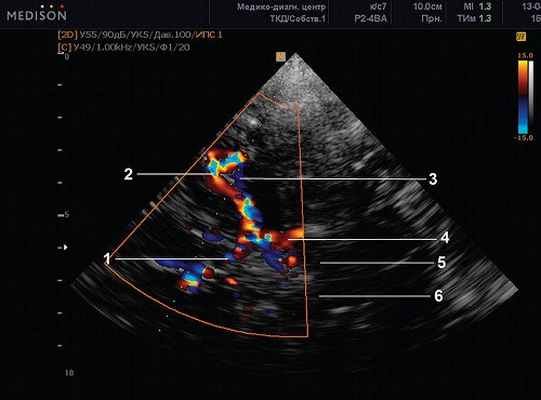
Рис. 6. Базилярная (основная) артерия. Транстемпоральный доступ. Режим ЦДК на уровне ПМА (1), СМА (2), первого сегмента ЗМА (4), средней мозговой вены (3). Ножки мозга (pedunculi cerebri) (5; 6).

Рис. 7. Вена Розенталя (правая) и ветвь задней мозговой артерии (правая). Там же. ЦДК, PW-режим. Сканирование потока в средней мозговой вене (проксимальный сегмент).

Рис. 8. Позвоночная артерия (сегмент V1). Транстемпоральный доступ. ЦДК, PW-режим. Сканирование патологического ускоренного потока в средней мозговой вене (проксимальный сегмент). Vmax 24,62 см/с

Рис. 9. Краевой венозный синус. Транстемпоральный доступ. Режим ЦДК на уровне первого сегмента ЗМА (3), вены Розенталя (4), вены Галена (5). Ножки мозга (pedunculi cerebri) (1; 2).
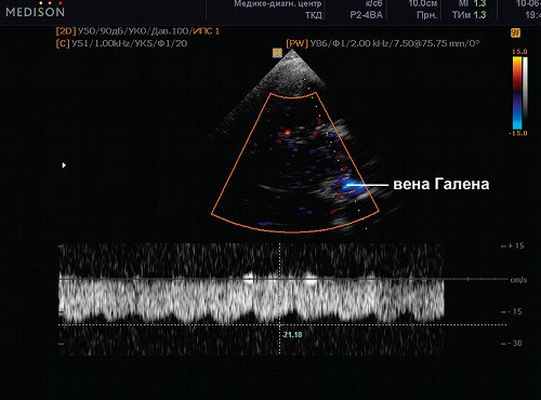
Рис. 10. Вена Галена (большая вена мозга). Там же. ЦДК, PW-режим. Сканирование потока в вене Галлена. Vmax 21,18 см/с
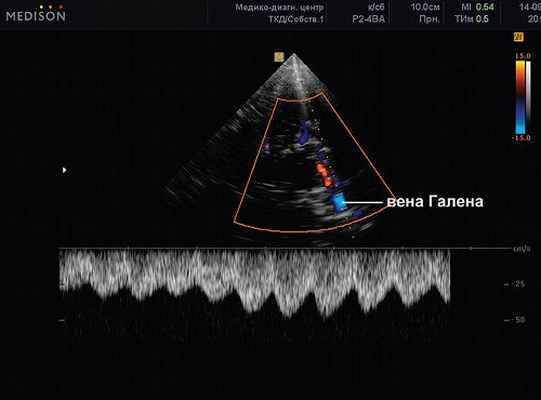
Рис. 11. Прямой синус. Транстемпоральный доступ. ЦДК, PW-режим. Сканирование патологического ускоренного потока в вене Гален. Vmax 50 см/с

Рис. 12. Ветвь задней мозговой артерии (левая). Продольное сканирование в проекции сегмента V2 позвоночной артерии (1) и позвоночной вены (2). ЦДК и PW-режим. Vmax в позвоночной вене 34,69 см/с.
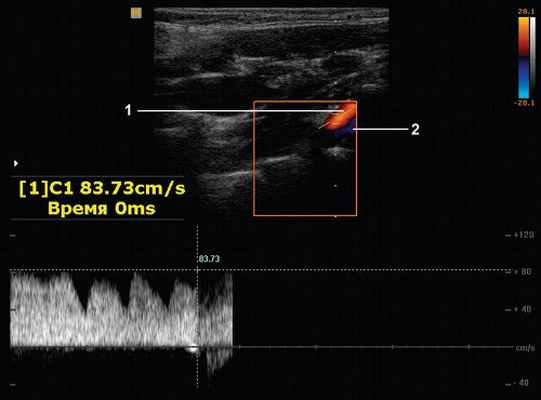
Рис. 13. Вена Розенталя (левая). Продольное сканирование в проекции сегмента V1 позвоночной артерии (1). ЦДК и PW-режим. Патологический ускоренный поток в позвоночной вене (2). Vmax 83,73 см/с.

Рис. 14. Нижняя желудочковая вена. Поперечное сканирование в проекции внутренней сонной артерии (3), наружной сонной артерии (2) и внутренней яремной вены (1). ЦДК и PW-режим. Vmax во внутренней яремной вене 41,49 см/с.

Рис. 15. Поперечное сканирование в проекции внутренней сонной артерии (1) и извитой внутренней яремной вены (2). ЦДК и PW-режим. Патологически ускоренный турбулентный поток во внутренней яремной вене до 80 см/с.

Рис. 16. Поперечное сканирование в проекции внутренней (1) и наружной (2) сонных артерий, наружной яремной вены (3). ЦДК и PW-режим. Vmax в наружной яремной вене 22,88 см/с.
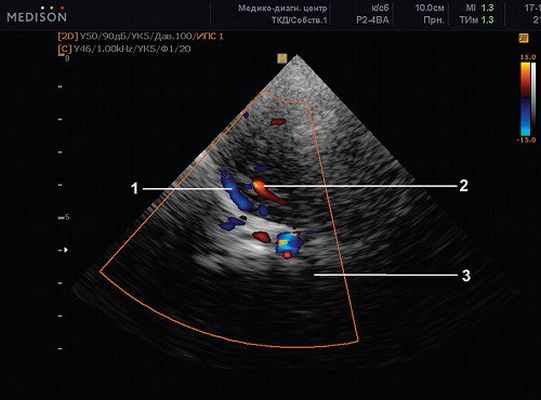
Рис. 17. Транстемпоральный доступ. Режим ЦДК на уровне СМА (2), и клиновидно-теменного венозного синуса (1). Ножки мозга (pedunculi cerebri) (3).

Рис. 18. Там же (рис. 17). ЦДК, PW-режим. Сканирование потока в клиновидно-теменном венозном синусе (1). Vmax 19,19 см/с.
Другой проблемой, стоящей перед исследователем, даже в случае когда удается оценить характер венозного кровотока на интра- и экстракраниальном уровне, является правильная трактовка полученных результатов. Поскольку имеющиеся в распоряжении литературные данные не дают целостного представления о причинах венозной дисциркуляции, а в ряде случаев в качестве основной причины ее появления указывается повышение ВЧД, либо соединительнотканная дисплазия, без указания на возможные механизмы формирования венозной дисциркуляции, польза от подобных заключений крайне мала. На тактику дальнейшего лечения также нет возможности оказать влияние, поскольку неизвестны, либо не указаны, точки возможного приложения усилий врачами разных специальностей.
О повышении ВЧД как вероятной причине венозной дисциркуляции не следует забывать, что в силу своей небольшой распространенности в популяции (0,025-0,05% среди детей и подростков) данная патология не может рассматриваться в качестве ведущей этиологической причины дисгемии и скорее всего является диагнозом исключения.
Необоснованно редко диагностируются и функциональные нарушения опорнодвигательного аппарата с формированием блоков в мелких суставах позвоночника с появлением рефлекторных болевых мышечно-скелетных синдромов, а также недооценивается роль миофасциальных болевых синдромов, при которых мышца страдает первично. Не последнюю роль в этом у детей играют те или иные повреждения шейного отдела позвоночника в анамнезе (главным образом во время родов). В литературе описывается мозаичность возникающих патогенетических факторов в затруднении оттока венозной крови из черепа. При этом ведущее место в генезе динамических расстройств венозного кровообращения принадлежит миофасциальному болевому синдрому шейной локализации. При локализации миофасциального болевого синдрома в мускулатуре краниовертебрального перехода застойные венозные расстройства обусловлены общими алгическими процессами этой зоны, включая функциональные блокады перехода, тогда как туннельно-компрессионные механизмы в этой зоне не играют определяющую роль венозной дисциркуляции. Туннельно-компрессионные механизмы затруднения венозного кровотока наиболее актуальны при средне- и нижне-шейной локализации миофасциальной боли.
Заключение
С учетом полученных нами данных о сильной корреляционной зависимости ускоренного венозного кровотока и извитости ВСА, ПА (как косвенных проявлениях нарушений в шейном отделе позвоночника, в том числе и проявлениях натальной травмы шейного отдела позвоночника), мы считаем, что у детей и подростков ключевую роль в появлении дисгемии (нарушении венозного оттока) играет "патология/особенности строения" шейного отдела позвоночника и врожденные особенности строения ВСА на экстракраниальном уровне. В качестве основных причин дисгемии в детском возрасте следует рассматривать "врожденную соединительнотканную дисплазию" [19], проявляющуюся в виде патологии шейного отдела позвоночника, с искривлением и извитостью костного канала, либо "родовые травмы с подвывихом 1-2 шейного позвонков" (наличие в анамнезе у большинства обследованных лиц), с нарушением венозного оттока на экстракраниальном уровне.
Учитывая все изложенное выше, также следует сделать вывод о том, что в случае выявления картины венозной дисциркуляции, особенно у молодых лиц, лечение должно быть направлено в первую очередь на восстановление функциональной целостности опорно-двигательного аппарата шейного отдела позвоночника, исправление осанки, мануальные практики, а также соблюдение режимно-ограничительных мероприятий [20].
Литература
- Лелюк В.Г., Лелюк С.Э. Ультразвуковая ангиология. М.: Реальное Время, 2003. 322 с.
- Valdueza J.M., Schmierer K., Mehraein S., Einhдupl K.M. Assessment of normal flow velocity in basal cerebral veins. A transcranial Doppler ultrasound study. 1996. Stroke 27. Р. 1221-1225.
- Schoser B.G., Riemenschneider N., Hansen H.C. The impact of raised intracranial pressure on cerebral venous hemodynamics: a prospective venous transcranial Doppler ultrasonography study // J. Neurosurg. 1999. V. 91, N 5. P. 744-749.
- Stolz E., Jauss M., Horning C. Cerebral venous anatomy in color-coded duplex sonography. What is possible in non-contrast enhanced TCCD? // New trends in cerebral haemodynamics and neurosonology / Eds. Kligelhofer J., Bartels E., Riglenshtein B. 1997. P. 312-319.
- Baumgartner R.W., Gonner F., Muri R. Normal haemodynamics in cerebral veins and sinuses: a transcranial color-coded duplex sonography study // New trends in cerebral haemodynamics and neurosonology / Eds. Kligelhofer J., Bartels E., Riglenshtein B. 1997. P. 312-319.
- Aaslid R. Cerebral hemodynamics // Transcranial Doppler / Eds. Newell D.W., Aaslid R.: - N.Y.: Raven, 1992. Р. 500.
- Шахнович В.А. Нарушение венозного кровообращения головного мозга по данным транскраниальной допплерографии // Ультразвуковая допплеровская диагностика сосудистых заболевания / Под. ред. Никитина Ю.М., Труханова А.И. М.: Видар, 1998. С. 355-400.
- Дическул М.Л., Куликов В.П., Маслова И.В. Ультразвуковая характеристика венозного оттока по позвоночным венам / Ультразвуковая и функциональная диагностика, 2008, N 4. С. 33-40.
- Иваничев Г.А., Долгих Г.Б. Нарушения артериального и венозного кровотока у детей с вертебрально-базилярной недостаточностью // Журнал неврологии и психиатрии, 2007, N 3.
- Долгих Г.Б., Иваничев Г.А. Церебральные сосудистые нарушения у детей с детским церебральным параличем и судорожным синдромом // Казанский медицинский журнал, 2008, N 3.
- Пуцилло М.В., Винокуров А.Г., Белов А.И. Атлас "Нейрохирургическая анатомия" / Под ред. Коновалова А.Н. М.: Антидор, 2002.
- Бурцев Е.М., Андреев А.В., Дьяконова Е.Н., Кутин В.А. Функциональная допплерография в детской ангионеврологии // Тезисы доклада на VIII Международной конференции: Современное состояние методов неинвазивной диагностики в медицине. Сочи, 2001. С. 151-160.
- Никитин Ю.М., Труханов А.И. Ультразвуковая допплеровская диагностика в клинике. МИК, 2004. 496 с.
- Adelson P.D., Bratton S.L., Carney N.A. et al. Guidelines for the acute medical management of severe traumatic brain injury in infants, children, and adolescents. Pediatr. Crit. Care Med. 2003; (4) 3.
- Samuel M., Burge D.M., Marchbanks R.J. Tympanic membrane displacement testing in regular assessment of intracranial pressure in eight children with shunted hydrocephalus // J. Neurosurg. 1998. V. 88. Р. 983-995.
- Bode H. Pediatric application of transcranial Doppler sonography / Wien; N.y.: Springer Verlag, 1988. P. 108.
- Росин Ю.А. Допплерография сосудов головного мозга у детей / СПбМАПО, 2006. 114 с.
- Белкин А.А., Алашеев А.М., Инюшкин С.Н. Транскраниальная допплерография в интенсивной терапии. Методическое пособие для врачей. Екатеринбург: Издание Клинического института Мозга СУНЦ РАМН; 2004.
- Андреев А.В., Лобанова Л.В., Ермолин И.Е. Транскраниальная допплерография и вариационная пульсометрия в диагностике церебральных ангиодистоний у детей // Журнал невропатологии и психиатрии. 1994. N 3. С. 22-23.
- Tsokolov A.V., Tsokolova V.A., Tsokolova M.A., Senchilo V.G., Egorov A.U. Venous discirculation // Journal of the Neurological Sciences. 333 (2013). e518. Abstract - WCN 2013, No102, Topic:8 - Headache. Vienne, Austria. 2013. Neurology in the age of globalization. XXI World Congress of Neurology.

УЗИ сканер HS70
Точная и уверенная диагностика. Многофункциональная ультразвуковая система для проведения исследований с экспертной диагностической точностью.
Вены позвоночного столба
Вены позвоночного столба образуют сплетения на его наружной и внутренней поверхности.
1 Наружные позвоночные венозные сплетения, plexus venosi vertehrales externi, располагаются на передней и задней поверхностях позвоночного столба. Поэтому различают: а) передние наружные позвоночные венозные сплетения, plexus venosi vertehrales externi anteriores, которые собирают кровь от передних отделов тел позвонков, передней продольной связки и прилегающих мышц (глубокие мышцы шеи); б) задние наружные венозные позвоночные сплетения, plexus venosi vertebrates externi posleriores, залегают на задней поверхности дуг, поперечных и остистых отростков; эти сплетения принимают кровь от глубоких мышц и кожи спины и позвонков.
2 Внутренние венозные позвоночные сплетения, plexus venosi vertebrates interni, находятся в полости позвоночного канала и залегают на внутренней поверхности его костных стенок, кнаружи от твердой мозговой оболочки, образуя расположенные продольно: а) передние и б) задние внутренние позвоночные венотые сплетения, plexus veno.vi vertebrate" interni anteriores et poxleriores, при этом передние образуются более крупными венами, а задние - более мелкими.
Они расположены на протяжении от затылочного отверстия до нижнего конца. Kpecтцового канала. Передние и задние венозные сплетения соединены поперечными анастомозами, образующими на уровне каждого позвонка венозные кольца. Кроме того, задние внутренние позвоночные венозные сплетения имеют соединения с задними наружными позвоночными венозными сплетениями, а внутренние передние - с наружными передними сплетениями. Эти сплетения собирают кровь от позвонков и внутренних связок и на уррвне большого затылочного отверстия находятся в соединении с затылочным венозным синусом и базилярным венозным сплетением.
3 Основные позвоночные вены идут в каналах губчатого вещества по направлению к задней поверхности тел позвонков и вливаются в plexus venosus vertebralis internus anterior. Внутренние позвоночные венозные сплетения имеют соединения с наружным передним венозным позвоночным сплетением через межпозвоночные отверстия: с позвоночными венами в шейной части, с межреберными венами - в грудной, с поясничными - в поясничной. Сплетения позвоночника соединяются со спинномозговыми венами, vv. spinales, которые находятся в мягкой мозговой оболочке спинного мозга. Отток крови от спинного мозга и сплетений позвоночника осуществляется частью через межпозвоночные вены, vv. inter-vertebrales, или непосредственно в сегментарные - vv. verte-brales, vv. intercostales, vv. lumbales, vv. sacrales laterales.
Вены сердца
Большая часть вен сердца (кроме малых и передних) приносит кровь в особый резервуар - венечный синус, sinus coro-narius, открывающийся в задний отдел полости правого предсердия, между отверстием нижней полой вены и правым предсердно-желудочковым отверстием.
Венечный синус, sinus coronarius, как бы является продолжением на диафрагмальную поверхность сердца его большой вены (см. ниже). Он располагается в левой части задней венечной борозды, на протяжении от места впадения в него сверху косой вены левого предсердия до своего устья; его длина равна 2-3 см. Над венечным синусом, перебрасывается тонкий слой мышечных пучков миокарда, за счет которого образуется также его средняя оболочка, tunica media. Отверстие венечного синуса в полости правого предсердия окаймлено заслонкой венечного синуса, valvula sinus coronarii. Две-три небольшие заслонки имеются и в самом синусе, недалеко от ее отверстия.
Большая вена сердца, v. cordis magna, начинается на передней поверхности верхушки сердца. Сначала она залегает в передней межжелудочковой борозде рядом с нисходящей ветвью левой венечной артерии. Дойдя кверху до венечной борозды, она располагается в ней и идет по нижней границе левого предсердия до левого края сердца. Обогнув левый край сердца, большая вена ложится в диафрагмальную часть венечной борозды, где и переходит без резкой границы в венечный синус. Иногда на месте перехода большой вены сердца в венечный синус имеется небольшая заслонка. В большую вену сердца впадают вены передней стенки обоих желудочков, межжелудочковой перегородки и иногда вблизи синуса - задняя вена левого желудочка.
Косая вена левого предсердия, v. obliaua atrii sinisiri, начинается на латеральной стенке левого предсердия и идет слева направо вниз, в виде небольшой веточки в складке перикарда. Направляясь вниз и вправо по задней стенке левого предсердия, она переходит в венечный синус. У устья этой вены иногда встречается небольшая заслонка.
Задняя вена левого желудочка, v. posterior ventriculi sinistri, берет начало на заднебоковой стенке левого желудочка, направляется вверх и впадает либо в большую вену сердца, либо непосредственно в венечный синус.
Средняя вена сердца, v. cordis media, начинается на задней поверхности в области верхушки сердца, ложится в задней продольной борозде рядом с межжелудочковой ветвью правой венечной артерии и впадает в правый конец венечного синуса. По пути средняя вена сердца принимает веточки от задних стенок обоих желудочков. В области вырезки сердца средняя вена сердца анастомо-эирует с большой веной сердца.
Малая вена сердца, v. cordis parva, начинается на правом крае правого предсердия и правого желудочка, ложится в заднюю часть венечной борозды и впадает либо в правый конец венечного синуса, либо самостоятельно открывается в полость правого предсердия, иногда в среднюю вену сердца.
Передние вены сердца, vv. cordis anteriores, имеют различную величину. Они берут начало в области передней и боковой стенок правого желудочка, направляются кверху и вправо к венечной борозде и впадают непосредственно в правое предсердие; в устьях передних вен иногда имеются незначительной величины клапаны.
Наименьшие вены сердца, vv. cordis minimae, группа мелких вен, собирающих кровь из различных участков сердца и открывающихся отверстиями наименьших вен, foramina venarum minimarum. непосредственно в правое и отчасти в левое предсердие, а также в желудочки.
Анатомия: Позвоночные венозные сплетения. Позвоночные вены
Ульяновский государственный университет
Роль артериовенозных взаимоотношений в формировании клинико-патогенетических вариантов гипертонической энцефалопатии
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(6): 8‑12
Белова Л.А. Роль артериовенозных взаимоотношений в формировании клинико-патогенетических вариантов гипертонической энцефалопатии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(6):8‑12.
Belova LA. The role of arteriovenous interrelations in the formation of clinical-pathogenetic variants of hypertonic encephalopathy. Zhurnal Nevrologii i Psikhiatrii imeni S.S. Korsakova. 2012;112(6):8‑12. (In Russ.).
Ульяновский государственный университет
Из 209 пациентов с хронической ишемией мозга на фоне артериальной гипертензии (гипертоническая энцефалопатия) были выделены 93 (44,5%) больных с клинико-анамнестическими признаками конституциональной флебопатии и 116 (55,5%) - без таковой. Всем пациентам проведено комплексное ультразвуковое исследование сосудистой системы головного мозга с учетом концепции ее построения на пяти функционально-морфологических уровнях. Группу контроля составили 30 человек без цереброваскулярной патологии. Выявлено, что при гипертонической энцефалопатии патологические процессы, развивающиеся на 1-м и 2-м структурно-функциональных уровнях сосудистой системы мозга (эктра- и интрацеребральные артерии), соответствуют ремоделированию, характерному для артериальной гипертензии, и не зависят от наличия конституциональной венозной недостаточности. Изменения параметров кровотока 3, 4 и 5-го структурно-функциональных уровней кровоснабжения мозга (микроциркуляторное русло, венозная система головы, яремные и позвоночные вены) у больных с гипертонической энцефалопатией формируют допплерографический паттерн церебральной венозной дисциркуляции, особенно выраженной при конституциональной флебопатии: снижение линейной скорости кровотока при пробе с нитроглицерином; более низкие значения индекса резистентности и повышение линейной скорости кровотока по поперечному синусу и вене Розенталя; недостаточность остиальных клапанов внутренней яремной вены, снижение линейной и увеличение объемной скорости кровотока по ней. Применение методологии системного подхода, основанного на клинических и инструментальных методах исследования церебральной гемодинамики, важно для оптимизации терапии у пациентов с хронической ишемией мозга.
Ульяновский государственный университет
В настоящее время в структуре смертности населения доминируют сосудистые поражения сердца, головного мозга и злокачественные новообразования [7, 12, 13]. Среди цереброваскулярных расстройств, помимо острых нарушений мозгового кровообращения (инсульты), широко распространена хроническая ишемия мозга (отечественный термин — дисциркуляторная энцефалопатия, ДЭ) [2, 8, 16], для которой характерна гетерогенность клинических, нейровизуализационных и гемодинамических показателей [4, 6, 12].
Концепция патогенетической гетерогенности ишемических поражений головного мозга основана на методологии системного подхода [6, 9, 12]. Это позволило представить сосудистую систему головного мозга в виде пяти основных структурно-функциональных уровней: 1-й — магистральные артерии головы; 2-й — экстра- и интрацеребральные артерии; 3-й — микроциркуляторное русло (МЦР); 4-й — венозная система головы (венулы, малые вены, венозные сплетения, синусы); 5-й — яремные и позвоночные вены, шейные венозные сплетения, верхняя полая вена [6, 9]. Известно, что в патогенезе ДЭ имеет значение как недостаточность притока артериальной крови к ткани мозга, так и замедление венозного оттока (ВО) [8, 13, 14, 16, 17]. В формировании венозных дисгемий участвуют исходный тонус вен, конституциональные и наследственные факторы [5, 11, 14, 17]. Учитывая многообразие патогенетических вариантов формирования сосудистой патологии мозга, актуально изучение состояния всей церебральной сосудистой системы [2, 6, 9, 12].
Цель настоящего исследования — определение роли артериовенозных взаимоотношений в формировании различных патогенетических подтипов хронической ишемии мозга на фоне артериальной гипертензии (гипертонической энцефалопатии, ГЭ) с позиции системного подхода, основанного на клинических и инструментальных методах исследования церебральной гемодинамики.
Материал и методы
Обследованы 209 пациентов с ГЭ, 69 мужчин и 140 женщин, средний возраст 52±10,7 года. Длительность течения артериальной гипертензии у включенных в исследование пациентов составила более 5 лет (12,3±7,5 года). У 70 (33,5%) больных ГЭ была I, у 87 (41,6%) — II, у 52 (24,9%) — III стадия. Также были выделены группы больных с конституциональной флебопатией (КФП) — 93 (44,5%), и без нее (НФ) — 116 (55,5%).
Критерии включения пациентов в группу с КФП: наличие нескольких объективных признаков венозной патологии (варикозное расширение и/или тромбоз вен нижних конечностей, геморрой, варикоцеле, варикозное расширение вен пищевода) и семейного анамнеза, отягощенного по венозной патологии [11, 14]. Критерием исключения из исследования являлось наличие соматических заболеваний, сопровождающихся вторичными нарушениями венозного кровообращения.
Группу контроля составили 30 человек без цереброваскулярной патологии, сопоставимых по полу и возрасту с группой пациентов.
Всем больным и лицам группы контроля проведено комплексное ультразвуковое исследование (УЗИ) сосудистой системы головного мозга с учетом концепции ее построения на пяти функционально-морфологических уровнях [14]. Исследование проводили УЗ-сканерами SSD-5500 («Aloka», Япония) и Sonoline G-60 («Siemens», Германия), датчиками с частотой 2,1—2,5 МГц и 5—12 МГц. Оценивали структурные характеристики сосуда, линейную скорость кровотока (ЛСК) — максимальную (Vmax), минимальную (Vmin), усредненную по времени (Vmed), объемный кровоток (Vvol), индекс резистентности (IR). Для исследования МЦР оценивали реактивность вен Розенталя при проведении функционально-нагрузочного теста с сублингвальным приемом 0,25 мг нитроглицерина.
Статистическую обработку данных проводили с помощью программы Statistica 6. Результаты представлены в виде среднего арифметического и стандартного отклонения (М±σ). За достоверные принимали различия при р
Результаты и обсуждение
Установлено, что клиническая и нейровизуализационная картина ГЭ зависит не только от стадии заболевания, но и наличия венозной недостаточности. Жалобы на головную боль (ГБ) предъявляли 86,1% больных. Не выявлено различий по частоте, суточной динамике, характеру ГБ между стадиями ГЭ. В то же время сравнение характера ГБ между группами пациентов с КФП и НФ показало четкое различие между ними. Больные с КФП чаще предъявляли жалобы на ночные и утренние ГБ (83,8%), что связано с длительным пребыванием в горизонтальном положении во время сна и описано в рамках синдрома «энцефалопатия пробуждения» [11]. ГБ преимущественно локализовалась в затылочной области (57,1%), куда проецируется место слияния внутричерепных венозных сосудов, либо трансформировалась в диффузную (38,4%), что можно объяснить наличием множественных анастомозов внутричерепных вен [14]. Больные характеризовали ее как ощущения «тяжести в голове» (48,4%), «головы, налитой свинцом» (26,9%), «головы, как колокол» (29,0%), «распирающей» боли (26,8%). Подобные характеристики ГБ характерны и для пациентов с внутричерепной гипертензией [14]. Существует мнение [1], что механизмом идиопатической внутричерепной гипертензии может быть повышение интракраниального венозного давления. Основными провоцирующими возникновение ГБ были факторы, ухудшающие ВО: задержка дыхания (38,4%), работа в наклонном положении (31,2%), перемена метеоусловий (10,8%), прием алкоголя (9,7%), кашель, громкая речь, смех (58,1%). ГБ уменьшалась после вставания и активизации, приема крепкого чая, контрастного душа, что может быть связано с улучшением ВО в вертикальном положении и при активизации симпатической системы [5, 11, 15, 17].
Для НФ были характерны ГБ, возникающие во второй половине дня (72,3%), после психоэмоционального напряжения (59,6%), длительного вынужденного положения головы и шеи (66,0%), «по типу обруча» (37,1%), давящие (35,3%), что соответствует описанию ГБ напряжения [1]. В настоящее время получила признание концепция мультифакторного патогенеза первичных и вторичных хронических ГБ [1, 14]. Высказано предположение, что сосудистый механизм формирования ГБ напряжения реализуется преимущественно через венозный сегмент мозгового кровообращения [1].
Жалобы на головокружение чаще предъявляли больные с НФ (71,6%) по сравнению с пациентами с КФП (63,5%). Были выявлены явные различия в характере головокружения между группами. В группе с КФП головокружение системного характера развивалось, как правило, при перемене положения тела, наклонах (88,2%), несистемного — в положении лежа (45,2%). В настоящее время доказано [18], что в развитии головокружения значение имеет нарушение оттока по венам внутреннего уха. У больных с НФ головокружение системного характера развивалось при запрокидывании и поворотах головы (80,9%), несистемного — в положении стоя (54,3%), часто на фоне повышения уровня АД (43,9%). Проведенные ранее исследования показали, что головокружение не всегда обусловлено повышением системного артериального давления (АД) и может возникать при различных заболеваниях, например при ГБ напряжения и эмоциональных расстройствах [10].
Прогрессирование ГЭ сопровождалось нарастанием жалоб на шум в голове, нарушение сна, повышенную утомляемость, снижение настроения, слабость в конечностях, поперхивание при глотании, нарушения речи. Данные жалобы были одинаково часто представлены в группах больных с КФП и НФ. В то же время у больных с КФП чаще по сравнению с НФ наблюдались характерные «венозные» жалобы [2, 8, 14]: невозможность сна на низкой подушке (65,6%); отечность лица и век (67,7%), ощущение рези и жжения в глазах в утренние часы (73,1%). Симптом «тугого воротника» встречался и у больных с КФП (58,1%), и у пациентов с НФ (48,3%), причем в группе НФ его частота нарастала по мере нарастания тяжести заболевания. При осмотре у части больных с КФП выявлялись также объективные клинические признаки церебральной венозной дисциркуляции [14]: расширение венозной сети в области висков, переносицы, передней поверхности грудной клетки, набухшие наружные яремные вены (7,5%); характерная триада симптомов — пастозность и цианоз кожных покровов лица, расширение подкожных вен на шее и лице (5,4%).
При исследовании 1-го структурно-функционального уровня сосудистой системы головного мозга одинаково часто у больных с КФП и НФ выявлялась извитость общих сонных (42,1%) и позвоночных (34,9%) артерий, атеросклеротические изменения артерий — от 37% пациентов с I стадией ГЭ до 96,3% — с III стадией ГЭ. Исследование сосудов 2-го структурно-функционального уровня включало оценку кровотока по средней мозговой артерии. При этом со стороны 1-го и 2-го структурно-функциональных цереброваскулярных уровней у больных с КФП и НФ наблюдались однотипные изменения — повышение IR при ГЭ III стадии, снижение ЛСК уже при ГЭ I стадии. Таким образом, при ГЭ на 1-м и 2-м структурно-функциональных уровнях сосудистой системы мозга происходит нарастание структурных изменений сосудов и сосудистого сопротивления и снижение ЛСК. Сопоставимая динамика показателей в группах с КФП и НФ свидетельствует о единстве патофизиологических механизмов и минимальном воздействии конституциональной флебопатии на формирование данных нарушений.
В группе больных с КФП показатели скорости кровотока по вене Розенталя и прямому синусу превышали таковые в группе контроля, а IR по сравнению с ней был ниже, что может свидетельствовать о недостаточности ВО из полости черепа и включении коллатеральных путей оттока [15].
В группе больных с НФ достоверных различий показателей от значений контрольной группы выявлено не было.
При исследовании 5-го структурно-функционального уровня сосудистой системы мозга установлено увеличение площади просвета внутренней яремной вены у всех больных с ГЭ по сравнению с контролем (p<0,001).
Ретроградный кровоток по глазничным венам, считающийся свидетельством нарушений ВО из полости черепа [9, 11, 17], в положении лежа был выявлен у 53,8% больных с КФП и 76,7% — с НФ; при проведении пробы Вальсальвы их число в группе пациентов с КФП увеличилось до 85,7% (p<0,05), а в положении сидя у 100% больных с КФП гемодинамика по глазничным венам приобрела патологический характер.
Таким образом, изменения параметров кровоснабжения головного мозга позволили объективизировать ранее клинически выявленные венозные дисгемические расстройства у пациентов с ГЭ. При ГЭ патологические процессы, развивающиеся на 1-м и 2-м структурно-функциональных уровнях сосудистой системы мозга соответствуют ремоделированию, характерному для артериальной гипертензии и не зависят от наличия конституциональной венозной недостаточности. Изменения параметров кровотока 3, 4 и 5-го структурно-функциональных уровней кровоснабжения мозга у больных ГЭ формируют допплерографический паттерн церебральной венозной дисциркуляции, особенно выраженной при КФП: снижение скорости кровотока при пробе с нитроглицерином; более низкие значения IR и повышение скорости кровотока по поперечному синусу и вене Розенталя; недостаточность остиальных клапанов внутренней яремной вены, снижение скорости кровотока и увеличение Vvol по ней. Для выявления конституциональной флебопатии у больных с ГЭ целесообразно проведение следующих функциональных проб: с нитроглицерином, Вальсальвы в горизонтальном положении с оценкой состояния остиальных клапанов внутренних яремных вен и направления кровотока по глазничным венам, оценка направления кровотока по ним в ортостазе. Применение методологии системного подхода, основанного на клинических и инструментальных методах исследования церебральной гемодинамики, способствует раскрытию закономерностей возникновения и развития ГЭ у больных как с интактными венами, так и с КФП, что важно для оптимизации терапии.
Сосудистая система позвоночника
Здесь от подключичной артерии отходят следующие ветви: позвоночная артерия, а. vertebralis, внутренняя грудная артерия, а. thoracica interna, и щитошейный ствол, truncus thyrocervicalis.
1. Позвоночная артерия, а. vertabralis (см. рис. 738, 743, 751, 752), отходит от подключичной артерии тотчас после выхода ее из полости груди. По своему ходу артерия делится на четыре части. Начинаясь от верхнемедиальной стенки подключичной артерии, позвоночная артерия направляется кверху и несколько кзади, располагается позади общей сонной артерии вдоль наружного края длинной мышцы шеи (предпозвоночная часть, pars prevertebralis).
Затем она вступает в отверстие поперечного отростка VI шейного позвонка и поднимается вертикально через одноименные отверстия всех шейных позвонков [поперечноотростковая (шейная) часть, pars transversaria (cervicalis)].

Рис. 738. Артерии головы и шеи; вид справа (полусхематично)

Рис. 743. Артерии головы и шеи; вид справа. (Нижняя и верхняя челюсти и основание черепа удалены сагиттальным распилом.)
Выйдя из отверстия поперечного отростка II шейного позвонка, позвоночная артерия поворачивает кнаружи; подойдя к отверстию поперечного отростка атланта, направляется кверху и проходит через него (атлантовая часть, pars atlantis). Далее следует медиально в борозде позвоночной артерии на верхней поверхности атланта, поворачивает кверху и, прободая заднюю атлантозатылочную перепонку и твердую оболочку головного мозга, вступает через большое затылочное отверстие в полость черепа, в подпаутинное пространство (внутричерепная часть, pars intracranialis) .
В полости черепа, направляясь на скат кверху и несколько кпереди, левая и правая позвоночные артерии конвергируют, следуя по поверхности продолговатого мозга; у заднего края мoстa мозга соединяются между собой, образуя один непарный сосуд - 6азилярную артерию, а. basilaris. Последняя, продолжая свой путь по скату, прилегает к базилярной борозде, нижней поверхности моста и у его переднего края делится на две - правую и левую - задние мозговые артерии.
От позвоночной артерии отходят следующие ветви
1. Мышечные ветви, rr. musculares, к предпозвоночным мышцам шеи.
2. Спинномозговые (корешковые) ветви, rr. spinales (radiculares), отходят от той части позвоночной артерии, которая проходит через позвоночно-артериальное отверстие. Эти ветви проходят через межпозвоночные отверстия шейных позвонков в позвоночный канал, где кровоснабжают спинной мозг и его оболочки.
3. Задняя спинномозговая артерия, а. spinalis posterior, парная, отходит с каждой стороны от позвоночной артерии в полости черепа, несколько выше большого затылочного отверстия. Направляется вниз, вступает в позвоночный канал и по задней поверхности спинного мозга, вдоль линии вступления в него задних корешков (sulcus lateralis posterior), достигает области конского хвоста; кровоснабжает спинной мозг и его оболочки.
Задние спинномозговые артерии анастомозируют между собой, а также со спинномозговыми (корешковыми) ветвями от позвоночных межреберных и поясничных артерий (см. рис. 805).
4. Передняя спинномозговая артерия, а. spinalis anterior, начинается от позвоночной артерии над передним краем большого затылочного отверстия.
Она направляется вниз, на уровне перекреста пирамид соединяется с одноименной артерией противоположной стороны, образуя один непарный сосуд. Последний спускается по передней срединной щели спинного мозга и заканчивается в области концевой нити; кровоснабжает спинной мозг и его оболочки и анастомозирует со спинномозговыми (корешковыми) ветвями от позвоночных, межреберных и поясничных артерий.
Пристеночные ветви
1. Верхние диафрагмальные артерии, аа. phrenicae superiores (см. рис. 737), всего две, отходят от передней стенки нижней части аорты и направляются к верхней поверхности поясничной части диафрагмы, анастомозируя в ее толще с ветвями нижних диафрагмальных артерий от брюшной части аорты (см. рис. 805).
2. Задние межреберные артерии (III - XI), аа. intercostales posteriores (см. рис. 765, 766), - это довольно мощные сосуды, всего 10 пар, отходят от задней поверхности грудной части аорты на всем ее протяжении. Девять из них залегают в межреберных промежутках, от третьего до одиннадцатого включительно, а самые нижние идут под XII ребрами и называются подреберными артериями, аа. subcostales.
Правые задние межреберные артерии несколько длиннее левых, так как грудная часть аорты располагается на левой поверхности позвоночного столба.
Каждая задняя межреберная артерия по своему ходу отдает спинную ветвь, r. dorsalis, а сама направляется немного вверх и идет по внутренней поверхности наружной межреберной мышцы: покрыта только грудной фасцией и париетальной плеврой. Проходит в борозде вышележащего ребра.
В области углов ребер от задней межреберной артерии отходит довольно мощная коллатеральная ветвь, r. collateralis. Она направляется книзу и кпереди, идет вдоль верхнего края нижележащего ребра, проходя между наружной и внутренней межреберными мышцами и кровоснабжая их нижние отделы.
Начиная от углов ребер, а. intercostalis posterior и r. collateralis идут по межреберью между наружной и внутренней межреберными мышцами и анастомозируют с rr. intercostales anteriores а. thoracicae internae (от а. subclavia), а первая межреберная артерия анастомозирует с а. intercostalis suprema (см. рис. 805). Концевые ветви межреберных артерий, от 7-й до 12-й, пересекают край реберной дуги и выходят между слоями широких мышц живота, кровоснабжая их и прямые мышцы живота. Они анастомозируют с ветвями верхней и нижней надчревных артерий, аа. epigastricae superior et inferior.
Задняя межреберная артерия дает латеральную кожную ветвь, r. сutаnеus lateralis, которая прободает межреберные или широкие мышцы живота и выходит в подкожный слой, а также ветви молочной железы, rr. mаmmаrii, которые отходят от 4-й, 5-й и 6-й межреберных артерий.
От начального участка задней межреберной артерии отходит спинная ветвь, r. dorsalis, которая направляется под шейкой ребра, между его связками, на заднюю (спинную) поверхность туловища; через межпозвоночное отверстие к спинному мозгу подходит спинномозговая ветвь, r. spinalis, которая в позвоночном канале анастомозирует с лежащими выше и ниже одноименными сосудами и с одноименной ветвью противоположной стороны, образуя вокруг спинного мозга артериальное кольцо (см. рис. 766). Она кровоснабжает также оболочки спинного мозга и позвонки.

Рис. 766. Межреберные артерии; вид спереди и немного сверху.
(Кожные покровы и поверхностные мышцы переднебоковой поверхности груди в пределах
III – IV ребер удалены; частично удалены правая молочная железа, париетальная плевра и внутригрудная фасция.)
Концевые стволы задних ветвей идут далее кзади, отдавая мышечные ветви. Потом каждый из концевых стволов делится на две ветви - медиальную и латеральную. Медиальная кожная ветвь, r. cutaneus medialis, кровоснабжает кожу в области остистых отростков и на своем пути дает ряд мелких веточек к длиннейшей и полуостистой мышцам. Латеральная кожная ветвь, r. cutaneus lateralis, кровоснабжает кожу боковых отделов спины, а также отдает веточки к подвздошно-реберной мышце.
Внутренностные ветви
1. Бронхиальные ветви, rr. bronchiales (см. рис. 765), всего две, реже 3-4, отходят от передней стенки начальной части грудной аорты, вступают в ворота легких и разветвляются вместе с бронхами.
Концевые веточки бронхиальных ветвей направляются к бронхолегочным лимфатическим узлам, перикарду, плевре и пищеводу.
2. Пищеводные ветви, rr. esophageales, всего 3-6, направляются к участку пищевода, где он контактирует с аортой, и разветвляются здесь на восходящие и нисходящие ветви. В нижних отделах пищеводные ветви анастомозируют с левой желудочной артерией, а. gastrica sinistra (см. рис. 805), а в верхних-с нижней щитовидной артерией, а. thyroidea inferior.
3. Медиастинальные ветви, rr. mеdiаstinаlеs, - многочисленные мелкие ветви, которые начинаются от передней и боковой стенок аорты; кровоснабжают соединительную ткань и лимфатические узлы средостения.
4. Пеpикардиальные ветви, rr. реriсаrdiасi, - мелкие сосуды, число которых варьирует, направляются к задней поверхности перикарда.
БРЮШНАЯ ЧАСТЬ АОРТЫ
Брюшная часть аорты (брюшная аорта), pars abdominalis aortae (aorta abdominalis) (рис. 767; см. рис. 693, 765, 779), является продолжением грудной части аорты. Начинается на уровне ХII грудного позвонка и доходит до IV - V поясничного позвонка. Здесь брюшная аорта разделяется на две общие подвздошные артерии, аа. aliacae communes. Место деления называется бифуркацией аорты, bifurcatio aortica. От бифуркации книзу отходит тонкая веточка, залегающая на передней поверхности крестца, - срединная крестцовая артерия, а. sacralis mediana.
От брюшной части аорты отходят два вида ветвей: пристеночные и внутренностные.
Брюшная часть аорты расположена забрюшинно. В верхней части к ее поверхности прилегают, пересекая ее, тело поджелудочной железы и две вены: лежащая вдоль верхнего края поджелудочной железы селезеночная вена, v. lienalis, и левая почечная вена, v. renalis sinistra, идущая позади железы. Ниже тела поджелудочной железы, впереди аорты, находится нижняя часть двенадцатиперстной кишки, а ниже ее - начало корня брыжейки тонкой кишки. Справа от аорты лежит нижняя полая вена, v. cava inferior; позади начального отдела брюшной аорты находится цистерна грудного протока, cisterna chyli, - начальная часть грудного протока, ductus thoracicus.
Пристеночные ветви
1. Нижняя диафрагмальная артерия, а. phrenica inferior (см. рис. 767), довольно мощная парная артерия. Отходит от передней поверхности начальной части брюшной аорты на уровне XII грудного позвонка и направляется к нижней поверхности сухожильной части диафрагмы, где отдает передние и задние ветви, кровоснабжающие последнюю. В толще диафрагмы правая и левая артерии анастомозируют между собой и с ветвями от грудной части аорты (см. рис. 805). Правая артерия проходит позади нижней полой вены, левая - позади пищевода.
По своему ходу артерия отдает 5 - 7 верхних надпочечниковых артерий, аа. suprarenales superiores. Это тонкие веточки, которые отходят от начального отдела нижней диафрагмальной артерии и кровоснабжают надпочечник. По пути от них отходит несколько мелких веточек к нижним отделам пищевода и к брюшине.

Рис. 767. Брюшная часть аорты, pars abdominalis aortae; вид спереди.
(Желудок, тонкая и толстая кишка, печень, поджелудочная железа и правая почка с мочеточником, а также париетальная брюшина и внутрибрюшная фасция, нижняя полая вена и ее ветви удалены.)
2. Поясничные артерии, aa. lumbales (см. рис. 767), представляют собой 4 парные артерии. Отходят от задней стенки брюшной части аорты на уровне тела I - IV поясничных позвонков. Направляются поперечно, в латеральную сторону, при этом две верхние артерии проходят позади ножек диафрагмы, две нижние - позади большой поясничной мышцы.
Вены позвоночного столба
Вены позвоночного столба, vv. columnae vertebralis (рис. 808. 809), образуют сплетения на его наружной и внутренней поверхностях.

Рис. 808. Вены позвоночного столба; вид сзади. (Дуги позвонков удалены; фронтальным распилом удалены задние отделы черепа.)
1. Наружные позвоночные венозные сплетения, plexиs venosi vertebrales externi, располагаются на передней и задней поверхностях позвоночного столба:
а) переднее наружное позвоночное венозное сплетение, plexus venosus vertebralis externus anterior, собирает кровь от передних отделов тел позвонков, передней продольной связки и прилегающих мышц (глубокие мышцы шеи);

Рис. 809. Вены позвоночного столба; вид слева.
(Сагиттальным распилом удалены части тел, дуг и остистых отростков двух верхних позвонков.)
б) заднее наружное венозное позвоночное сплетение, plexus venosus vertebralis externus posterior, залегает на задней поверхности дуг, поперечных и остистых отростков; эти сплетения принимают кровь от глубоких мышц и кожи спины и позвонков.
2. Внутренние позвоночные венозные сплетения, plexus venosi vertebrales interni (см. рис. 809), находятся в полости позвоночного канала и залегают на внутренней поверхности его костных стенок, кнаружи от твердой оболочки спинного мозга. Различают продольно расположенные переднее и заднее внутренние позвоночные венозные сплетения, plexus venosi vertebrales interni anterior et posterior, при этом переднее образовано более крупными венами. Эти сплетения встречаются на протяжении от затылочного отверстия до нижнего конца крестцового канала.
Передние и задние позвоночные венозные сплетения соединены поперечными анастомозами, образующими на уровне каждого позвонка венозные кольца. Кроме того, задние внутренние позвоночные венозные сплетения соединены с задними наружными позвоночными венозными сплетениями, а внутренние передние - с наружными передними.
Сплетения собирают кровь от позвонков и внутренних связок и на уровне большого затылочного отверстия соединяются с затылочным венозным синусом и базилярным венозным сплетением.
З. Базально-позвоночные вены, vv. basivertebrales (см. рис. 809), идут в каналах губчатого вещества по направлению к задней поверхности тел позвонков и впадают в plexus venosus vertebralis internus anterior.
Внутренние позвоночные венозные сплетения соединяются с наружным передним позвоночным венозным сплетением через межпозвоночные отверстия с позвоночными венами в шейной части, с межреберными венами - в грудной, с поясничными - в поясничной.
Сплетения позвоночника соединяются с передними и задними спинномозговыми венами, vv. spinales anteriores et posteriores, которые расположены в мягкой оболочке спинного мозга.
Отток крови от спинного мозга и сплетений позвоночника осуществляется через межпозвоночные вены, vv. intervertebrales, или непосредственно в сегментарные: vv. vertebrales, vv. intercostales, vv. lumbales, vv. sacrales laterales.
ПЛЕЧЕГОЛОВНЫЕ ВЕНЫ
Плечеголовные вены, правая и левая, vv. Brachiocephalicae, dextra et sinistra (см. рис. 806, 807), собирают кровь от головы, шеи и верхних конечностей.
Каждая плечеголовная вена образуется в области верхней апертуры грудной клетки, позади соответствующего грудино-ключичного сустава из двух вен: внутренней яремной вены, v. jugularis interna, и подключичной вены, v. subclavia.
Правая плечеголовная вена, v. brachiocephalica dextra, начинается позади правого грудино-ключичного сустава, спускается почти вертикально к медиальному концу I ребра, где сливается с одноименной веной противоположной стороны. Правая поверхность вены прилегает к париетальной плевре, образующей здесь купол плевры.
Левая плечеголовная вена, v. brachiocephalica sinistra, вдвое длиннее правой. От места своего образования направляется косо сверху вниз слева направо позади рукоятки грудины и почти под прямым углом сливается с правой плечеголовной веной. Своей задней поверхностью она прилегает к дуге аорты и ее ветвям. К задней поверхности вены прилегают блуждающий и диафрагмальный нервы.
В плечеголовные вены впадают:
1. Ряд небольших вен из органов средостения:
а) тимусные вены, vv. thymicae;
б) медиастинальные вены, vv. mediastinales;
в) перикардиальные вены, vv. pericardiacae;
г) пищеводные вены, vv. еsорhagеаlеs;
д) бронхиальные вены, vv. bronchiales;
е) трахеальные вены, vv.tracheales;
ж) перикардо - диафрагмальные вены, vv. pericardia cophrenicae.
2. Наивысшие межре6ерные вены, vv. intercostales supremae, левая и правая, с правой стороны собирают кровь из двух трех верхних межреберных промежутков, а слева - из трех - четырех верхних межреберных промежутков.
Правая наивысшая межреберная вена чаще впадает непосредственно в правую плечеголовную вену; левая - в левую плечеголовную вену либо в добавочную полунепарную вену; в этом случае она всегда имеет связь с плечеголовной веной.
З. Нижние щитовидные вены, vv. thyroideae inferiores (см. рис. 807), всего 1 - 3, начинаются из непарного щитовидного сплетения, plexus thiroideus impar, которое располагается на передней поверхности верхней части трахеи и нижнего отдела щитовидной железы. Это сплетение соединяется с верхними щитовидными венами, венами трахеи, гортани и пищевода.
При наличии самой нижней щитовидной вены она вливается в левую плечеголовную вену.
4. Глубокая шейная вена, v. cervicalis profunda (см. рис. 810), парная, начинается в области задней дуги атланта, над полуостистой мышцей, от наружного позвоночного венозного сплетения. Анастомозируя с

Рис. 807. Непарная вена, v. azygos, полунепарная вена, v. hemiazygos, и добавочная полунепарная вена,v. hemiazigos accessoria; вид спереди. (Париетальная плевра и брюшина, а также внутригрудная и внутрибрюшинная фасции удалены.)
затылочной веной, v. occipitalis, глубокая шейная вена следует вниз позади поперечных отростков шейных позвонков, собирает кровь от мышц затылка и иногда вливается в плечеголовную вену, а чаще в позвоночную вену, v. vertebralis.
5. Позвоночная вена, v. vertebralis (см. рис. 808, 910), парная, начинается у затылочной кости в области задней периферии большого затылочного отверстия, здесь она анастомозирует с затылочной веной.
Позвоночная вена, сопровождая позвоночную артерию, образует вокруг артерии сплетение и принимает на своем протяжении вены от венозных сплетений позвоночного столба и глубоких вен шеи. Нижний конец позвоночной вены выходит через позвоночно-артериальное отверстие VI, а иногда VII шейного позвонка, направляется вперед, проходит впереди подключичной артерии и впадает в начальный отдел плечеголовной вены. У устья вены имеются клапаны.
В позвоночную вену впадают следующие вены:
а) затылочная вена, v. occipitalis, собирает венозную кровь от подзатылочного венозного сплетения, plexus venosus suboccipitalis, расположенного в глубоких слоях мышц затылка. Может анастомозировать как с наружной яремной веной, так и с ее ветвью – задней ушной веной. Иногда, сопровождая одноименную артерию, затылочная вена впадает во внутреннюю яремную вену.
б) передняя позвоночная вена, v. vertebralis anterior, начинается от подзатылочного венозного сплетения на уровне I шейного позвонка, направляется книзу, сопровождая a. cervicalis ascendens, и впадает в конечный участок v. vertebralis;
в) добавочная позвоночная вена, v. vertebralis accessoria, дренируя позвоночное венозное сплетение, фактически дублирует v. vertebralis. Спускается вниз, проходит через отверстия поперечных отростков всех шейных позвонков, соединяясь с концевым отделом v. vertebralis.

Рис. 810. Вены головы и шеи; вид справа (полусхематично).
(Часть теменной кости удалена; видны диплоические и эмиссарные вены.)
Читайте также:
