Хемодектома височной кости на томограмме
Обновлено: 30.04.2024
Авторы: Шевчик Е.А. 1 , Свистушкин В.М. 2 , Мухамедов И.Т. 1 , Пшонкина Д.М. 1 , Золотова А.В. 1
1 ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава России
2 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
В статье представлен клинический случай сочетания гломусной опухоли яремной вены с хроническим гнойным средним отитом, осложненным холестеатомой. Приведена классификация гломусных новообразований височной кости. Особое внимание уделяется трудности своевременной диагностики гломусных новообразований данной локализации.
Для цитирования: Шевчик Е.А., Свистушкин В.М., Мухамедов И.Т. и др. Cочетание гломусной опухоли луковицы яремной вены с эпитимпанитом, осложненным холестеатомой. РМЖ. 2015;23:1420-1421.
В статье представлен клинический случай сочетания гломусной опухоли яремной вены с хроническим гнойным средним отитом, осложненным холестеатомой
Для цитирования. Шевчик Е.А., Свистушкин В.М., Мухамедов И.Т., Пшонкина Д.М., Золотова А.В. Сочетание гломусной опухоли луковицы яремной вены с эпитимпанитом, осложненным холестеатомой // РМЖ. 2015. No 23. С. 1420–1421.
Резюме: в статье представлен клинический случай сочетания гломусной опухоли яремной вены с хроническим гнойным средним отитом, осложненным холестеатомой. Приведена классификация гломусных новообразований височной кости. Особое внимание уделяется трудности своевременной диагностики гломусных новообразований данной локализации.
Ключевые слова: гломусная опухоль, яремный гломус, холестеатома.
Гломусная опухоль – доброкачественное, медленно растущее, обильно васкуляризованное, локально инвазивное новообразование, которое развивается из клеток параганглиев, ассоциированных с симпатическими и парасимпатическими ганглиями. Таким образом, гломусные опухоли можно отнести к параганглиомам. В области височной кости гломусные опухоли чаще всего локализуются в области луковицы яремной вены, а также на промонториальной стенке, исходя из тимпанального сплетения.
Несмотря на низкую распространенность данной патологии (1:300 000), среди доброкачественных новообразований среднего уха гломусные опухоли занимают 2-е место после невриномы преддверно-улиткового нерва [1–3].
Вследствие медленного роста и бессимптомного течения клинические проявления манифестируют в возрасте 40–60 лет, при этом у женщин частота встречаемости данной патологии в 3 раза больше, чем у мужчин. Существует генетическая предрасположенность к данному заболеванию. При наличии данной патологии у ближайших родственников риск развития новообразования составляет 30%. В настоящее время идентифицирован ряд генов, мутации которых приводят к повышенному риску развития параганглиом [2–4].
Гломусные опухоли локально инвазивны, в связи с чем классификация данной патологии основана на степени инвазии новообразования в окружающие структуры. При типе А параганглиома располагается в пределах барабанной полости, тип В подразумевает инвазию новообразования в клетки сосцевидного отростка. При типе С опухоль поражает инфралабиринтное пространство и распространяется в верхушку пирамиды височной кости. В этом случае наиболее важными являются взаимоотношения новообразования со стенкой внутренней сонной артерии. При типе D отмечается интра-краниальное распространение [5].
Методом выбора при лечении данной патологии является хирургическое удаление новообразования. Альтернативный способ – лучевая терапия (g-нож), которая показана людям пожилого возраста и пациентам, имеющим противопоказания для обширной операции, согласно данным литературы, позволяет замедлить или даже остановить рост гломусной опухоли [6].
Клиническая часть
Пациент Т., 55 лет, поступил в клинику болезней уха, горла и носа Первого МГМУ имени И.М. Сеченова 8.09.2015 г. с жалобами на практически полное отсутствие слуха на левое ухо, постоянный шипящий шум в этом ухе пульсирующего характера с меняющимся тембром, усиливающийся при выполнении физической нагрузки, периодическое гноетечение из левого уха.
Шум в левом ухе пациент отметил около 6 лет назад, однако к врачам не обращался, спустя 3 года слух на это ухо начал снижаться, периодически появлялось гноетечение, что заставило пациента обратиться к ЛОР-врачу в поликлинику по месту жительства. В связи с гноетечением, отсутствием болевого синдрома был поставлен диагноз «Левосторонний хронический гнойный средний отит», проводились консервативное лечение и наблюдение. Следует отметить, что на данном этапе пациенту не были рекомендованы выполнение КТ височных костей и хирургическое лечение. В течение 5 лет проводилось наблюдение, несмотря на периодическое гноетечение из левого уха.
Год назад пациент самостоятельно отметил появление новообразования в наружном слуховом проходе при выполнении туалета уха, снова обратился к врачу. Только на этом этапе было выполнено дообследование в объеме КТ и МРТ височных костей. Согласно результатам лучевой диагностики, при КТ височных костей (от 15.12.2014 г.) обнаружены признаки новообразования левой височной кости с остеолитической деструкцией (рис. 1); по результатам МРТ сосудов головного мозга от 10.04.2015 г. выявлены МР-признаки патологического участка сосудистого новообразования в области пирамиды левой височной кости, вероятнее всего – гломусная опухоль луковицы левой яремной вены.
В поликлинике по месту жительства была проведена биопсия новообразования наружного слухового прохода, результат гистологического исследования: ангиофиброма.
Пациент был направлен в клинику болезней уха, горла и носа Первого МГМУ имени И.М. Сеченова. При поступлении выполнена отомикроскопия: слева отмечался субтотальный дефект барабанной перепонки, барабанная полость заполнена образованием ярко-розового цвета, пульсирующим.
Аудиологически: левосторонняя смешанная тугоухость.
Было выполнено повторное МРТ головного мозга с контрастированием от 4.09.2015 г.: МР-картина, вероятнее всего, соответствует гломусной опухоли слева. МР-данных за очаговое поражение вещества головного мозга и мозжечка не получено.
Пациент был консультирован неврологом и нейрохирургом для исключения поражения черепно-мозговых нервов, при этом не отмечено признаков поражения блуждающего, лицевого, добавочного, подъязычного нервов, что может встречаться при гломусной опухоли данной локализации.
Было принято решение о проведении хирургического вмешательства. С учетом генеза образования предварительно 9.09.2015 г. в рентгенодиагностическом отделении ангиографии Первого МГМУ имени И.М. Сеченова под местной анестезией выполнена артериография левой наружной сонной артерии в 2-х проекциях с селективной эмболизацией гломусной опухоли. Кровоснабжение образования осуществлялось за счет затылочной и ветвей верхнечелюстной артерий.
1. Аникин И.А., Комаров М.В. Гломусная опухоль (параганглиома) уха. Современное состояние проблемы. Литературный обзор // Российская оториноларингология. 2010. № 4.
2. Havekes B., van der Klaauw A.A., Hoftijzer H.C., Jansen J.C., van der Mey A.G., Vriends A.H. Reduced quality of life in patients with head-and-neck paragangliomas // Eur J Endocrinol. 2008 Feb. Vol. 158 (2). Р. 247–253.
3. Semaan M.T., Megerian C.A. Current assessment and management of glomus tumors // Curr Opin Otolaryngol Head Neck Surg. 2008 Oct. Vol. 16 (5). Р. 420–426.
4. Jackler R.K., Brackmann D.E. Tumors of the ear and temporal bone. Philadelphia: Lippincott Williams & Wilkins, 2000. 494 p.
5. Fisch U., Mattox D. Microsurgery of the Skull Base. New York: Thieme. 1988.
6. Sharma M.S., Gupta A., Kale S.S., Agrawal D., Mahapatra A.K., Sharma B.S. Gamma knife radiosurgery for glomus jugulare tumors: Therapeutic advantages of minimalism in the skull base // Neurol India. 2008 Jan-Mar. Vol. 56 (1). Р. 57–61.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Хемодектомы шеи
Хемодектомы шеи - опухоли мягких тканей, развиваются из рецепторных клеток параганглиев, ими представлено 18% внеорганных опухолей шеи и 40% всех внеорганных опухолей.
Источник хемодектом - каротидное тельце (гломус). Первое описание в 1748 г. Heller, гистологическое исследование в 1862 г. Luchka. В результате эмбриональных исследований известно, что мезенхимальная основа каротидного гломуса закладывается из адвентиции бифуркации сонной артерии. Это является причиной слияния капсулы каротидного гломуса и исходящих из него опухолей с адвентицией сосудов. Каротидный гломус имеет размеры 3-7 мм, находится позади или у края внутренней сонной артерии. Его тельце представлено полигональными клетками с круглыми ядрами типа эпителиоцитов, отделенные друг от друга кровеносными синусоидами, окруженные сплетениями нервных волокон. Таким образом, каротидное тельце это конгломерат артериовенозных анастомозов (Roos, 1959). Каротидное и югулярное тельца (нехромаффинные параганглии) являются единой морфологической и функциональной системой. Иннервацию каротидного гломуса осуществляет нерв Геринга (ветвь языкоглоточного нерва). Нехромаффинные параганглии также встречаются в ganglion nodosum блуждающего нерва, луковице яремной вены, клетчатке орбиты, в области дуги аорты, около устья брыжеечной артерии, у основания черепа. Кроме того существуют крылонебный, окологлоточный и надключичный гломусы.
Нехромаффинным параганглиям присуща хеморецепторная функция: при дефиците кислорода рефлекс с параганглия приводит к стимуляции дыхания, повышению АД, секреции АКТГ, глюкокортикоидов, адреналина, инсулина, повышению числа эритроцитов периферической крови. Именно хеморецепторная функция явилась причиной появления термина хемодектома, предложено было Mulligan в 1950 г.
Впервые опухоль каротидного тельца описана в 1891 г. Marchand у женщины 32 лет, при ее удалении были перевязаны сонные артерии, пациентка умерла после операции. В 1889 г. произведена первая успешная операция по удалению опухоли каротидного тельца доктором Albert без перевязки сонных артерий. Было установлено, что строение опухоли повторяет нормальную гистологическую структуру каротидного тельца.
Хемодектома блуждающего нерва впервые описана Stout в 1935 г., первое описание в отечественной медицине в 1959 г. А. С. Лурье.
По гистологическому строению хемодектомы являются доброкачественными, однако, в 5-30% злокачественное течение заболевания (Фалилеев Г.В., 1978; Подвязников CO., Кропотов М.А., 1991; Fachinetti P. et al., 1991): наличие рецидивов и метастазов (Матякин Е.Г., 1995; Sauter E. et al, 1991). Хемодектомы имеют медленно прогрессирующий рост, в 36 % случаев при наличии злокачественности обнаруживают метастазы в регионарные лимфатические узлы и в 41 % — в отдаленные, преимущественная локализация в позвоночнике и легких (Подвязников CO., Кропотов М.А., 1991). Процесс метастазирования обычно протекает бурно.
Чаще хемодектомы встречаются у пациентов старше 40—50 лет, у мужчин и женщин с одинаковой частотой (Torres-Patino F. et al., 1991; Rossi P. et al., 1994). В 5—10 % хемодектомы обнаружены у членов одной семьи (Sobol S. et al., 1990; Ridge B. et al., 1993; Rossi P. et al., 1994). У пациентов с наследственными хемодектомами множественное поражение наблюдается в 27—87%, а при отсутствии семейного анамнеза — примерно в 3 % случаев (Ridge В. et al., 1993; Lajtman Z. et al., 1994; Netter-ville J. et al., 1995).
Анатомической особенностью расположения хемодектом является их тесная взаимосвязь с сонными артериями, черепными нервами, основанием черепа и глоткой. Кровоснабжение сонные артерии, щитошейный ствол, позвоночные артерии.
Для роста хемодектом характерна значительная инфильтрация близлежащих тканей, особенно адвентиции сонных артерий, а при хемодектомах блуждающего нерва — периневральных элементов. Хемодектомы обычно циркулярно обрастают сонные артерии, имеют тенденцию к распространению вдоль сосудистого пучка к основанию черепа.
Клиника каротидных хемодектом
Чаще всего единственной жалобой является обнаруженное объемное образование. Реже пациенты жалуются на головную боль, боль и болезненность в области опухоли, головокружение. Иррадиация боли возможна в висок, зубы и надплечье. Иногда встречаются неврологические проявления: осиплость голоса, кашель, затруднение глотания, обусловленные давлением на близлежащие нервы (чаще всего на блуждающий нерв). При гормонально-активных опухолях отмечается общая слабость, быстрая утомляемость, бессонница.
Типичная локализация: на боковой поверхности шеи, ниже угла нижней челюсти, в зоне сонного треугольника, реже в зачелюстной ямке. Опухоль может контурировать в виде припухлости, покрытой неизмененной кожей, обычно безболезненна, плотной или плотноэластической консистенции, с гладкой поверхностью. При пальпации пульсация на передней или наружной ее поверхности, выражена более интенсивно, чем на противоположной стороне. Аускультативно над опухолью в 5—10 % случаев выслушивается систолический шум. Особенностью хемодектом является заметная смещаемость в горизонтальном направлении и ограниченная в вертикальном направлении. Отвести опухоль от пульсирующей артерии невозможно. При надавливании на опухоль возможно кратковременное коллаптоидное состояние (бледность кожных покровов, падение АД) вследствие раздражения каротидного синуса. Для каротидных хемодектом типичен медленный рост. При длительном течении опухоли могут достигать значительных размеров, возможно сдавление и оттеснение гортани и глотки. Злокачественный вариант встречается довольно редко; метастазы располагаются, как правило, вблизи образования в виде инкапсулированного узла.
Клиника вагальных хемодектом
Вагальные хемодектомы образуются из параганглионарной (хеморецепторной) ткани нодозного узла блуждающего нерва, располагающегося вблизи от яремного отверстия. К нодозному ганглию интимно прилежат ВСА, внутренняя яремная вена, подъязычный и языкоглоточный нервы.
Пациенты предъявляют жалобы на наличие опухолевидного образования в подчелюстной области. Субъективно отмечают чувство инородного тела в глотке, изменение тембра голоса, реже затруднение при глотании. Неврологические проявления при вагальных хемодектомах более существенны, чем при каротидных. Чаще это триада Горнера (птоз, миоз, энофтальм). Возможны также симптомы, связанные с выпадением функции блуждающего, подъязычного и языкоглоточного нервов.
Обычно вагальные хемодектомы локализуются на боковой поверхности шеи под углом нижней челюсти. Верхний полюс не определяется, так как уходит в зачелюстную ямку в парафарингеальное пространство. Для вагальных хемодектом типично выпячивание боковой стенки глотки с отклонением мягкого неба и языка вперед и медиально. Слизистая оболочка при этом не изменена, смещается над опухолью. На слизистой могут быть видны многочисленные извитые сосуды диаметром до 1 мм. При других объемных образованиях, распространяющихся в парафарингеальное пространство, подобный симптом отсутствует. Пульсация сонных артерий над опухолью определяется редко. Верхний полюс опухоли может достигать основания черепа, а нижний развилки ОСА. ВСА обычно соприкасается с медиальной поверхностью опухоли и на 30—40 % окружена опухолью.
Также характерен медленный рост. Однако, в отличии от каротидных хемодектом, более частое озлокачествление с агрессивным инфильтративным ростом по отношению к окружающим тканям, особенно к сонным артериям и нервам. При прогрессировании рост опухоли происходит в сторону основания черепа и височной кости.
Регионарные метастазы вагальных хемодектом располагаются вблизи основной опухоли и часто составляют с ней единый конгломерат. Отдаленные метастазы локализуются в позвоночнике и легких.
Хемодектомы атипичной локализации располагаются на боковой поверхности шеи вблизи сосудисто-нервного пучка, но вне его фасциального футляра, отличаются упорным местным рецидивированием и более частым метастазированием.
Обследование: цветное дуплексное сканирование, ультразвуковая допплерография, компьютерная томография, включая спиральную, рентгеноконтрастное исследование сосудов, транскраниальная допплерография, бронхоскопия.
При анализе результатов исследований обращают на топографию сонных артерий и их взаимоотношение с опухолью, протяженность поражения сосудов и степень их обрастания, расположение верхнего полюса опухоли, состояние дистальной части ВСА, характеристику (качественную и количественную) кровотока по сонным артериям.
Дифференциальный диагноз.
Внеорганные новообразования шеи схожи по своим клиническим проявлениям. Нередко единственным симптомом является наличие опухоли на шее. Боли, компрессионные синдромы и неврологическая симптоматика наблюдаются редко. Все это затрудняет дифференциальную диагностику. Диагностические ошибки довольно типичны: чаще при первичном обращении ошибочно диагностируется лимфаденит, что связано с редкостью внеорганных опухолей шеи и недостаточной осведомленностью докторов в этой патологии, ложной связью обнаруженной опухоли с воспалительными явлениями (кариес, хронический тонзиллит, фарингит и др.).
При обнаружении опухоли на шее, особенно солитарной, в первую очередь необходимо исключить метастатический генез, гемобластоз.
Неспецифические лимфадениты чаще наблюдаются у детей при хронических воспалительных заболеваниях кожи лица и головы, слизистой оболочки рта, верхних дыхательных путей. При этом лимфоузлы обычно увеличены, плотноваты, множественны, безболезненны; признаки периаденита отсутствуют. Необходимо дифференцировать от метастазов в лимфатические узлы шеи и лимфоретикулярных поражений. Метастатические лимфатические узлы более плотные, округлые. Окончательный диагноз обычно ставят при цитологическом или гистологическом исследовании.
Специфический хронический лимфаденит при туберкулезе и сифилисе. Туберкулезное поражение чаще двустороннее, характерно изменение подчелюстных и яремных узов. На ранних стадиях плотные, подвижные, безболезненные, не спаяны между собой и с окружающими тканями. Затем приобретают вид пакета, нарастают явления периаденита, могут появляться абсцессы и свищи.
Хемодектомы шеи и невриномы, локализованные вблизи сонных артерий, в первую очередь следует дифференцировать с аневризмами сонных артерий. При аневризме определяется более четкая пульсация и систолический шум, характерно отставание пульсовой волны на височной или лицевой артерии, что при хемодектомах отсутствует.
Кроме того, хемодектомы данной локализации следует отличать от неврином блуждающего или подъязычного нервов и солитарных метастазов. При невриномах, расположенных в непосредственной близости к сонным артериям, иногда возможно ощутить передаточную пульсацию. Дифференциальной диагностике способствуют попытки отведения опухоли от сосудов, которая возможна при невриномах, а при хемодектомах образование смещается только вместе с сосудом.
Наибольшую трудность для дифференциальной диагностики представляют образования парафарингеального расположения. Их следует дифференцировать от злокачественных опухолей ротоглотки, чаще опухолей миндалин. Для рака миндалин характерны боли, неловкость при глотании, ощущением инородного тела. При осмотре: изъязвленная кровоточащая опухоль. Это крайне важно, так как при парафарингеальных опухолях не бывает изъязвления слизистой оболочки.
Также представляют значительные трудности в дифференциальной диагностике первично-множественные опухоли. Чаще обнаруживаются комбинации опухолей щитовидной железы с хемодектомами, невриномами, лимфосаркомой. В этих случаях солитарные опухоли на шее принимают за метастазы рака щитовидной железы.
При сборе анамнеза следует обращать внимание на длительность развития заболевания, темп роста образования, на наличие опухоли ранее, метастазом или рецидивом которой может быть обнаруженная в настоящее время опухоль.
Исследование групп лимфатических узлов проводится последовательно, целесообразно осуществлять пальпацию со спины пациента, при этом четче определяются все анатомические структуры в надключичной области и вдоль сосудистого пучка.
При парафарингеальной локализации используют бимануальную пальпацию. Ее следует проводить при расслаблении мышц шеи (голова исследуемого наклонена вперед), а также в положении лежа с валиком под плечами, голова повернута в сторону. Это дает возможность определить локализацию, взаимоотношение опухоли с магистральными сосудами.
Важное значение в дифференциальной диагностике внеорганных новообразований шеи имеет их локализация: для неврином и ганглионеврином характерно расположение в парафарингеальной зоне, нейрофибром — в боковых отделах шеи, липом — в боковом треугольнике или надключичной области, лимфангиом — вдоль кивательной мышцы или над ключицей, десмоида — вблизи мышечных массивов плечевого пояса и в нижнебоковых отделах шеи, срединной кисты и опухоли щитоязычного протока — строго по средней линии шеи, вблизи подъязычной кости.
Из методов лабораторной диагностики важное значение при диагностики гемобластозов имеет клинический анализ крови.
Обзорную рентгенографию в обязательном порядке проводят при пальпируемых плотных, неподвижных небольших образованиях в надключичной области для исключения шейных ребер и вторичных поражений костей. Рентгенологическое обследование также дает возможность выявить наличие известковых включений (симптом отсутствует при хемодектомах, метастазах рака, липомах).
Важнейшее место в дифференциальной диагностике различных внеорганных опухолей шеи занимает ультразвуковое исследование. В В-режиме метастазы в лимфатические узлы имеют неоднородную структуру, капсулу толщиной до 2 мм, невриномы — изоэхогенную однородную структуру без выраженной капсулы, кисты - гипоэхогенную структуру с наличием мелкодисперсного жидкого содержимого и капсулу толщиной до 1.5 мм. Кровоток по сонным артериям характеризуется отсутствием локального повышения скорости, что свидетельствует о неизменности гемодинамики. В 30 % случаев определяют гемодинамически значимую компрессию яремной вены. Сосудистый рисунок неврином чаще представлен множеством сосудов, преимущественно артериями, диаметром до 2.2 мм с коллатеральным типом кровотока, в шванноме сосуды с венозным характером кровотока, внутри кист сосудистый рисунок не выражен.
Безусловно ангиография помогает в дифференциальной диагностике внеорганных новообразований шеи. Ангиографическая картина при метастатических опухолях характеризуется смещением оси сонных артерий в трех направлениях — кнутри, кпереди и кзади. Чаще сонные артерии отклоняются медиально, смещения сонных артерий кнаружи не бывает. В 20 % случаев выявляется компрессия ОСА или ВСА. Метастатические образования обычно прилегают к сонным артериям в области бифуркации ОСА, реже в начальных отделах ВСА и НСА. Известны единичные случаи циркулярного расположения метастатических опухолей вокруг сонных артерий. Чаще опухоль спаяна с наружной стенкой артерии.
При лимфоретикулярных опухолях шеи (лимфогранулематоз, ретикулосаркоматоз) характерна локализация сонных артерий медиально по отношению к опухоли, поэтому на ангиограммах определить их ход не представляется возможным.
Наиболее частая локализация образований в области бифуркации ОСА при метастатических образованиях объясняется несколькими причинами: находящимся вблизи бифуркационным лимфатическим узлом, в который чаще метастазируют опухоли головы и шеи, а также фиксацией развилки ОСА ветвями НСА.
Признаки опухолей черепных нервов на ангиограммах:
• при невриномах, исходящих из блуждающих нервов, в прямой проекции характерно отдавливание сонных артерий кнаружи, в боковой — кпереди
• при опухолях симпатического ствола (невролейомиомы, неврофибромы) в прямой проекции бифуркация ОСА, ВСА и НСА оттеснены новообразованием кнаружи в латеральном направлении, в боковой — ВСА смещена кзади, а НСА — кпереди
• при опухолях из сосудов (ангиофибромы) в прямой проекции отклоняют ВСА кнаружи, а в боковой — кпереди
• при синовиальной саркоме смещение в прямой проекции дистального отдела ОСА и начального отдела ВСА кпереди и в боковой латерально.
Лечение.
Консервативное лечение хемодектом шеи малоэффективно: полное излечение при лучевой терапии достигается только в 23 %, а частичное улучшение — в 54 % случаев (Valdagni R., Amichetti M., 1990; Dinges S. et al., 1993). Поэтому отдают предпочтение радикальному удалению опухоли (Матякин Е.Г., 1995; Kogel H. et al., 1991; Williams M. et al., 1992). Хирургическая тактика дает хорошие результаты в 93—96 % случаев (Kraus D. et al., 1990; Van-der-Mey A. et al, 1992).
До середины 50-х годов прошлого века смертность при хирургическом лечении каротидных хемодектом достигала более 30 %, а среди выживших инвалидность вследствие афазии, гемипарезов, параличей каудальной группы черепных нервов до 50 %.
Расположение хемодектом в непосредственная связи с сонными артериями обусловливает сложность и опасность оперативного лечения, что в 28—43 % случаев определяет необходимость реконструкции сонных артерий (Lee-lamanit V. et al, 1993). Операция выбор удаление новообразования с сохранением проходимости внутренней сонной артерии.
Важные условия хирургического вмешательства:
- определение толерантности больного к пережатию сонной артерии путем оценки функциональных возможностей виллизиева круга: в дооперационном периоде транскраниальная допплерография, тест на пережатие сонной артерии, в интраоперационном — транскраниальная допплерография, измерение ретроградного давления в общей сонной артерии
- эндотрахеальный наркоз
- широкий доступ: по внутреннему краю кивательной мышцы, при распространении в парафарингеальное пространство — от сосцевидного отростка до края хрящей гортани (дугообразный) с пересечением двубрюшной мышцы в сухожильной части, при необходимости НС;
- по показаниям резекция, пластика или протезирование ВСА; техника операций не отличается от аналогичных на брахиоцефальных сосудах
Отдаленные результаты, прогноз.
Показатели 5-летней выживаемости после хирургического лечения каротидных и вагальных хемодектом составляют 93—99 %, атипичных (учитывая в 100 % случаев злокачественный вариант течения болезни) — 50-61 %.
Параганглиомы
В практике применения ГН имеют значение яремная и тимпаническая гломусные опухоли.
Что такое гломусная яремная опухоль?
Некоторые авторы рассматривают гломусные опухоли как категорию, которую можно разделить на 2 подгруппы: яремные и тимпанические гломусы. Гломусные опухоли в целом являются редкими (0,6% от всех опухолей головы и шеи), однако, тимпанический гломус является самой частой опухолью среднего уха и часто пациенты обращаются с ними к отохирургам. Яремные гломусы происходят из гломусных телец, обычно в области луковицы яремной вены и распространяются вдоль сосудов. Могут иметь пальцевидные выросты в яремную вену (которые могут стать причиной эмболии во время резекции). Яремные параганглиомы очень богаты сосудами, основное кровоснабжение происходит из наружной сонной артерии с дополнительным питанием из каменистой части внутренней сонной артерии. Эти опухоли обычно содержат секреторные гранулы (даже если они являются функционально неактивными) и могут активно секретировать катехоламины, аналогично феохромоцитоме (в 1-4% случаев яремных гломусов). В функционально активных опухолях будет повышен норэпинефрин, т.к. им не хватает метилтрансферазы для превращения его в эпинефрин. Напротив, могут выделяться серотинин и калликреин, что может вызывать карциноид-подобный синдром (сужение бронхов, гипертония, гепатомегалия и гипергликемия).
Какие симптомы могут соответствовать параганглиоме?
Обычно клинические проявления выражаются в потере слуха и пульсирующем звоне в ухе. Третьим по частоте симптомом является головокружение. Также возможна боль в ухе. Потеря слуха может носить кондуктивный (напр., из-за закупорки слухового канала) или нейросенсорный характер (из-за внедрения в лабиринт), что часто сопровождается головокружениеями (наиболее часто вовлекаемым черепно-мозговым нервом является VIII). Встречаются различные сочетания поражений IX, X, XI и XII ЧМН, иногда бывает паралич VII нерва (обычно за счет вовлечения в канале лицевого нерва в пирамиде височной кости). При обширных поражениях, которые вызывают сдавление ствола мозга, могут быть атаксия и/или гидроцефалия. Иногда симптомы могут быть обусловлены выделением продуктов секреции опухоли, что может проявляться гиперадреналовыми кризами, бронхоспазмами и другими симптомами.
Какие методы диагностики применяются при подозрении на параганглиому?
Отоскопическое исследование может выявить пульсирующую красно-синюю массу за барабанной перепонкой, при тимпаническом характере опухоли (иногда ЛОР-врачи, к сожалению, пунктируют ее для биопсии, что может привести к массивному кровотечению).
Эндокринные исследования. Для определения секреции катехоламинов в суточном анализе мочи определяют ванил-манделиевую кислоту, метанефрины и общий уровень катехоламинов.
Компьютерная томография используется для того, чтобы определить расположение и распространенность опухоли. Спиральная КТ в костном режиме с тонкими срезами (0.5-1 мм) лучше помогает оценить литическое действие опухоли на костные структуры основания черепа в виде расширения яремного отверстия, барабанной полости и др. СКТ в режиме перфузии выявляет объемное образование со скоростью кровотока близкой к таковому в яремной вене, что помогает дифференцировать параганглиому от других видов опухолей данной локализации.
Магнитно-резонансная томография без контраста и с контрастом, в т.ч. с подавлением сигнала от жировой ткани, помогает определить не только внутричерепной рост, но и внечерепное распространение в мягкие ткани шеи по ходы сосудисто-нервного пучка.
Ангиография выявляет выраженную сосудистую сеть опухоли, что помогает исключить, например, невриному слухового нерва; позволяет оценить состояние противоположной яремной вены на тот случай, если при операции придется пересекать яремную вену на стороне поражения; обычно луковица яремной вены и/или сама вена частично или полностью окклюзированы. Проведение ангиографии оправдано в случае подготовки к операции, для одномоментного проведения эндоваскулярной эмболизации.
Какие методы лечения параганглиом наиболее эффективны?
Медикаментозное лечение параганглиом, активно продуцирующих катехоламины, консервативное лечение является эффективной паллиативной мерой, а также вспомогательным методом при подготовке к проведению эмболизации или хирургического вмешательства. Назначение альфа- и бета-блокаторов перед эмболизацией или операцией позволяет предотвратить угрожающие жизни больных колебания АД и аритмии.
Лучевая терапия в настоящее время, утратила свое значение ввиду невысокой эффективности и выраженных побочных эффектов. В целом, может ослабить симптомы и замедлить рост опухоли. При очень больших опухолях, или при невозможности хирургии или радиохирургии, рекомендуются стереотаксическое облучение в дозе 40-45 Гр в виде сеансов по 2 Гр, либо ≈35 Гр в виде 15 сеансов по 2,35 Гр, что также показало свою эффективность, но при этом было меньше побочных эффектов. В качестве основного метода лечения параганглиомы обычно используется только при больших опухолях. В последнее время накапливается опыт гипофракционированной радиотерапии, об эффективности и отдаленных результатах которой судить еще рано
Эндоваскулярная эмболизация обычно используется при больших опухолях, при благоприятных вариантах кровоснабжения (напр., при наличии сосудов, которые можно эмболизировать селективно без угрозы попадания эмболов в нормальный мозг), однако имеет свои особенности:
- постэмболизационный отек опухоли может приводить к увеличению давления на ствол мозга или мозжечек
- при эмболизации активно секретирующих опухолей требуется осторожность, т.к. в результате инфаркта опухоли возможен выброс вазоактивных веществ (напр., эпинефрина)
- у больных, которым нельзя осуществить хирургическое лечение, ее можно использовать в качестве основного лечения. Но в этом случае эмболизация будет только временной паллиативной мерой, т.к. через какое-то время кровоснабжение опухоли восстанавливается и рост продолжается.
Хирургическое лечение. При небольших опухолях, располагающихся только в среднем ухе, хирургическая резекция является несложным, эффективным методом лечения, выполняемом отохирургами. Роль хирургического лечения при больших опухолях, которые внедряются в кость и разрушают ее, не определена. В этих случаях проведение операции чревато множественными параличами черепно-мозговых нервов, а также связано с возможностью возникновения опасного кровотечения, что обычно приводит к частичной резекции. Рекомендуется проведение операции группой хирургов, состоящей из нейрохирурга, отохирурга, а также специалиста по хирургии головы и шеи. При этом используется подход к основанию черепа через шею. Сначала перевязывают питающие сосуды из системы наружной сонной артерии, а затем быстро дренажные вены (для того, чтобы предотвратить системное действие выделяющихся катехоламинов). Пересечение яремной вены переносится нормально, если противоположная вена проходима. Даже после проведения тотальной резекции рецидивы могут быть ≈ в ⅓ случаев.
Наиболее частыми осложнениями являются образование ликворной фистулы в основании черепа, нарушения мимики, дизартрия и дисфагия различной степени в результате нарушения функций черепно-мозговых нервов (VII-XII). Значительная кровопотеря сопровождает практически все операции по удалению яремных параганглиом, что требует серьезной предварительной подготовки со стороны нейроанестезиологов и нейрореаниматологов. Во время хирургического вмешательства на этих опухолях может происходить также выброс гистамина и брадикинина, что вызывает гипотонию и бронхоспазм, что также требует предварительной предоперационной подготовки и своевременных действий во время операции.
Радиохирургия. Применение Гамма-ножа является высокоэффективным методом лечения небольших яремных и тимпанических параганглиом. Безрецидивная 5-летняя и 10-летняя выживаемость составляют 96 и 91%, соответственно. Дисфункция 7 чмн встречается примерно в 0.5-1% случаев, снижение слуха после радиохирургии – 1.2-1.5%, дисфункция каудальных нервов с развитием дизартрии и\или дисфагии
Хемодектома височной кости на томограмме
Хемодектома височной кости на томограмме
Хемодектомы (или параганглиомы) возникают из параганглиотической гломусной ткани (хеморецепторов). Четыре основные локализации: яремная ямка (яремные гломусные опухоли), барабанная полость (тимпанальные гломусные опухоли), бифуркация сонной артерии (каротидные гломусные опухоли) и нижний ганглий (ganglion nodosum) блуждающего нерва (вагусный гломус). В этой статье рассмотрены только две первые.
а) Опухоли тимпанального гломуса. Опухоли тимпанального гломуса возникают в барабанной полости над промонториумом из гломусной ткани, расположенной в адвентиции сосудов вдоль тимпанальной ветви (нерва Якобсона) языкоглоточного нерва и аурикулярной ветви (нерва Арнольда) блуждающего нерва.
Аксиальные и коронарные срезы КТ демонстрируют хорошо дифференцированные контрастные мягкотканые структуры различных размеров в нижней части барабанной полости и прилегающие к промонториуму. Дно барабанной полости и яремная ямка обычно интактны. По мере роста опухоли происходит заполнение барабанной полости, ведущее к выпячиванию барабанной перепонки и сглаживанию промонториума. Распространяясь кзади, опухоль может заполнять сосцевидный отросток, а книзу клетки гипотимпанума и яремную ямку.

Тимпанальный гломус: А. Аксиальная, Б. Коронарная КТ.
Четко ограниченное мягкотканое образование хорошо видно в нижней части барабанной полости, прилегающей к промонториуму.
б) Опухоли яремного гломуса. Опухоли яремного гломуса возникают из параганглиев яремной ямки и луковицы яремной ямки. Яремная ямка обычно расширена с эрозией кортикального слоя и костной перегородки, отделяющей ее от нормального отверстия сонного канала.
Ассиметрия яремной ямки и луковица яремной вены без эрозии кортикальной пластинки являются довольно частой анатомической вариацией и не имеют клинического значения. При разрушении нижней стенки гипотимпанума опухоль распространяется в барабанную полость, а оттуда в наружный слуховой проход. Латеральное распространение опухолевого процесса в сосцевидный отросток часто ведет к эрозии стенок канала лицевого нерва и повреждению нервного ствола.
Медиальное прорастание, вначале ведет к «подрытию» задней нижней части пирамиды, а затем собственно разрушению перилабиринтной кости и верхушки пирамиды. Прочная капсула лабиринта вовлекается редко. Внутричерепное распространение часто наблюдается при больших опухолях, хотя обычно опухоль остается экстрадуральной. Экстракраниальное распространение может наблюдаться по ходу яремной вены.
КТ-исследование является идеальным для выявления кост-ных изменений, типичных для опухолей яремного гломуса. Тем не менее, МРТ является методом выбора, более точным в определении и размеров опухоли, особенно при интракраниальном, экстракраниальном и интраваскулярном росте.
Опухоль выглядит как массив с сигналом средней интенсивности в режиме Т1 и становится светлее в режиме Т2 при контрастном усилении. Зернистость области сигнала вызвана кровеносными сосудами внутри опухоли. Вовлеченность яремной вены и сонной артерии оценивается легко, поскольку эти сосудистые образования хорошо видны на МРТ, что позволяет воздержаться от более инвазивных сосудистых исследований.
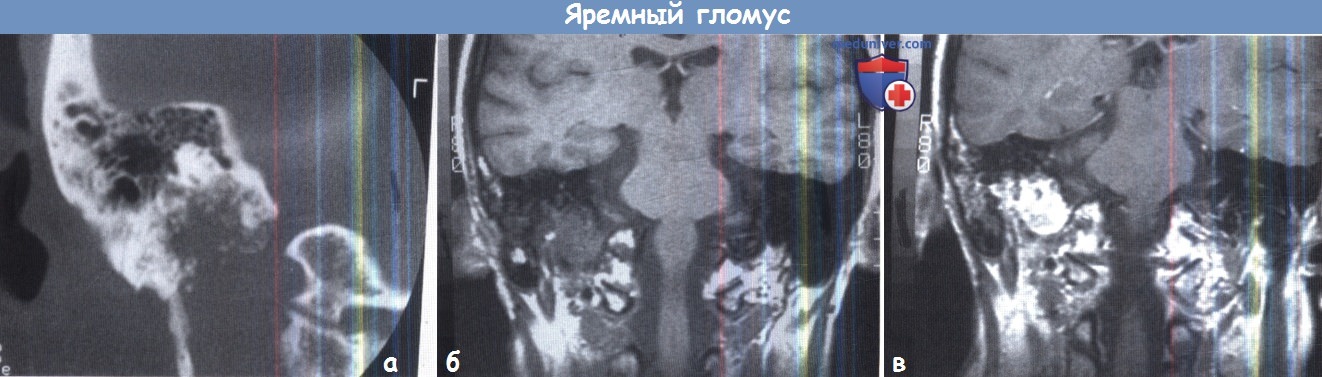
Яремный гломус: А. Коронарная КТ; Б. и В. коронарная МРТ в режиме Т1 до и после контрастирования.
Правая яремная ямка выглядит увеличенной с эрозированным контуром.
МРТ демонстрируют массив средней интенсивности сигнала, усиливающийся при контрастировании.
Обратите внимание на участки выпадения сигнала, образованные кровеносными сосудами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Международный неврологический журнал 5 (51) 2012
Каротидная хемодектома: клинический случай с благоприятным исходом после резекции общей сонной артерии

Авторы: Кушнир Г.М., Иошина Н.Н., Савчук Е.А., Микляев А.А.- ГУ «Крымский государственный медицинский университет имени С.И. Георгиевского», г. Симферополь; Кузина О.С., Мешкова С.В. - 7-я городская клиническая больница, г. Симферополь
Версия для печати
В статье приводится описание клинического случая развития гигантской хемодектомы каротидной локализации и проведенного оперативного лечения с резекцией ствола сонной артерии. На примере послеоперационного неврологического статуса показательны значительные компенсаторные возможности коллатерального кровообращения головного мозга.
У статті наводиться опис клінічного випадку розвитку гігантської хемодектоми каротидної локалізації і проведеного оперативного лікування з резекцією стовбура сонної артерії. На прикладі післяопераційного неврологічного статусу є показовими значні компенсаторні можливості колатерального кровообігу головного мозку.
The article describes the clinical case of development of giant carotid chemodectoma and operative treatment with carotid artery trunk resection. Through the example of postoperative neurological status the significant compensation abilities of collateral circulation are shown.
каротидная хемодектома, синкопальные состояния, резекция сонной артерии.
каротидна хемодектома, синкопальні стани, резекція сонної артерії.
carotid chemodectoma, syncope, carotid artery resection.

Хемодектомы (ХД) относятся к группе нейроэктодермальных опухолей (син. — параганглиомы, гломусные опухоли), которые в большинстве случаев являются доброкачественными, мягкотканными, медленно растущими, развивающимися из нехромаффинных ганглиев, разбросанных по организму в виде шаровых скоплений (гломусов) нейрорецепторных клеток, преимущественно в адвентициальной ткани артерий и вен крупного калибра. Наиболее крупные нехромаффинные ганглии, имеющие органоидный тип строения, располагаются в области головы и шеи. Наиболее часто ХД располагаются в каротидном синусе (каротидный гломус, каротидное тельце, каротидный параганглий), яремной зоне, височных областях. Реже их обнаруживают в забрюшинном пространстве, в параселлярной области, носоглотке, придаточных пазухах носа, на основании черепа, конском хвосте и ногтевых ложах пальца (опухоль Барре — Массона). ХД значительно беднее нервными волокнами, чем ткань каротидного гломуса, и хромаффинных клеток не содержит. В последние годы с помощью нейровизуализационных методик показано, что этот вид опухолей встречается чаще, чем распознается. С возрастом их частота увеличивается. Чаще болеют женщины (соотношение женщин и мужчин 3 : 1) в возрасте от 20 до 50 лет. Следует также отметить, что опухоль может приобретать злокачественный характер, метастазировать в финале не только в рядом расположенные кости, лимфатические узлы, но и в легкие, печень, головной мозг [2, 5, 6].
Каротидные хемодектомы составляют 18 % внеорганных опухолей шеи, чаще эти опухоли идиопатические (80–85 %), в 10–15 % описаны семейные случаи. Частота распространения этой патологии — 1–2 случая на 100 тыс. населения. Этиология развития ХД на сегодняшний день остается неуточненной. В литературе обсуждаются данные о роли хронической гипоксии и наследственной предрасположенности. Среди пациентов с семейным типом верифицированы мутации в 4 генах на коротком плече 3й хромосомы (аутосомнодоминантный тип наследования), кодирующих субъединицы фермента сукцинатдегидрогеназы, входящей в цикл Кребса. Дефект синтеза сукцинатдегидрогеназы приводит к увеличению концентрации внутриклеточных медиаторов и фактора роста эндотелия сосудов и, соответственно, к гиперплазии, ангиогенезу и неоплазии. Среди пациентов со спорадическим типом опухоли не исключается возможность образования мутации в половых хромосомах за счет геномного импринтинга, снижения пенетрантности или повторных мутаций в половых хромосомах. Каротидная ХД развивается из каротидного гломуса, расположенного в бифуркации сонной артерии, позади или у края внутренней сонной артерии, т.е. ниже и несколько кзади от угла нижней челюсти (соответственно ветвлению общей сонной артерии (ОСА)). Опухоль чаще имеет овальную форму, кожа над ней не изменена и не спаяна с опухолью. Характерной особенностью ХД является ее смещаемость в горизонтальном и отсутствие смещаемости в вертикальном направлении, невозможность отвести опухоль от пульсирующего сосуда и передаточная пульсация над опухолью (самостоятельной пульсации не имеет). Пальпация у большинства больных безболезненна. Аускультативно иногда прослушивается систолический или систолодиастолический шум, но отсутствие шума не исключает опухоли. Каротидная ХД не прорастает в сосуды, ближайшие нервные стволы, трахею, глотку. Злокачественный вариант ХД встречается в 15–20 % наблюдений. Каротидные ХД растут медленно, в течение нескольких лет. Так, по данным некоторых авторов, средняя скорость роста опухоли составляет 0,83 мм/год. Рост опухоли сопровождается развитием значительной артериальной и венозной сети сосудов, которые васкуляризируют каротидный гломус [2, 3, 6].
Клинические проявления ХД зависят от величины опухоли, степени сдавления крупных артериальных и нервных стволов шеи. В случае каротидной ХД, в отличие, например, от ХД яремного отверстия, клиника весьма скудна, особенно при малых размерах опухоли. Опухоли длительное время протекают бессимптомно. Иногда больные случайно обнаруживают безболезненную плотную опухоль на шее. По мере роста опухоли появляются разнообразные симптомы, связанные со сдавлением различных анатомических образований на шее. Обычно больных беспокоят головная боль, головокружение, тянущие боли в соответствующей половине лица и шеи, чувство удушья, кашель. Давление опухоли на блуждающий нерв и его возвратную ветвь, на подъязычный и симпатический нервы проявляется замедлением частоты сердечных сокращений, дисфонией, появлением синдрома Горнера, а при росте опухоли в сторону глотки — дисфагией. У некоторых больных возникает кратковременное обморочное состояние — синдром, связанный с раздражением каротидного синуса. Редким симптомом опухоли каротидного гломуса является лихорадка [2–4, 6].
Для подтверждения диагноза ХД используют ультразвуковое дуплексное и триплексное сканирование сонных артерий и методы нейровизуализации: сцинтиграфия, КТ, МРТ в ангиографическом режиме, ангиография. Выбор методики зависит от предполагаемой локализации опухоли, ее размеров. Ультразвуковую допплерографию применяют на первых этапах диагностики ХД. При малых размерах опухоли (до 1 см в диаметре) наиболее информативной ряд авторов считают КТангиографию (ХД выглядит как гиперваскулярное образование в области бифуркации ОСА), которая позволяет точно определять размеры и границы опухоли, ее отношение к органам и тканям. Ряд авторов в ранней диагностике отдают предпочтение сцинтиграфии, при которой накопление радиоактивного изотопа позволяет выявлять ХД минимальных размеров (менее 1 см в диаметре), расположение прилегающих к ним сосудов. Сцинтиграфия, по мнению некоторых авторов, позволяет диагностировать ХД в 75 % случаев. МРТ с контрастированием дает возможность выявлять гиперваскулярный характер опухоли, состояние прилегающих к ней сосудов и благодаря этому отдифференцировать ХД от других опухолей. С целью определения тактики лечения и решения вопроса об операбельности прибегают к ангиографии и рентгенологическому исследованию основания черепа, преимущественно методом компьютерной томографии, результаты которых и являются золотым стандартом. Эти методы дают возможность судить о степени стенозирования сосудов, состояния коллатералей и определить показания к реконструкции сосудов. Характерные ангиографические находки: локализация опухоли над развилкой ОСА, патологическая гиперваскуляризация, интенсивное накопление контрастного вещества [2–4, 6].
В лечении ХД используют лучевую терапию и оперативное удаление опухоли. Одни исследователи предпочитают хирургические методы, ссылаясь на их высокую эффективность (до 97 %) и стойкость излечения, другие, учитывая склонность ХД к рецидивам и частую малую их доступность, используют гамманож или лучевую терапию [2, 3, 6].
Приводим наблюдение каротидной хемодектомы.
Больная А., 24 лет, поступила в неврологическое отделение в ноябре 2011 года с целью переосвидетельствования на МСЭК, является инвалидом II группы.
На момент осмотра предъявляет жалобы на периодические головные боли, преимущественно в правой затылочной области, пульсирующего характера, на фоне стрессовых ситуаций, при перемене погоды, сужение левой глазной щели, периодически — поперхивание при приеме пищи, кратковременные очень редкие (0,5–1 раз в год) бессудорожные приступы с потерей сознания, перед которыми больная ощущает шум в ушах, головокружение, приступы амнезирует, после приступа ориентирована, адекватна, ощущает общую слабость.
Считает себя больной с 14летнего возраста, когда стали беспокоить головокружения, шум в ушах, приступы потери сознания частотой 2 раза в неделю, как правило, по утрам, при вставании с постели, затем (ежедневно) — при любом положении тела, а также колебания артериального давления, в связи с чем больная обращалась за медицинской помощью, обследована, и был выставлен диагноз: вегетососудистая дистония пубертатного периода по ваготоническому типу, перманентнопароксизмальное течение с синкопальными пароксизмами, диффузный зоб II степени, пролапс митрального клапана. В возрасте 16 лет больная стала замечать заметно прогрессирующее увеличение нижней части левой половины лица и шеи. Обращает на себя внимание семейный анамнез, согласно которому, со слов пациентки, у ее деда был «перекос лица», аналогично — у тети и отца больной. В 2007 году обратилась за медицинской помощью и была обследована, проведена КТангиография сосудов шеи (4срезовый мультиспиральный томограф, в/в визипак320 100 мл): на 2 см ниже бифуркации левой общей сонной артерии определяется объемное образование 6,5 х 4,2 х 4,3 см, муфтообразно охватывающее внутреннюю и наружную сонные артерии, раздвигая их: просвет внутренней и наружной сонных артерий сохранен: внутренняя сонная артерия 0,48 см, наружная сонная артерия — 0,43 см. На протяжении 2,4 см просвет внутренней яремной вены сужен до 0,4 см. Образование распространяется вверх до уровня верхнего края зуба осевого позвонка, не распространяясь в полость средней черепной ямки. Заключение: КТпризнаки хемодектомы бифуркации левой общей сонной артерии (рис. 1).

26.04.2007 г. проведена операция: иссечение параганглиомы каротидного тельца слева с перевязкой ствола сонной артерии. Протокол операции: под эндотрахеальным наркозом произведен горизонтальный дугообразный разрез по естественной складке от переднего края трапециевидной мышцы до середины пластинки щитовидного хряща слева. Сформированы кожномышечные лоскуты с включением подкожной мышцы. Кивательная мышца в фасциальных листках смещена латерально. Обнаружен сосудистонервный пучок, выявлена опухоль, легко кровоточащая при попытке мобилизации, цианотичная, муфтообразно охватывающая ствол сонной артерии на 1,5 см книзу от бифуркации, кверху охватывающая бифуркацию сонной артерии и ее ветви единым конгломератом. Внутренняя яремная вена сдавлена опухолью, кровоток в ней снижен, находится в спавшемся состоянии. После ее выделения кровоток в ней восстановился. Выделенный блуждающий нерв вместе с веной смещены латерально. Опухоль кверху распространяется к основанию черепа и верхним полюсом прилегает к кости. На ствол сонной артерии наложены турникеты и произведена попытка субадвентициального выделения опухоли — сечение сосуда резко сужено, сосудистая стенка извитая, дегенеративно изменена. Учитывая состояние артерий, распространенность опухоли, а также инвазивный характер ее роста, принято решение произвести резекцию ствола сонной артерии в блоке с опухолевым конгломератом, включающим бифуркацию с ветвями сонной артерии, муфтообразно охваченными опухолью и прилежащими к нему тканями. Блок мобилизованных тканей резецирован. Культи ствола сонной артерии и ее ветвей лигированы. Произвести протезирование сосуда изза короткой культи, расположенной у основания черепа, не представлялось возможным.
Описание макропрепарата: макропрепарат представлен опухолью в соединительнотканной капсуле синюшной окраски плотноэластичной консистенции, овальной формы, диаметром 6,5 см. На разрезе опухоль серой, багровосинюшной окраски с множественными очагами кровоизлияния и большим количеством извитых сосудов. В толще опухоли, непосредственно прилегающей к сосудам, располагались плотные узлы с наличием двух участков хрящевидной консистенции. Патогистологическое заключение от 10.05.2007 г.: в препаратах параганглиома, ангиоматозный вариант.
В настоящее время в неврологическом статусе больной имеют место синдром Горнера и поражение бульбарной группы нервов слева: парез мягкого неба слева, гипогевзия на задней трети языка, парез левой половины гортани, снижены рефлексы с мягкого неба и глоточный слева, атрофия левой половины языка и кивательной мышцы. В остальном неврологический статус без особенностей. При этом функциональный дефицит ограничивается периодическим поперхиванием при приеме пищи, косметическим дефектом вследствие наличия левостороннего птоза верхнего века и слабовыраженного энофтальма и наличием очень редких синкопальных пароксизмов.
Таким образом, у нашей пациентки имел место прогрессивный длительный рост каротидной ХД слева, имеющей, судя по анамнестическим данным, генетическую природу, причем первоначальные жалобы имели довольно неспецифический характер и были расценены как синдром вегетативной дистонии с синкопальными пароксизмами на фоне пролапса митрального клапана. Впоследствии в связи с явным ростом опухоли, опять же в отсутствие объективной очаговой неврологической симптоматики, больной была проведена КТангиография сосудов шеи и выявлена больших размеров опухоль, по ангиографическим данным и локализации соответствующая каротидной хемодектоме. В ходе операции был выявлен резкий стеноз общей сонной артерии с дегенеративно измененной и извитой сосудистой стенкой (хотя, согласно данным КТангиографии, просвет общей сонной артерии был сохранен), в связи с чем было принято решение произвести резекцию ствола сонной артерии в блоке с опухолевым конгломератом, включающим бифуркацию с ветвями сонной артерии, причем ввиду короткой культи артерии, расположенной у основания черепа, произвести протезирование сосуда не представлялось возможным. После полной резекции сонной артерии удивительным представляется факт минимального (при такой радикальности операции) неврологического дефицита: синдром Горнера, элементы бульбарного синдрома, очень редкие синкопальные пароксизмы. Объяснением этому уникальному сохранению интактности мозгового кровообращения, повидимому, может послужить молодой возраст и «тренировка» коллатералей длительной нарастающей компрессией общей сонной артерии.
Представленное клиническое наблюдение является крайне поучительным в плане особенностей клинического течения ХД, давая основания для включения в алгоритм диагностического поиска, при злокачественном течении синкопальных состояний, каротидных ХД, уникальности хирургического вмешательства и удивительных саногенетических возможностях компенсации кровообращения головного мозга с минимально выраженным постоперационным неврологическим дефицитом в виде элементов синдрома Вилларе — одностороннего сочетанного поражения языкоглоточного, блуждающего, подъязычного, добавочного нервов и шейных узлов симпатического ствола. Следует отметить, что сочетание бульбарного симптомокомплекса с синдромом Горнера позволяет клинически исключить наличие у больной ХД яремного отверстия. Тем не менее больная нуждается в дальнейшем динамическом клиническом и нейровизуализационном контроле для исключения возможного продолженного роста и злокачественного течения ХД.
1. Бразис П., Мэсдью Дж., Биллер Х. Топическая диагностика в клинической неврологии: Пер. с англ. О.С. Левина. — М.: МЕДпрессинформ, 2009. — 736 с.
2. Джибладзе Д.Н., Ерофеева А.В., Лагода О.В. и др. Случай каротидной хемодектомы // Неврологический журнал. — 1999. — № 5. — С. 3233.
3. Дружинин Д.С., Пизова Н.В. Каротидная хемодектома: дифференциальная диагностика по данным ультразвукового исследования // Опухоли головы и шеи. — 2012. — № 1. — С. 4650.
4. Дудицкая Т.К., Матякин Е.Г. Параганглиомы шеи // Вестник Российского онкологического научного центра имени Н.Н. Блохина РАМН. — 2004. — № 3. — С. 2529.
5. Пинский С.Б., Дворниченко В.В., Репета О.Р. Редкое наблюдение множественной злокачественной параганглиомы шеи // Сибирский медицинский журнал. — 2009. — № 3. — С. 131134.
6. Пономарева Е.Н., Трезкова О.А., Пономарев В.В. и др. Хемодектомы: клинические варианты, критерии диагностики и подходы к лечению // Неврологический журнал. — 2003. — № 5. — С. 2427.
7. Чернявский А.М., Стародубцев В.Б., Бахарев А.В. и др. Случай радикального удаления каротидной хемодектомы с протезированием внутренней сонной артерии // Ангиология и сосудистая хирургия. — 2008. — Т. 14, № 4. — С. 133135.
Читайте также:
- Экссудативные плевриты при парагонимозе. Течение плеврита при ларвальном парагонимозе
- Суставная капсула голеностопного сустава. Связки голеностопного сустава. Кровоснабжение голеностопного сустава. Иннервация голеностопного сустава.
- Мезаденит при туберкулезе. Клиника мезаденита при туберкулезе.
- Стенокардия. Причины стенокардии. Этиология стенокардии.
- Височное побледнение соска зрительного нерва. Псевдоневрит — псевдозастойный сосок зрительного нерва
