Синтез триглицеридов из углеводов. Этапы синтеза жиров из углеводов
Обновлено: 25.04.2024
Триглицериды синтезируются в стенке кишечника, в печени и жировой ткани (в адипоцитах). Синтез триглицеридов в стенке кишечника может происходить из моноглицерида (из 2-моноацилглицерола) и двух молекул активных жирных кислот (остатки жирных кислот в комплексе с ацилпереносящим энзимом – S-КоА), или из глицерина и трех молекул активных жирных кислот с участием АТФ, что более характерно для процессов в печени и жировой ткани. Синтез жира из глицерина и жирных кислот в печени и жировой ткани происходит по следующему пути. Глицерин фосфорилируется с использованием АТФ до глицерофосфата (фермент глицеролкиназа), затем под действием фермента глицеролфосфатацилтрансферазы взаимодействует с двумя молекулами ацилкоэнзима-А (например, с пальмитил-КоА). Образуется фосфатидная кислота (3-фосфо-1,2-диацилглицерол). При взаимодействии последней с ацилкоэнзимом-А образуется триглицерид, свободный HS-КоА и остаток ортофосфорной кислоты. Печень – основной орган, где идет синтез жирных кислот из продуктов гликолиза. Основной путь синтеза триглицелидов в печени из жирных кислот и глицерофосфата. Глицерофосфат, в свою очередь, в печень поступает из гидролиза жиров, а так же при восстановлении диоксиацетонфосфата (из гликолиза) при помощи восстановленного НАДФ (НАДФ Н+Н).
Фосфолипиды синтезируются во всех клетках, содержащих ядро. Существует несколько путей синтеза глицерофосфолипидов. Рассмотрим синтез фосфатидилсерина и кефалина из фосфатидной кислоты и синтез лецитина из диглицерида и холина. Прежде чем холин вступит в синтез лецитина, происходит фосфорилирование холина и присоединение холина к нуклеотиду. При взаимодействии диацилглицерола с ЦДФ-холином синтезируется лецитин и освобождается цитидинмонофосфат (ЦМФ). При отсутствии готового холина синтез фосфолипидов происходит на основе фосфатидной кислоты и аминокислоты серина, образуется фосфотидилсерин. При декарбоксилировании фосфатидилсерина образуется кефалин. Для синтеза лецитина из кефалина необходимо присоединить к азоту три метильных радикала. Источником метильных радикалов служит метионин в активной форме (S-аденозилматионин) с которого фермент метилтрансфераза переносит группу -CH3 на кефалин.
64. Кетоновые тела и их роль в метаболизме
- это ацетоацетат, бета-оксибутират, ацетон ,кот образ-ся из ацетил-КоА при его избыт накоп-е в печени. Биосинтез идет в печени: 1) ацето-ацетил-КоА,
4) ацетон (вывод-ся через легкие). Окисление происх-т в 3 стадии в мышцах ,клетках мозга, в надпочечниках.
Кетоновые тела, являясь продуктами жирового обмена, выполняют в организме функцию энергетического субстрата, т.е. источника энергии. К кетоновым телам относят b-гидроксимасляную кислоту, ацетоуксусную кислоту и, как конечный (тупиковый) продукт – ацетон (диметилкетон). Это небольшие водорастворимые молекулы. Общая концентрация кетоновых тел в крови млекопитающих составляет около 5 мг% (у жвачных животных до 10 мг%). Синтезируются кетоновые тела в печени (в гепатоцитах) из ацетил-КоА. У жвачных животных отмечают также синтез кетоновых тел в слизистой оболочке преджелудков. При выраженном углеводном голодании (белковый и белково-жировой рацион с недостатком углеводов), при нарушениях обмена углеводов (сахарный диабет) в результате клеточного голодания усиливается распад и использование жиров, что приводит к накоплению ацетил-КоА. Излишек молекул ацетил-КоА вовлекается в синтез кетоновых тел. Резкое увеличение концентрации кетоновых тел в крови приводит к развитию кетозов и кетоацидозов. Для синтеза кетоновых тел используется три молекулы ацетил-КоА. При конденсации двух молекул ац.-КоА образуется ацетоацетил-КоА; затем добавление третьей молекулы приводит к образованию b-гидрокси-b-метил-глютарил-КоА. При этих реакциях освобождается две молекулы HS-КоА. Полученная молекула b-гидрокси-b-метил-глютарил-КоА под действием лиазы распадается на ацетоуксусную кислоту и ацетил-КоА. Все указанные реакции протекают в матриксе митохондрий гепатоцитов. В цитоплазме клеток ацетоуксусная кислота при участии НАД-зависимой дегидрогеназы (НАДФ*Н2) может восстанавливаться до b-гидроксимасляной кислоты или спонтанно декарбоксилироваться с образованием ацетона (диметилкетона).
Синтез триглицеридов из углеводов. Этапы синтеза жиров из углеводов
Ткани и органы. Печень

Печень является главным местом синтеза жирных кислот, жиров, кетоновых тел и холестерина. Жиры могут также синтезироваться в жировой ткани, однако ее основной функцией остается депонирование липидов.
А. Метаболизм липидов
Обмен липидов в печени тесно связан с превращением углеводов и аминокислот. При поступлении питательных веществ в фазе резорбции (см. с. 300) глюкоза через промежуточное образование ацетил-КоА (ацетил-СоА) конвертируется в жирные кислоты . Печень может также извлекать жирные кислоты из липопротеинов, поступающих из желудочно-кишечного тракта (в виде хиломикронов ) и других тканей (см. с. 272). Жирные кислоты используются для биосинтеза триглицеринов и фосфолипидов . При связывании жиров с аполипопротеинами образуются липопротеиновые комплексы очень низкой плотности [ЛОНП (VLDL), см. с. 272]. Они попадают в кровь и переносятся в другие ткани, прежде всего в жировую и мышечную ткань.
В фазе пострезорбции (см. с. 300), особенно в период поста или голодания, обмен липидов идет в обратном направлении, организм обращается к собственным запасам. В этих условиях жиры поступают из жировой ткани в кровь, переносятся в печень, распадаются в результате β-окисления до ацетил-КоА и, наконец, превращаются в кетоновые тела .
Холестерин поступает в организм из двух источников — с пищей и за счет эндогенного синтеза, причем большая часть холестерина синтезируется в печени. Биосинтез холестерина начинается с ацетил-КоА (см. с. 174). Полученный холестерин используется в синтезе желчных кислот (см. с. 306), встраивается в клеточные мембраны (см. с. 216), депонируется в жировых каплях в составе эфиров жирных кислот. Остальная часть поступает в кровь в составе липопротеиновых комплексов [ЛОНП (VLDL)] и переносится в другие ткани. Печень способствует обмену холестерина благодаря тому, что служит местом, худа поступают с кровью и где подвергаются расщеплению липопротеиновые комплексы [ЛВП, ЛПП, ЛНН (HDL, IDL, LDL), см. с. 272], содержащие холестерин и его эфиры с жирными кислотами.
Б. Биосинтез кетоновых тел
При высокой концентрации ацетил-КоА в митохондриях гепатоцитов происходит конденсация двух молекул ацетил-КоА с образованием ацетоацетил-КоА [ 1 ]. Присоединение еще одной ацетильной группы [ 2 ] приводит к 3-гидрокси-З-метилглутарил-КоА (ГМГ-КоА) [ 3 ], который после отщепления ацетил-КоА превращается в ацетоуксусную кислоту (ацетоацетат) ( цикл Линена ). При восстановлении последней получается 3-гидроксибутират [ 4 ], а при неферментативном декарбоксилировании — ацетон [ 5 ]. Все три соединения принято называть «кетоновыми телами», что не совсем правильно, поскольку в 3-гидроксимасляной кислоте отсутствует кетогруппа!
Кетоновые тела поступают из печени в кровь, где они хорошо растворимы. Концентрация кетоновых тел в крови возрастает в фазе пострезорбции (фаза голодания). Наряду с жирными кислотами 3-гидроксибутират и ацетоацетат в этот период являются основными энергоносителями. Ацетон, не имеющий метаболической ценности, удаляется через легкие. После 1-2 недели голодания кетоновые тела начинают использоваться в качестве источника энергии нервными тканями. Однако при этом для обеспечения цитратного цикла необходимо минимальное количество глюкозы.
Если биосинтез кетоновых тел превышает потребности организма, они накапливаются в крови (кетонемия) и, наконец, выводятся с мочой (кетонурия). Оба феномена наблюдаются во время длительного голодания (углеводная недостаточность) и при заболеваний диабетом (Diabetes mellitis). Хотя 3-гидроксимасляная кислота является слабой кислотой (рК а примерно 4), возрастание концентрации кетоновых тел вызывает изменение рН в крови ( кетоацидоз , см. с. 280). Кетонурия и кетоацидоз могут быстро привести к электролитному сдвигу (нарушению ионного гомеостаза) и потери сознания (кетоацидозной коме) и, следовательно, опасны для жизни.
Синтез триглицеридов из углеводов. Этапы синтеза жиров из углеводов

А. Метаболизм жиров: общие сведения.
Метаболизм жиров в жировой ткани (на схеме сверху)
Жиры (триацилглицерины) — наиболее важный резерв энергии в организме животных. Они хранятся главным образом в клетках жировой ткани, адипоцитах . Там же они участвуют в постоянно происходящих процессах образования и деградации.
Жирные кислоты, необходимые для синтеза жиров (липогенеза), в составе триацилглицеринов переносятся из печени и кишечника в виде липопротеиновых комплексов (ЛОНП и хиломикроны). Липопротеин-липаза [ 1 ], находящаяся на поверхности эндотелиальных клеток кровеносных капилляров, отщепляет от этих липопротеинов жирные кислоты (см. рис. 273).
В адипоцитах деградация жиров (липолиз) катализируется гормонзависимой липазой [ 2 ]. Уровень свободных жирных кислот, поступающих из жировой ткани, зависит от активности этой липазы — фермент регулирует таким образом уровень жирных кислот в плазме.
Жирные кислоты из жировой ткани транспортируются в плазму крови в неэтерифицированной форме. При этом растворимы только короткоцепочечные жирные кислоты, а жирные кислоты с более длинными цепями, менее растворимые в воде, переносятся в комплексе с альбумином .
Деградация жирных кислот в печени (на схеме слева)
Жирные кислоты поступают из плазмы крови в ткани; здесь из них синтезируются жиры или за счет окисления получается энергия. Особенно интенсивен метаболизм жирных кислот в клетках печени (гепатоцитах).
Наиболее сажным процессом деградации жирных кислот является β-окисление (см. рис. 167) в митохондриях. При этом жирные кислоты вначале активируются в цитоплазме, присоединяясь к коферменту А [ 3 ]. Затем они с помощью транспортной системы (карнитинового челнока [ 4 ]; см. рис. 215) попадают в митохондриальный матрикс, где разрушаются в результате β-окисления до ацетил-КоА . Образующиеся ацетильные остатки полностью окисляются до СО 2 в цитратном цикле с освобождением энергии в виде АТФ (АТР). Если количество образовавшегося ацетил-КоА превосходит энергетическую потребность гепатоцитов, что наблюдается при высоком содержании жирных кислот в плазме крови (типичные случаи — голодание и сахарный диабет), то в гепатоцитах синтезируются кетоновые тела (см. рис. 305), снабжающие энергией уже другие ткани.
Синтез жирных кислот в печени (на схеме справа)
Биосинтез жирных кислот протекает в цитоплазме, в основном в печени, жировой ткани, почках, легких и молочных железах. Главным источником атомов углерода является глюкоза , однако возможны и другие предшественники ацетил-КоА, например аминокислоты.
Первая стадия — карбоксилирование ацетил-КоА с образованием малонил-СоА — катализируется ацетил-КоА-карбоксилазой [ 5 ], ключевым ферментом биосинтеза жирных кислот. Создание длинноцепочечных жирных кислот осуществляется синтазой жирных кислот [ 6 ] (см. рис. 171). Исходя из молекулы ацетил-КоА под действием этого полифункционального фермента, цепь удлиняется (процесс включает семь реакций) путем добавления малонильных групп и отщепления СО 2 (в каждой реакции) с образованием пальмитата. Таким образом, в результате каждой реакции молекула удлиняется на два углеродных атома. В качестве восстановителя используется НАДФН + Н + , образующийся в гексозомонофосфатном пути (см. рис. 155) или в реакциях, катализируемых изоцитратдегидрогеназой и «малатферментом» .
Удлинение цепи жирной кислоты на синтазе жирных кислот заканчивается на C 16 , т.е. на пальмитиновой кислоте (16:0). В последующих реакциях пальмитат используется в качестве предшественника для получения ненасыщенных или более длинноцепочечных жирных кислот.
Дальнейший биосинтез жиров протекает с участием активированных жирных кислот (ацил-КоА) и 3-глицерофосфата (см. рис. 173). Для обеспечения других тканей жиры в гепацитах упаковываются в липопротеиновые комплексы типа ЛОНП (VLDL) и поступают в кровь (см. рис. 273).
Синтез триглицеридов из углеводов. Этапы синтеза жиров из углеводов
Синтез триглицеридов из углеводов. Этапы синтеза жиров из углеводов
а) Синтез триглицеридов из углеводов. Если когда-нибудь большие количества углеводов попадают в организм, они либо сразу используются для получения энергии, либо запасаются в виде гликогена, а избыток их быстро превращается в триглицериды и хранится в таком виде в жировой ткани. У человека большая часть триглицеридов образуется в печени, но очень небольшие количества могут образовываться и в самой жировой ткани. Триглицериды, образуемые в печени, транспортируются главным образом в виде липопротеинов очень низкой плотности в жировую ткань, где и хранятся.
б) Превращение ацетил-КоА в жирные кислоты. Первым этапом синтеза триглицеридов является превращение углеводов в ацетил-КоА.
Это происходит во время обычного расщепления глюкозы гликолитической системой. Вследствие того, что жирные кислоты являются крупными полимерами уксусной кислоты, легко представить, каким образом ацетил-КоА может быть превращен в жирную кислоту. Однако синтез жирных кислот не обеспечивается просто изменением направления реакции окислительного расщепления. Этот синтез осуществляется двуступенчатым процессом, показанным на рисунке ниже, с использованием малонил-КоА и НАДФ-Н в качестве основных посредников процесса полимеризации.
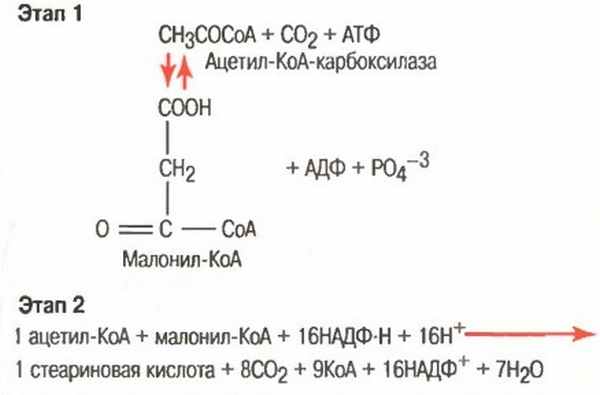
Синтез жирных кислот
в) Объединение жирных кислот с α-глицерофосфатом при образовании триглицеридов. Как только синтезируемые цепочки жирных кислот начинают включать от 14 до 18 атомов углерода, они взаимодействуют с глицеролом, образуя триглицериды. Ферменты, катализирующие эту реакцию, высокоспецифичны для жирных кислот с длиной цепочки от 14 атомов углерода и выше, что является фактором, контролирующим структурное соответствие триглицеридов, хранящихся в организме.
Как показано на рисунке ниже, образование глицероловой части молекулы триглицерида обеспечивается α-глицерофосфатом, который является побочным продуктом реакции гликолитического расщепления глюкозы.

Общая схема синтеза триглицеридов из глюкозы
г) Эффективность превращения углеводов в жиры. Во время синтеза триглицеридов только 15% потенциально содержащейся в глюкозе энергии теряется в виде тепла. Остальные 85% преобразуются в энергию запасаемых триглицеридов.
д) Важность синтеза и хранения жиров. Синтез жиров из углеводов особенно важен в связи с двумя обстоятельствами.
1. Способность различных клеток организма запасать углеводы в виде гликогена выражена слабо. Только несколько сотен граммов гликогена может запасаться в печени, скелетных мышцах и всех других тканях организма, вместе взятых. В то же время могут запасаться килограммы жира, поэтому синтез жиров является способом, с помощью которого энергия, содержащаяся в избыточном количестве поступивших в организм углеводов (и белков), может запасаться, чтобы использоваться позднее. Количество энергии, которую запасает организм человека в виде жиров, приблизительно в 150 раз превышает количество энергии, запасаемой в виде углеводов.
2. Каждый грамм жиров содержит почти в 2,5 раза больше энергии, чем каждый грамм углеводов. Следовательно, при одном и той же массе тела организм может запасать в несколько раз больше энергии в виде жиров, чем в виде углеводов, что особенно важно, если необходима высокая степень подвижности, чтобы выжить.
е) Снижение синтеза жиров из углеводов при отсутствии инсулина. При отсутствии инсулина, как это бывает при тяжелом сахарном диабете, жиров синтезируется мало, если они вообще синтезируются, по следующим причинам. Во-первых, при отсутствии инсулина глюкоза не может попадать в сколько-нибудь существенных количествах в жировые ткани и клетки печени, что не обеспечивает образования достаточных количеств ацетил-КоА и НАДФ-Н, необходимых для синтеза жиров и получаемых при метаболизме глюкозы. Во-вторых, отсутствие глюкозы в жировых клетках существенно снижает количество наличного глицерофосфата, что также затрудняет образование триглицеридов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Биохимия печени
Печень самый крупный из паренхиматозных органов. Она выполняет ряд ключевых функций.
1) Принимает и распределяет вещества, поступающие в организм из пищеварительного тракта, которые приносятся с кровью по воротной вене. Эти вещества проникают в гепатоциты, подвергаются химическим превращениям и в виде промежуточных или конечных метаболитов поступают в кровь и разносятся в другие органы и ткани.
2) Служит местом образования желчи.
3) Синтезирует вещества, которые используются в других тканях.
4) Инактивирует экзогенные и эндогенные токсические вещества, а также гормоны.
Особенности строения гепатоцита
Такие разнообразные функции обусловлены особенностями строения печени и ее отдельных клеток. Гепатоцит имеет хорошо развитую систему эндоплазматического ретикулума (ЭР), причем как гладкую, так и шероховатую. Одна из главных функций ЭР - синтез белков, которые используются другими органами и тканями (альбумины), или ферментов работающих в печени. Кроме того, в ЭР синтезируются фосфолипиды, триглицериды и холестерол. Гладкий ЭР содержит ферменты детоксикации ксенобиотиков.
Роль печени в метаболизме углеводов
Печень играет ведущую роль в поддержании физиологической концентрации глюкозы в крови. Из общего количества поступающей из кишечника глюкозы печень извлекает ее большую часть и тратит: 10-15 % от этого количества на синтез гликогена, 60 % на окислительный распад, 30 % на синтез жирных кислот.
При физиологической гипогликемии в печени активируется распад гликогена. Первая стадия этого процесса заключается в отщеплении молекулы глюкозы и ее фосфорилировании (фермент фосфорилаза). Далее Глю-5-Ф может расходоваться по трем направлениям:
1. по пути глтколиза с образованием пировиноградной кислоты и лактата;
2. по пентозофосфатному пути;
3. расщепляться под действием фосфотазы на глюкозу и фосфор.
Преобладает последний путь, который приводит к выбросу в общий кровоток свободной глюкозы.
В печени активно протекает глюконеогенез, при котором предшественниками глюкозы являются пируват и аланин (поступающий из мышц), глицерол - из жировой ткани и с пищей ряд глюкогенных АК. Избыточное поступление глюкозы с пищей увеличивает в гепатоците интенсивность всех путей ее превращения. Так активируется ее окисление с образованием большого количества пирувата. Для его дальнейшего окисления необходимо также большое количество КоА, который также используется и для окисления жирных кислот. В результате окисление жирных кислот и распад липидов в жировых депо замедляется.
Метаболизм липидов
В печени синтезируются желчные кислоты, при дефиците которых переваривания жиров практически не происходит. В регуляции метаболизма липидов печени принадлежит ведущая роль. Так, при дефиците основного энергетического материала - глюкозы, в печени активируется окисление жирных кислот. В условиях избытка глюкозы в гепатоцитах происходит синтез триглицеридов и фосфолипидов из жирных кислот, которые поступают в печень из кишечника.
Печени принадлежит ведущая роль в регуляции обмена холестерола. Исходное вещество в его синтезе - ацетил-КоА. Т. е. Избыточное питание стимулирует образование холестерола.
В печени синтезируются транспортные формы липопротеинов.
В печени, кроме того, синтезируются кетоновые тела, в частности ацетоацетат и гидрооксимаслянная кислота , которые разносятся кровью по организму. Сердечная мышца и корковый слой надпочечников предпочитают в качестве источника энергии использовать именно эти соединения, а не глюкозу.
Метаболизм белков
Печень использует АК, поступающие из пищеварительного тракта для синтеза собственных белков, но большая их часть идет на синтез белков плазмы крови. В печени синтезируются фибриноген, альбумины, a - и b -глобулины и липопротеиды. В печени синтезируется также т.н. лабильный резервный белок, который является как бы запасом АК, которые затем могут использоваться различными органами и тканями по мере необходимости.
Печень занимает центральное место в обмене АК, т.к. в ней активно протекают процессы их химической модификации. Кроме того, именно в печени происходит синтез мочевины.
Детоксицирующая функция печени
Детоксикация ядовитых метаболитов и чужеродных соединений (ксенобиотиков) протекает в гепатоцитах в две стадии. Реакции первой стадии катализируются монооксигеназной системой, компоненты которой встроены в мембраны эндоплазматического ретикулума. Реакции окисления, восстановления или гидролиза являются первой стадией в системе выведения из организма гидрофобных молекул. Они превращают вещества в полярные водорастворимые метаболиты.
Основной фермент гемопротеид цитохромы Р-450 . К настоящему времени выявлено множество изоформ этого фермента и отнесено, в зависимости от их свойств и выполняемых функций, к нескольким семействам. У млекопитающих идентифицировано 13 подсемейств цх Р-450, условно считается, что ферменты семейства I-IV участвуют в биотрансформации ксенобиотиков, остальные метаболизируют эндогенные соединения (стероидные гормоны, простатагландины, жирные кислоты и др.).
Важным свойством цх Р-450 является способность к индукции под действием экзогенных субстратов, что легло в основу классификации изоформ в зависимости от индуцируемости тем или веществом определенной химической структуры.
На первой стадии биотрансформации происходит образование или высвобождение гидрокси-, карбоксильных, тиоловых и аминогрупп, которые являются гидрофильными, и молекула может подвергаться дальнейшему превращению и выведению из организма. В качестве кофермента используется НАДФН. Кроме цх Р-450, в первой стадии биотрансформации принимают участие цх b 5 и цитохромредуктаза.
Многие лекарственные вещества, попадая в организм, превращаются на первой стадии биотрансформации в активные формы и оказывают необходимый лечебный эффект. Но часто ряд ксенобиотиков не детоксицируется, а наоборот токсифицируется с участием монооксигеназной системы и становится более реакционноспособным.
Продукты метаболизма чужеродных веществ, образовавшихся на первой стадии биотрансформации, подвергаются дальнейшей детоксикации с помощью ряда реакций второй стадии. Образующиеся при этом соединения менее полярны и в связи с этим легко удаляются из клеток. Преобладающим является процесс конъюгации, катализируемый глутатион-S-трансферазой, сульфотрансферазой и UDP-глюкуронилтрансферазой. Конъюгацию с глутатионом, приводящую к образованию меркаптуровых кислот, принято рассматривать в качестве основного механизма детоксикации.
Глутатион (ведущий компонент редокс-буфера клетки) представляет собой соединение, содержащее реактивную тиоловую группу. Большая его часть находится в восстановленной форме (GSH) и играет центральную роль в инактивации токсических и реактивных продуктов. Восстановление окисленного глутатиона осуществляет фермент - глутатионредуктаза, используя как кофермент НАДФН. Коньюгаты с глутатионом, серной и глюкуроновой кислотами выводятся из организма преимущественно с мочой.
Зональность ферментных систем
Зональность метаболических комплексов печени, основного органа поддержания химического гомеостаза, определяет различие в ферментном составе между гепатоцитами перивенозной (центральной) и перипортальной (периферической) зон ацинуса (рис.4.16.1.). Это связано с их неодинаковой потребностью в кислороде различных ферментных систем.
Так, наибольшая концентрация ферментов ЦТК, катаболизма амино- и жирных кислот, цикла мочевины, глюконеогенеза отмечена в перипортальной зоне, получающей более оксигенированную кровь. Поскольку компоненты реакций второй фазы биотрансформации локализованы в клетках этой зоны ацинуса, то они более защищены от действия токсических продуктов. В гепатоцитах перицентральной зоны более активен гликолиз и первая стадия биотрансформации ксенобиотиков.
ЛИТЕРАТУРА К ГЛАВЕ IV .16.3.
1. Бышевский А. Ш., Терсенов О. А. Биохимия для врача // Екатеринбург: Уральский рабочий, 1994, 384 с.;
2. Ленинджер А. Биохимия. Молекулярные основы структуры и функций клетки // М.: Мир, 1974, 956 с.;
3. Пустовалова Л.М. Практикум по биохимии // Ростов-на Дону: Феникс, 1999, 540 с.;
4. Хмельницкий Р. А. Физическая и коллоидная химия // М.: Высш. шк., 1988, 400 с.;
5. Ньюсхолм Э., Старт К. Регуляция метаболизма. Под ред. Э.Г.Ларского. - М.: Мир, 1977. - 407 с.
6. Мишнев О.Д., Щеголев А.И. Структурно-метаболическая характеристика ацинуса печени // Арх. патологии, гистологии и эмбриологии. 1988. Т. ХСV, № 10, с. 89-96.;
7. Парк Д.В. Биохимия чужеродных соединений. - М.: Медицина, 1973, 287 с.;
8. Чекман И.С., Гриневич А.И. Конъюгация ксенобиотиков // Фармакологи и токсикология, 1988, № 1, с. 86-93.
9. Щербаков В.М., Тихонов А.В. Изоформы цитохрома Р-450 печени человека // М.: АО “Биохимические технологии”, 1995, 102 с.
Читайте также:
