Регуляция выделения инсулина. Стимуляция секреции инсулина
Обновлено: 26.07.2024
Инсулин представляет собой белок, состоящий из двух пептидных цепей А (21 аминокислота) и В (30 аминокислот), связанных между собой дисульфидными мостиками. Всего в зрелом инсулине человека присутствует 51 аминокислота и его молекулярная масса равна 5,7 кДа.
Синтез
Инсулин синтезируется в β-клетках поджелудочной железы в виде препроинсулина, на N-конце которого находится концевая сигнальная последовательность из 23 аминокислот, служащая проводником всей молекулы в полость эндоплазматической сети. Здесь концевая последовательность сразу отщепляется и проинсулин транспортируется в аппарат Гольджи.
На данном этапе в молекуле проинсулина присутствуют А-цепь, В-цепь и С-пептид (англ. connecting – связующий). В аппарате Гольджи проинсулин упаковывается в секреторные гранулы вместе с ферментами, необходимыми для "созревания" гормона . По мере перемещения гранул к плазматической мембране образуются дисульфидные мостики, вырезается связующий С-пептид (31 аминокислота) и формируется готовая молекула инсулина. В готовых гранулах инсулин находится в кристаллическом состоянии в виде гексамера, образуемого с участием двух ионов Zn 2+ .

Схема синтеза инсулина
Около 15% молекул проинсулина поступает в кровоток. Проинсулин обладает более слабой активностью (около 1:10), но большим периодом полувыведения (около 3:1), по сравнению с инсулином. Поэтому повышение его уровня может вызывать гипогликемические состояния, что наблюдается при инсулиномах.
Регуляция синтеза и секреции
Секреция инсулина из β-клеток происходит постоянно, и высвобождение около 50% инсулина никак не связано с приемом пищи или иными влияниями. В течение суток поджелудочная железа выделяет примерно 1/5 от запасов имеющегося в ней инсулина.
Главным стимулятором секреции инсулина является повышение концентрации глюкозы в крови выше 5,5 ммоль/л, максимума секреция достигает при 17-28 ммоль/л. Особенностью этой стимуляции является двухфазное усиление секреции инсулина:
- первая фаза длится 5-10 минут и концентрация гормона может 10-кратно возрастать, после чего его количество понижается,
- вторая фаза начинается примерно через 15 минут от начала гипергликемии и продолжается на протяжении всего ее периода, приводя к увеличению уровня гормона в 15-25 раз.
Чем дольше в крови сохраняется высокая концентрация глюкозы, тем большее число β-клеток подключается к секреции инсулина.
Индукция синтеза инсулина происходит от момента проникновения глюкозы в клетку до трансляции инсулиновой мРНК. Она регулируется повышением транскрипции гена инсулина, повышением стабильности инсулиновой мРНК и увеличением трансляции инсулиновой мРНК.
Активация секреции инсулина
1. После проникновения глюкозы в β-клетки (через ГлюТ-1 и ГлюТ-2) она фосфорилируется гексокиназой IV (глюкокиназа, обладает низким сродством к глюкозе),
2. Далее глюкоза аэробно окисляется, при этом скорость окисления глюкозы линейно зависит от ее количества,
3. В результате нарабатывается АТФ, количество которого также прямо зависит от концентрации глюкозы в крови,
4. Накопление АТФ стимулирует закрытие ионных K + -каналов, что приводит к деполяризации мембраны,
5. Деполяризация мембраны приводит к открытию потенциал-зависимых Ca 2+ -каналов и притоку ионов Ca 2+ в клетку,
6. Поступающие ионы Ca 2+ активируют фосфолипазу C и запускают кальций-фосфолипидный механизм проведения сигнала с образованием ДАГ и инозитол-трифосфата (ИФ3),
7. Появление ИФ3 в цитозоле открывает Ca 2+ -каналы в эндоплазматической сети, что ускоряет накопление ионов Ca 2+ в цитозоле,
8. Резкое увеличение концентрации в клетке ионов Ca 2+ приводит к перемещению секреторных гранул к плазматической мембране, их слиянию с ней и экзоцитозу кристаллов зрелого инсулина наружу,
9. Далее происходит распад кристаллов, отделение ионов Zn 2+ и выход молекул активного инсулина в кровоток.
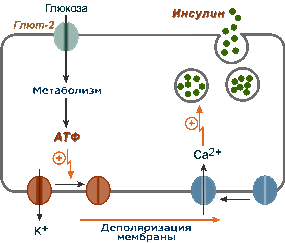
Схема внутриклеточной регуляции секреции инсулина при участии глюкозы
Описанный ведущий механизм может корректироваться в ту или иную сторону под действием ряда других факторов, таких как аминокислоты, жирные кислоты, гормоны ЖКТ и другие гормоны, нервная регуляция .
Из аминокислот на секрецию гормона наиболее значительно влияют лизин и аргинин. Но сами по себе они почти не стимулируют секрецию, их эффект зависит от наличия гипергликемии, т.е. аминокислоты только потенциируют действие глюкозы.
Свободные жирные кислоты также являются факторами, стимулирующими секрецию инсулина, но тоже только в присутствии глюкозы.
Логичной является положительная чувствительность секреции инсулина к действию гормонов желудочно-кишечного тракта – инкретинов (энтероглюкагона и глюкозозависимого инсулинотропного полипептида), холецистокинина, секретина, гастрина, желудочного ингибирующего полипептида.
Клинически важным и в какой-то мере опасным является усиление секреции инсулина при длительном воздействии соматотропного гормона, АКТГ и глюкокортикоидов, эстрогенов, прогестинов. При этом возрастает риск истощения β-клеток, уменьшение синтеза инсулина и возникновение инсулинзависимого сахарного диабета. Такое может наблюдаться при использовании указанных гормонов в терапии или при патологиях, связанных с их гиперфункцией.
Нервная регуляция β-клеток поджелудочной железы включает адренергическую и холинергическую регуляцию. Любые стрессы (эмоциональные и/или физические нагрузки, гипоксия, переохлаждение, травмы, ожоги) повышают активность симпатической нервной системы и подавляют секрецию инсулина за счет активации α2-адренорецепторов. С другой стороны, стимуляция β2-адренорецепторов приводит к усилению секреции.
Также выделение инсулина повышается n.vagus, в свою очередь находящегося под контролем гипоталамуса, чувствительного к концентрации глюкозы крови.
К лекарственным регуляторам секреции инсулина относятся производные сульфанилмочевины (глибенкламид, гликлазид) и глиниды (старликс, новонорм). Обе группы связываются с разными участками одного рецептора и блокируют АТФ-зависимые калиевые каналы, открывая Ca 2+ -каналы, и этим индуцируя секрецию инсулина.
Мишени
Рецепторы инсулина находятся практически на всех клетках организма, кроме нервных, но в разном количестве. Нервные клетки не имеют рецепторов к инсулину, т.к. последний просто не проникает через гематоэнцефалический барьер.
Наибольшая концентрация рецепторов наблюдается на мембране гепатоцитов (100-200 тыс на клетку) и адипоцитов (около 50 тыс на клетку), клетка скелетной мышцы имеет около 10 тысяч рецепторов, а эритроциты - только 40 рецепторов на клетку.
Механизм действия
После связывания инсулина с рецептором активируется ферментативный домен рецептора. Так как он обладает тирозинкиназной активностью, то фосфорилирует внутриклеточные белки - субстраты инсулинового рецептора. Дальнейшее развитие событий обусловлено двумя направлениями: MAP-киназный путь и ФИ-3-киназный механизмы действия (подробно).
При активации фосфатидилинозитол-3-киназного механизма результатом являются быстрые эффекты – активация ГлюТ-4 и поступление глюкозы в клетку, изменение активности "метаболических" ферментов – ТАГ-липазы, гликогенсинтазы, гликогенфосфорилазы, киназы гликогенфосфорилазы, ацетил-SКоА-карбоксилазы и других.
При реализации MAP-киназного механизма (англ. MAP - mitogen-activated protein) регулируются медленные эффекты – пролиферация и дифференцировка клеток, процессы апоптоза и антиапоптоза.

Два механизма действия инсулина
Скорость эффектов действия инсулина
Биологические эффекты инсулина подразделяются по скорости развития:
Очень быстрые эффекты (секунды)
Эти эффекты связаны с изменением трансмембранных транспортов :
1. Активации Na + /K + -АТФазы , что вызывает выход ионов Na + и вход в клетку ионов K + , что ведет к гиперполяризации мембран чувствительных к инсулину клеток (кроме гепатоцитов).
2. Активация Na + /H + -обменника на цитоплазматической мембране многих клеток и выход из клетки ионов H + в обмен на ионы Na + . Такое влияние имеет значение в патогенезе артериальной гипертензии при сахарном диабете 2 типа.
3. Угнетение мембранной Ca 2+ -АТФазы приводит к задержке ионов Ca 2+ в цитозоле клетки.
4. Выход на мембрану миоцитов и адипоцитов переносчиков глюкозы ГлюТ-4 и увеличение в 20-50 раз объема транспорта глюкозы в клетку.
Быстрые эффекты (минуты)
Быстрые эффекты заключаются в изменении скоростей фосфорилирования и дефосфорилирования метаболических ферментов и регуляторных белков.
Печень
- торможение эффектов адреналина и глюкагона (активация фосфодиэстеразы),
- ускорение гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- увеличение превращения пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиление синтеза жирных кислот (ацетил-SКоА-карбоксилаза),
- формирование ЛПОНП,
- повышение синтеза холестерина (ГМГ-SКоА-редуктаза),
Мышцы
- торможение эффектов адреналина (активация фосфодиэстеразы),
- стимулирует транспорт глюкозы в клетки (активация ГлюТ-4),
- стимуляция гликогеногенеза (гликогенсинтаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- увеличение превращения пирувата в ацетил-SКоА (ПВК-дегидрогеназа),
- усиливает транспорт нейтральных аминокислот в мышцы,
- стимулирует трансляцию (рибосомальный синтез белков).
Жировая ткань
- стимулирует транспорт глюкозы в клетки (активация Глют-4),
- активирует запасание жирных кислот в тканях (липопротеинлипаза),
- активация гликолиза (фосфофруктокиназа, пируваткиназа),
- усиление синтеза жирных кислот (активация ацетил-SКоА-карбоксилазы),
- создание возможности для запасания ТАГ (инактивация гормон-чувствительной-липазы).
Медленные эффекты (минуты-часы)
Медленные эффекты заключаются в изменении скорости транскрипции генов белков, отвечающих за обмен веществ, за рост и деление клеток, например:
1. Индукция синтеза ферментов в печени
- глюкокиназы и пируваткиназы ( гликолиз ),
- АТФ-цитрат-лиазы, ацетил-SКоА-карбоксилазы, синтазы жирных кислот, цитозольной малатдегидрогеназы ( синтез жирных кислот ),
- глюкозо-6-фосфатдегидрогеназы ( пентозофосфатный путь ),
2. Индукция в адипоцитах синтеза глицеральдегидфосфат-дегидрогеназы и синтазы жирных кислот.
3. Репрессия синтеза мРНК, например, для ФЕП-карбоксикиназы ( глюконеогенез ).
4. Обеспечивает процессы трансляции, повышая фосфорилирование по серину рибосомального белка S6.
Очень медленные эффекты (часы-сутки)
Очень медленные эффекты реализуют митогенез и размножение клеток. Например, к этим эффектам относится
1. Повышение в печени синтеза соматомедина, зависимого от гормона роста.
2. Увеличение роста и пролиферации клеток в синергизме с соматомединами.
3. Переход клетки из G1-фазы в S-фазу клеточного цикла.
Именно группой медленных эффектов объясняется "парадокс" наличия инсулинорезистентности адипоцитов (при сахарном диабете 2 типа) и одновременное увеличение массы жировой ткани и запасание в ней липидов под влиянием гипергликемии и инсулина.
Инактивация инсулина
Удаление инсулина из циркуляции происходит после его связывания с рецептором и последующей интернализации (эндоцитоза) гормон-рецепторного комплекса, в основном в печени и мышцах. После поглощения комплекс разрушается и белковые молекулы лизируются до свободных аминокислот. В печени захватывается и разрушается до 50% инсулина при первом прохождении крови, оттекающей от поджелудочной железы. В почках инсулин фильтруется в первичную мочу и, после реабсорбции в проксимальных канальцах, разрушается.
Патология
Гипофункция
Инсулинзависимый и инсулиннезависимый сахарный диабет. Для диагностики этих патологий в клинике активно используют нагрузочные пробы и определение концентрации инсулина и С-пептида.
Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов
Для цитирования: Аметов А.С. Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов. РМЖ. 2006;26:1867.
Сахарный диабет 2 типа является гетерогенным заболеванием, развивающимся в результате комбинации врожденных и приобретенных факторов. Согласно мнению профессора Ральфа Де Фронзо, патофизиология сахарного диабета 2 типа представляет собой кульминацию двух одновременно протекающих процессов: с одной стороны – инсулинорезистентность, с другой – недостаточность функции b–клеток для того, чтобы преодолеть инсулинорезистентность путем повышения уровня инсулина. В этой связи изучение функции b–клеток в норме и при патологии находятся под пристальным вниманием исследователей.
В норме b–клетки быстро адаптируются к снижению чувствительности к инсулину на уровне печени или периферических тканей, повышая секрецию инсулина и предотвращая развитие гипергликемии натощак. При сахарном диабете 2 типа гипергликемия натощак развивается в случаях недостаточной функции b–клеток в плане производства и секреции инсулина, необходимого для преодоления инсулинорезистентности. Вне всякого сомнения, эти факторы тесно связаны друг с другом, хотя кажется абсолютно ясным, что без нарушенной секреции инсулина не может развиваться гипергликемия и таким образом именно b–клетки и их функция являются «сердцем» данной проблемы.
Более 25 лет тому назад было убедительно показано, что у пациентов с нарушенной толерантностью к глюкозе или с сахарным диабетом 2 типа имеют место нарушения кинетики выделения инсулина и снижение инсулинового ответа на пищевую нагрузку.
Рассматривая вопросы секреции инсулина в норме и при сахарном диабете 2 типа, необходимо отметить, что у здоровых лиц существует постоянная базальная секреция инсулина, которая имеет место даже тогда, когда отсутствуют любые экзогенные стимулы для выделения инсулина. И даже в тех случаях, когда уровень глюкозы плазмы после ночного голодания низкий (4,4–5,5 ммоль/л), все равно в организме человека поддерживается постоянная базальная секреция инсулина.
Известно, что в постпрандиальном периоде глюкоза попадает в циркуляцию крови непосредственно из абсорбированных с пищей углеводов, а затем распределяется – в основном в скелетные мышцы через многократное увеличение инсулинопосредованного захвата глюкозы (ИОЗГ). А в связи с тем, что пациенты с сахарным диабетом 2 типа имеют ограниченные возможности к быстрому увеличению ИОЗГ, постпрандиальная гликемия у них будет значительно повышенной.
Необходимо особо подчеркнуть, что постпрандиальная гипергликемия может развиваться и существовать в течение нескольких лет до развития и появления гипергликемии натощак и до клинической манифестации сахарного диабета.
Организация запасов глюкозы в первую очередь именно мышечной тканью частично объясняется тем, что эта ткань способна абсорбировать глюкозу достаточно быстро и в больших количествах, препятствуя развитию постпрандиальной гипергликемии в физиологических условиях. Причем колебания постпрандиального уровня глюкозы являются важной составляющей общей суточной гипергликемии.
В настоящее время убедительно показано, что b–клетки несут серьезную ответственность за поддержание в организме человека уровней глюкозы в достаточно узком диапазоне. По мнению P.D. Home (2000), уровень глюкозы в норме у лиц молодого и среднего возраста абсолютно стабилен в течение ночи и составляет непосредственно перед завтраком 4,3 ммоль/л. После завтрака концентрация глюкозы повышается, достигая 7,0 ммоль/л в течение 30 минут, затем снижается, достигая показателя 5,5 ммоль/л в течение почти такого же времени.
Необходимо отметить, что у больных сахарным диабетом 2 типа повышение секреции инсулина в ответ на прием пищи замедлено и ослаблено. У некоторых пациентов инсулиновый ответ на прием пищи вообще отсутствует.
Особое место в исследованиях занимает информация, касающаяся двухфазности секреции инсулина в норме и патологии.
В настоящее время известно, что выделение инсулина происходит двухфазным образом, характеризующимся наличием острых пиков, продолжающихся в среднем в течение 10 минут (первая фаза), с последующим постепенным повышением выделения инсулина (вторая фаза).
Существует точка зрения, что эти две фазы фактически представляют два различных внутриостровковых пула инсулина. Первый пул, или пул немедленного реагирования, представляет собой в количественном отношении около 5–10% внутриостровкового содержания инсулина. Речь идет о гранулах инсулина, находящихся максимально близко к мембране b–клетки, и считается, что именно этот быстровыделяемый пул обеспечивает первую, раннюю фазу в секреции инсулина.
Второй пул, или готовый к использованию пул инсулина, или резервный пул, для выделения которого необходима аденозинтрифосфат–зависимая мобилизация инсулинсодержащих гранул, перемещающихся постепенно в первый пул, с последующим экзоцитозом, фактически представляет 90–95% запасов инсулина, содержащихся в b–клетках в данную единицу времени.
Несомненно, что обе фазы в секреции инсулина являются важными в поддержании нормального гомеостаза глюкозы. Однако в настоящее время значительно большее внимание уделяется именно первой фазе инсулиновой секреции. Предполагается, что это и есть главная детерминанта в «раннем» выделении инсулина в течение первых 30 минут после приема пищи или глюкозы.
Интересно отметить, что инсулиновый секреторный ответ панкреатических b–клеток на стимуляцию глюкозой заключается в развитии первой фазы, которая появляется сразу же после внутривенного введения глюкозы. Далее следует снижение секреции инсулина до самых низких значений и затем развитие пролонгированной второй фазы ответа. Первая фаза секреции инсулина развивается за счет активации КАТФ–зависимых (триггерных) каналов, которые повышают концентрацию кальция и, как предполагается, высвобождают гранулы из «готового к высвобождению» пула. Из этого следует, что вторая фаза влечет за собой приготовление гранул для опорожнения, возможно, включающее транслокацию и способность к наполнению перед экзоцитозом. Механизмы, ответственные за развитие второй фазы инсулиновой секреции, включают путь КАТФ–зависимых каналов по причине необходимости увеличения концентрации кальция и дополнительные сигналы независимо от КАТФ–зависимых каналов. Механизмы, лежащие в основе таких дополнительных сигналов, пока остаются неизвестными. Современные гипотезы предполагают повышение цитозольного длинноцепочечного ацетил–КоА, малат–пируватный цикл, «экспорт» глутамата из митохондрий, а также увеличение соотношения АТФ/АДФ.
У человека каждая b–клетка содержит около 10000 гранул инсулина, из которых только 100 представляют собой «готовый к высвобождению» пул.
Очевидно, что стимуляция высвобождения при помощи даже одного стимулятора секреции, такого как глюкоза, происходит согласно строго координированному взаимодействию многих факторов по отношению к передвижению гранул: прикрепление к плазматической мембране, приготовление к высвобождению (наполнение) и экзоцитоз. Общее количество инсулинсодержащих гранул в b–клетках значительно превышает количество, требуемое для контроля гликемии, связанной с однократным приемом пищи. Характерно, что лишь очень малый процент гранул и, соответственно, общего содержания инсулина в гранулах, секретируется в ответ на стимуляцию глюкозой [Proks P. еt al., 1996].
Хорошо известно, что существуют и неглюкозные стимулы секреции инсулина, такие как аминокислоты, свободные жирные кислоты и гормоны. Важную роль в стимуляции секреции инсулина играет и невральная регуляция.
Следует отметить также, что многие гормоны влияют на b–клетки, либо стимулируя, либо подавляя, либо модулируя инсулиновый ответ на глюкозу.
В последние годы большой научно–практический интерес вызывает изучение роли гормонов желудочно–кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека.
В этой связи следует подчеркнуть, что в литературе имеются данные, свидетельствующие о важной роли таких гормонов желудочно–кишечного тракта, как глюкагоноподобный пептид 1 (ГПП–1) и глюкозо–зависимый–инсулинотропный полипептид или желудочный ингибирующий пептид (ГИП). Эти гормоны получили название инкретины, а их действие, приводящее к усилению глюкозозависимой секреции инсулина b–клетками поджелудочной железы, было названо «инкретиновый эффект». Кстати, «инкретиновый эффект» был впервые описан в 1960 году, и приписывается пептидным гормонам, которые секретируются К– и L–клетками кишечника в ответ на прием пищи.
Наиболее популярным и наиболее изученным в настоящее время является ГПП–1.
ГПП–1 является посттрансляционным продуктом гена проглюкагона, членом суперсемейства глюкагона, в которое входят такие пептидные гормоны, как глюкагон, глюкагоноподобный пептид 1, глюкагоноподобный пептид 2, желудочный ингибирующий пептид и экзендин–4. В нашей статье основное внимание будет уделено именно ГПП–1.
ГПП–1 продуцируется энтеро–эндокринными L–клетками тонкого кишечника, и регуляция его секреции из эндокринных клеток ЖКТ осуществляется с помощью нескольких внутриклеточных сигналов, включая протеин киназу А, протеин киназу С и кальций. Многочисленные экспериментальные работы продемонстрировали, что секреция ГПП–1 контролируется нутриентами, а также невральными и эндокринными факторами. Следует отметить, что плазменные базальные уровни ГПП–1 у человека находятся в пределах от 5 до 10 пМ, и повышаются после приема пищи до 50 пМоль.
В исследованиях Kieffer T.Y. (1999), Drucker D.J. (1998), Massimo S.P. (1998) было показано, что ГПП–1 секретируется в ответ на прием смешанной пищи и таких отдельных нутриентов, как глюкоза, жирные кислоты и пищевые волокна. Так, пероральный прием глюкозы у человека приводил к двухфазному увеличению ГПП–1 в плазме, тогда как внутривенные инфузии глюкозы имели минимальный эффект [Hermann C., 1995]. В связи с тем, что большинство L–клеток, продуцирующих ГПП–1, расположены в дистальных отделах тонкого кишечника, быстрое повышение уровня ГПП–1 в плазме, наблюдаемое после приема пищи, может быть обусловлено непрямыми стимулирующими эффектами. В связи с чем Roberge J.N. (1993) было сделано предположение о наличии проксимально–дистальной петли, которая передает нутриент–стимулирующие сигналы из проксимальных отделов кишечника через невральные и эндокринные эффекты к дистальным L–клеткам.
При анализе экспериментальных работ было высказано предположение, что кандидатом на роль такого трансмиттера могут претендовать ГИП и ацетилхолин. Однако у человека ГИП не стимулирует секрецию ГПП–1, что было убедительного показано в исследованиях Nauck M.A. (1993). В литературе также обсуждается роль гастрин–продуцирующего пептида [Hermann–Rinke C., 2000] и n. vagus, который играет важную роль, обеспечивая быстрое высвобождение ГПП–1 из дистальных L–клеток в ответ на прием нутриентов [Rocca A.S., 1999].
Таким образом, двухфазная секреция ГПП–1, может происходить за счет интеграции гормональных и невральных факторов, которые стимулируют раннее выделение ГПП–1 (10–15 минут), а прямой нутриентный контакт с L–клетками стимулирует вторую фазу (30–60 минут) секреции ГПП–1 [Kieffer T.Y., 1999].
Хотя этот вопрос и менее изучен, необходимо также отметить, что подавляют секрецию ГПП–1 инсулин и соматостатин–28 [Hansen L., 2000], а также нейропептид галанин [Hermann–Rinke C., 2000].
Период полужизни циркулирующего, биологически активного ГПП–1 меньше, чем 2 минуты. Такой короткий период полужизни ГПП–1 в плазме обусловлен протеазной активностью фермента дипептидил пептидаза IV (ДПП–IV). ДПП–IV широко экспрессируется во многих тканях и органах, включая поджелудочную железу, ЦНС, сосудистую сеть эндотелия тонкого кишечника, находящегося в непосредственной близости к месту секреции ГПП–1.
Необходимо отметить, что первичный путь клиренса ГПП–1 осуществляется через почки с помощью механизмов, включающих гломерулярную фильтрацию и канальциевый метаболизм [Dearcor C.F., 1996]. В этой связи интерес представляют данные, что у пациентов после двусторонней нефрэктомии или у пациентов с уремией уровень иммунореактивного ГПП–1 в плазме был повышенным.
Множественные биологические эффекты ГПП–1 проявляются на самых различных уровнях (табл. 1).
Было установлено, что действие ГПП–1 не ограничивается только усилением экзоцитоза секреторных гранул, содержащих инсулин из b–клеток, а как следует из данных, представленных в таблице 1, ГПП–1 влияет также и на a–клетки поджелудочной железы, подавляя секрецию глюкагона, что, в свою очередь, ограничивает постпрандиальное повышение глюкозы.
ГПП–1 усиливает регенерацию островковых клеток путем воздействия на факторы транскрипции, такие как PDX–1. Этот ростовый эффект ГПП–1 может играть роль в адаптации островков к возрастающим требованиям к b–клеткам, например, в условиях инсулинорезистентности, на фоне ожирения. ГПП–1 имеет внепанкреатический эффект, включая инсулиннезависимое распределение глюкозы и улучшение чувствительности к инсулину [M.A. Nauck et al., 1997].
Определенный интерес представляют данные о том, что эффект действия ГПП–1 проявляется путем мощного усиления, подобно взрыву (вспышке) секреции инсулина. Однако введение ГПП–1 не влияет на частоту и амплитуду пульсовой секреции инсулина [Porksen W., 1998].
Кроме того, имеются доказательства того, что ГПП–1 действует как вещество, повышающее чувствительность b–клеток к глюкозе. Так, ГПП–1 может способствовать образованию АТФ в митохондриях. Во всяком случае, важное клиническое значение имеет тот факт, что препараты сульфонилмочевины, которые связываются с АТФ–чувствительными калиевыми каналами и закрывают их, вызывая тем самым деполяризацию мембраны и поступление ионов кальция внутрь клетки, могут выключать зависимость ГПП–1 от глюкозы. Так, введение ГПП–1 в изолированную поджелудочную железу крыс, находящуюся в перфузионном растворе с низкой концентрацией глюкозы, которая обычно не влияет на секрецию инсулина, приводило к значительной стимуляции секреции инсулина в случаях, когда в железу предварительно вводились препараты сульфонилмочевины. Показано, что цАМФ, образующийся в результате активации рецепторов ГПП–1, также может непосредственно влиять на процесс экзоцитоза, и, по оценкам исследователей, этот процесс составляет до 70% от всего секреторного инсулинового ответа. Клинически важным следствием зависимости эффектов ГПП–1 от концентрации глюкозы в крови, соответствующие нормальной или выше нормы гликемии натощак, конечно, является то, что ГПП–1 не может вызвать развитие выраженной гипогликемии (кроме, возможно, случаев одновременного применения с препаратами сульфонилмочевины).
Недавно было показано, что ГПП–1 способен ингибировать апоптоз b–клеток. В связи с тем, что нормальное количество b–клеток поддерживается равновесием процессов апоптоза и пролиферации, эти данные представляют огромный интерес и открывают возможность того, что ГПП–1 может оказаться эффективным при патологических состояниях, связанных с усиленным апоптозом b–клеток. Все это позволяет предположить, что ГПП–1 может быть способным стимулировать образование новых b–клеток (неогенез) у пациентов с сахарным диабетом 2 типа и недостаточным количеством функционирующих клеток (хотя еще не выяснено, насколько этот процесс выражен у человека).
Особый интерес представляют данные, касающиеся изучения секреции ГИП и ГПП–1 при сахарном диабете 2 типа.
Так, в исследовании Toft–Nielsen обнаружили, что уровни ГИП натощак у больных сахарным диабетом 2 типа близки к нормальным значениям. В то же время эти авторы, изучая секрецию ГПП–1 у больных сахарным диабетом 2 типа, выявили существенные нарушения этого этерогормона при данном заболевании.
При сравнении секреции инсулина в ответ на оральную и внутривенную нагрузку глюкозой при условии одинаковой концентрации глюкозы оказалось, что превышение секреции инсулина на пероральное введение у здоровых лиц достоверно выше, чем при сахарном диабете 2 типа [Nauck, 1986].
Говоря о нарушении инкретинового эффекта при сахарном диабете 2 типа, важно подчеркнуть, что при этом заболевании секреция ГПП–1 снижена на 20–30% при сохранении в целом его инсулиностимулирующего действия. В то же время следует подчеркнуть, что секреция ГИП при сахарном диабете не меняется, однако установлено снижение его стимулирующего влияния на b–клетки поджелудочной железы.
Причины этих нарушений окончательно не установлены, хотя большинство исследователей приходят к заключению, что нарушение секреции ГПП–1, очевидно, является следствием сахарного диабета 2 типа.
В заключение следует сказать, что в последнее десятилетие благодаря фундаментальным и клиническим исследованиям развилось новое и перспективное направление в лечении сахарного диабета 2 типа, основанное на использовании инкретинового эффекта. Так, изучены свойства и лечебный потенциал ГПП–1, и сегодня нет сомнений в его терапевтической эффективности. Принципиально важным моментом в этом плане являются глюкозозависимая стимуляция секреции инсулина и ингибирование секреции глюкагона. В то же время возможное торможение апоптоза b–клеток поджелудочной железы и усиление их регенерации дают определенную надежду на то, что при сахарном диабете 2 типа удастся остановить прогрессирующее снижение массы функционирующих b–клеток при развитии дефицита секреции инсулина.
Результатом многолетних клинических исследований, проводимых совместно компаниями «Эли Лилли» и «Амилин Фармасьютикалс», явилась разработка препарата Эксенатид, являющегося экзогенным функциональным аналогом ГПП-1 и первым представителем лекарственного класса инкретиновых миметиков. Эксенатид показан при сахарном диабете типа 2 в качестве дополнительной терапии к метформину, производным сульфонилмочевины или комбинации метформина и производных сульфонилмочевины для улучшения гликемического контроля. Неоспоримым преимуществом Эксенатида, делающим возможным его клиническое применение (в отличие от ГПП-1), явился длительный период полувыведения, составляющий 2,4 часа (1-2 минуты для ГПП-1). Аминокислотная последовательность Эксенатида частично соответствует последовательности человеческого ГПП-1, в результате чего он связывается и активирует рецепторы ГПП-1 у человека, приводя к усилению глюкозозависимого синтеза и секреции инсулина из b-клеток поджелудочной железы с участием циклического АМФ и/или других внутриклеточных сигнальных путей. При этом Эксенатид стимулирует высвобождение инсулина из b-клеток в присутствии повышенных концентраций глюкозы, минимально влияя на выброс инсулина при нормогликемии, что ведет к низкому риску гипогликемий. Нормализация углеводного обмена при назначении экзенатида достигается не только за счет глюкозозависимой стимуляции синтеза инсулина, но и за счет реализации таких важных эффектов, как подавление неадекватно повышенного уровня глюкагона, снижение аппетита, торможение эвакуации желудочного содержимого и увеличение массы b-клеток, обусловленное стимуляцией пролиферации и неогенеза, с одной стороны, и торможением апоптоза – с другой. Все вышеперечисленное вселяет уверенность, что инкретин миметики найдут свое достойное место в ряду препаратов, применяемых для лечения сахарного диабета.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Регуляция секреции инсулина
Регуляция секреции инсулина осуществляется контуром регуляции с каналом обратной связи, где регулируемым параметром является концентрация глюкозы в плазме крови:
1 Секреция инсулина стимулируется увеличением концентрации глюкозы в крови до 4,5 ммоль / л. Глюкоза входит через мембрану в бета-клетки через транспортеры GIUT-2, метаболизируется под влиянием глюкокиназы, следствием чего является увеличение синтеза АТФ в митохондриях АТФ ингибирует чувствительные к ней ионные калиевые каналы, что приводит к уменьшению выхода ионов К + из бета-клеток и их деполяризации.
2 Деполяризация мембраны бета-клеток инициирует раскрытие потенциалозалежних ворот Са 2+ -каналов. Растет вход ионов кальция, способствует секреции бета-клетками инсулина, который находился в гранулах. Вместе с инсулином секретируется также С-пептид. Выделение инсулина в ответ на гликемию осуществляется в две фазы: быстрая фаза - выделение готового инсулина из гранул, пролонгированная фаза - выделение новосинтезированного инсулина, пока не произойдет блокирование синтеза ингибиторами (рис 6.28).
3 При увеличении концентрации инсулина в крови снижается концентрация глюкозы в ней, что благодаря отрицательной обратной связи приводит к уменьшению секреции инсулина (рис. 6.29).
4 Увеличение концентрации инсулина в крови возникает также при повышении в плазме крови количества аминокислот (аргинина, лизина, лейцина). жирных кислот, а также некоторых гормонов: глюкагона, гастрина, секретина, шлунковоингибуючого пептида (ШИП), холецистокинина (ХЦК), глюкагоноподобного полипептида-1 (GLP-1), кортизона; под влиянием ацетилхолина - стимуляции М-холинорецепторов.
Подавляют секрецию инсулина
■ уменьшение концентрации глюкозы в крови - гипогликемия
■ соматостатин, который образуется дельта-клетками островков Лангерганса;
■ инсулин (большие концентрации в крови)
■ адренергическая стимуляция α-адренорецепторов;

РИС. 6.27. Паракринно регуляция секреции гормонов поджелудочной железы. Знак "+" - стимуляция секреции, знак "-" - торможение секреции

РИС. 6.28. Секреция инсулина бета-клетки
глюкозы в крови, приводит к стимуляции секреции инсулина бета-клетками и подавление секреции соматостатина дельта-клетками;
■ активация постганглионарных симпатических нервных волокон благодаря норадреналина, который при взаимодействии с альфа-адренорецепторами бета-клеток, подавляет секрецию инсулина. Норадреналин также стимулирует секрецию соматостатина (рис. 6.30).
Механизм действия инсулина на клетки-мишени
Действие инсулина на клетки-мишени происходит после связывания его с инсулиновыми рецепторами мембраны клетки.
РИС. 6.29. Контур регуляции секреции инсулина, где регулируемым параметром выступает концентрация глюкозы в крови. С - концентрация

РИС. 6.30. Регуляция секреции инсулина автономной нервной системой. Знак "+" - стимуляция, знак "-" - торможение
■ истощение запасов калия
■ блокада кальциевых каналов.
Регуляция секреции осуществляется также автономной нервной системой:
■ активация холинергических парасимпатических лостганглионарних волокон, при увеличенной концентрации
Инсулиновые рецепторы - это тетрамеры, имеющих две альфа- и две бета-гликопротеиновых субъединицы. Альфа субъединицы присоединяют инсулин и является внеклеточными, тогда как бета-субъединицы проникают сквозь мембрану клеток-мишеней и их внутренняя часть имеет тирозинкиназну активность. Тирозинкиназа фосфорилирует бета-субъединицы. Фосфорилированный рецептор затем фосфорилирует внутриклеточные белки, а некоторые дефосфорилюе. Комплекс "инсулин - рецептор" входит в клетку путем эндоцитоза.
Биологические эффекты, происходящие в клетках-мишенях под влиянием инсулина, является следствием фосфорилирования одних белков и дефосфорилювання других. Это приводит к образованию белков-транспортеров глюкозы через мембрану и накопление ее в клетках. В результате возрастает синтез гликогена, липидов. Процессы синтеза белков происходят медленнее. Через несколько часов и дней изменяется скорость процессов трансляции на рибосомах, и еще позже происходят процессы транскрипции ДНК в ядре клетки, приводящие к синтезу новых белков (рис. 6.31).
Инсулин регулирует количество рецепторов в клетках-мишенях - уменьшает их численность при ожирении, увеличивает - при голодании.
Регуляция выделения инсулина. Стимуляция секреции инсулина
Регуляция выделения инсулина. Стимуляция секреции инсулина
а) Регуляция секреции инсулина. Ранее предполагали, что секреция инсулина регулируется только концентрацией глюкозы в крови. Однако по мере изучения роли инсулина в метаболизме белков и жиров стало очевидно, что в такой регуляции важная роль отводится аминокислотам крови наряду с другими факторами (для облегчения понимания просим вас изучить таблицу ниже).

б) Увеличение глюкозы в крови стимулирует секрецию инсулина. Натощак, когда в норме уровень глюкозы колеблется от 80 до 90 мг/дл, скорость секреции инсулина минимальна — в пределах 25 нг/мин на 1 кг массы тела, что характеризует очень небольшую физиологическую активность. Если внезапно концентрация глюкозы в крови повышается в 2-3 раза относительно нормы и сохраняется на таком уровне в течение какого-то времени, секреция инсулина значительно повышается, причем как бы в два этапа, как это показано на рисунке ниже.
1. Концентрация инсулина в плазме увеличивается почти в 10 раз в течение 3-5 мин после быстрого подъема уровня глюкозы; это является результатом немедленного выброса уже заготовленного инсулина из бета-клеток островков Лангерганса. Однако высокий уровень высвобождения инсулина не сохраняется надолго, концентрация инсулина снижается, становясь равной почти половине нормальных значений через 5-10 мин.
2. Приблизительно через 15 мин начинается второй подъем инсулиновои секреции, формирующий плато к 2-3 ч; в это время скорость секреции обычно даже превышает предшествующий максимум. Наблюдаемый процесс является следствием как дополнительного высвобождения уже запасенного инсулина, так и активации ферментных систем, синтезирующих и высвобождающих новые порции инсулина из островков.

Увеличение концентрации инсулина в плазме крови после внезапного увеличения концентрации глюкозы в крови в 2-3 раза по сравнению с нормальным уровнем. Отметьте начальный быстрый подъем концентрации инсулина, затем отсроченный и более высокий и длительный подъем концентрации, начинающейся на 15-20 мин позже
в) Отношение по принципу обратной связи между концентрацией глюкозы в крови и уровнем секреции инсулина. Как только концентрация глюкозы в крови превысит 100 мг/дл крови, скорость секреции инсулина быстро нарастает и достигает пика, становясь в 10-25 раз выше уровня базальной секреции, когда концентрация глюкозы в крови достигает 400-600 мг/дл (для облегчения понимания просим вас изучить рисунок ниже).

Приблизительная секреция инсулина при различных уровнях глюкозы в плазме
Итак, увеличение секреции инсулина, стимулируемое глюкозой, чрезвычайно высоко как по скорости, так и по достигаемому уровню.
Прекращение инсулиновой секреции происходит столь же быстро, как и ее повышение, практически через 3-5 мин после снижения концентрации глюкозы в крови до уровня, регистрируемого в норме натощак.
Характер секреции инсулина, связанный с подъемом концентрации глюкозы, обеспечивается чрезвычайно важным для поддержания концентрации глюкозы в крови механизмом обратной связи. В соответствии с ним любое повышение глюкозы в крови увеличивает секрецию инсулина. А инсулин, в свою очередь, увеличивает поступление глюкозы в клетки печени, мышцы и прочие ткани и понижает уровень глюкозы, возвращая его к нормальным значениям.
Видео физиология гормонов поджелудочной железы и регуляции уровня глюкозы - профессор, д.м.н. П.Е. Умрюхин
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Электив на тему Сахарный диабет (текст) / 2 Синтез и секреция инсулина
Молекула инсулина построена из двух пептидных цепей: цепь А содержит 21 аминокислотный остаток, цепь Б - 30 остатков. Цепи соединены между собой двумя дисульфидными мостиками. Инсулины многих животных очень сходны по первичной структуре. С инсулином человека наиболее сходен инсулин свиньи, различие имеется лишь в одной позиции: в цепи В, 30-я позиция (С-концевой остаток) - у человека Тре, у свиньи Ала:
Образование инсулина из проинсулина. Стрелки указывают на гидролизуемые пептидные связи.
Инсулин образуется из препроинсулина в результате посттрансляционной модификации. Ген препроинсулина в геноме человека представлен единственной копией. В настоящее время интенсивно изучаются строение промоторной области и механизмы регуляции гена инсулина.
Синтез препроинсулина происходит на полирибосомах, связанных с эндоплазматическим ретикулумом. Препроинсулин проникает в люмен ретикулума, где от него отщепляется лидирующая последовательность - N-концевой фрагмент, содержащий 24 аминокислотных остатка. Образовавшийся проинсулин (86 остатков) перемещается в люмене к аппарату Гольджи, где упаковывается в секреторные гранулы. В аппарате Гольджи и секреторных гранулах происходит превращение проинсулина в инсулин. В этом участвуют две эндопептидазы: прогормон конвертазы 2 и 3 (ПГ2 и ПГ3; последнюю называют также ПГ1). Эти ферменты расщепляют связи Арг32-Глу33 и Арг65-Гли66. Затем С-концевые остатки Арг и Лиз отщепляются карбоксипептидазой Е (КП-Е; известна также как КП-Н) [Е и Н - лат.]. Этот фермент есть во многих других органах, где участвует в процессинге ряда гормонов и нейромедиаторов.
Т.о. в секреторных гранулах содержатся (и секретируются из них) инсулин и С-пептид в эквимолярных количествах. Долгое время С-пептид рассматривали как физиологически неактивное вещество. Однако недавно было обнаружено, что он в физиологических концентрациях стимулирует потребление глюкозы клетками мышц здорового человека и больных ИЗД примерно в такой же мере, как инсулин.
Глюкоза участвует в регуляции экспрессии гена инсулина, а также генов других белков, связанных с обменом основных энергоносителей. Транскрипция ряда генов, связанных с метаболизмом, активируется в поджелудочной железе, печени и жировых клетках при потреблении пищи, содержащей углеводы. Действие глюкозы может быть прямым, когда сама глюкоза или ее метаболиты непосредственно взаимодействуют с аппаратом регуляции гена, или вторичным, связанным с влиянием глюкозы на секрецию гормонов, главным образом инсулина и глюкагона. Однако выяснить, что является регулятором - инсулин или глюкоза, можно только при использовании клеточных культур, позволяющих строго контролировать содержание этих веществ в среде (табл. 1).
Таблица 1. Гены, индуцируемые глюкозой и инсулином
При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, а количество инсулиновой мРНК в клетке возрастает в результате активации транскрипции и стабилизации мРНК. Активация транскрипции требует образования метаболитов глюкозы на стадиях гликолиза. Синтез и секреция инсулина не являются прочно сопряженными процессами. Например, при отсутствии Ca2 + в среде глюкоза не стимулирует секрецию инсулина, в то время как синтез активируется. Глюкоза стимулирует синтез инсулиновой мРНК при продолжительной инкубации (2 - 72 часа). При инкубации в течение 1 часа сколько-нибудь существенного увеличения мРНК не происходит, и в то же время включение меченых аминокислот в проинсулин возрастает в 10 - 20 раз. При этом актиномицин D (ингибитор транскрипции) не подавляет синтез проинсулина. Из этого следует, что первоначальная стимуляция синтеза (в течение примерно 20 минут после добавления глюкозы) происходит с использованием предсуществующей мРНК и регулируется на уровне трансляции.
Секреция инсулина и С-пептида происходит путем экзоцитоза. Инсулин в растворе легко образует олигомерные агрегаты, преимущественно димеры и гексамеры; ионы цинка способствуют такой агрегации. В такой форме инсулин находится в секреторных гранулах. После секреции содержимого гранул в кровь олигомеры распадаются.
Глюкоза, аминокислоты (особенно аргинин и лизин), кетоновые тела и жирные кислоты в физиологических концентрациях стимулируют секрецию инсулина, причем стимуляция аминокислотами, кетоновыми телами и жирными кислотами проявляется при определенной (субстимулирующей) концентрации глюкозы. Лактат, пируват, глицерин не влияют. Глюкоза является главным регулятором секреции инсулина.
На рисунке показаны изменения концентрации инсулина в крови человека после приема пищи. Одновременно со стимуляцией -клеток к секреции инсулина происходит ингибирование секреции глюкагона из -клеток островков Лангерганса:
Изменение концентраций в крови глюкозы, инсулина и глюкагона после приема пищи.1 Ед инсулина содержит 0,4081 мг белка инсулина.
Время полураспада инсулина в крови - 3-10 мин, С-пептида - около 30 мин. Кровь при однократном прохождении через печень теряет до 60 % инсулина. В почках задерживается до 40% инсулина, содержащегося в протекающей через почки крови, причем в клубочках инсулин фильтруется, а затем, наряду с другими белками первичной мочи (альбумин, гемоглобин и др.), реабсорбируется и разрушается в клетках проксимальных канальцев.
Регуляция секреции инсулина зависит от глюкозосенсорной системы -клеток, обеспечивающей пропорциональность между концентрацией глюкозы в крови и секрецией инсулина. Потребление глюкозы -клетками происходит при участии ГЛЮТ1 (основной переносчик глюкозы в -клетках человека) и, возможно, ГЛЮТ2. Эта ступень не является лимитирующей: концентрация глюкозы в клетке быстро уравнивается с концентрацией в крови. В -клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV, как и в глюкозосинтезирующих органах - печени, почках), имеющей высокую Км для глюкозы - 12 мМ (Км гексокиназ I, II и III - от 0,2 до 1,2 мМ). Вследствие этого скорость фосфорилирования глюкозы практически линейно зависит от ее концентрации в крови. Кроме того глюкокиназа в -клетках - лимитирующее звено гликолиза. Поэтому глюкокиназа, вероятно, основной (но не единственный) элемент глюкозосенсорной системы -клеток. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета - диабет I типа у взрослых (MODY).
Специфический ингибитор глюкокиназы манногептулоза подавляет стимуляцию глюкозой синтеза и секреции инсулина. Это указывает на то, что непосредственные сигналы, регулирующие синтез и секрецию инсулина, образуются в результате метаболизма глюкозы. Природа этих молекул неизвестна. Согласно имеющимся представлениям, роль такой молекулы может выполнять АТФ (точнее - отношение [АТФ]/[АДФ]). Гипотеза обосновывается тем, что секреция инсулина стимулируется только метаболизируемыми веществами - источниками энергии. Например, глюкоза и глицеральдегид стимулируют секрецию пропорционально скорости их метаболизма. Глицерин не метаболизируется в b-клетках (низкая активность глицеролкиназы) и не стимулирует секрецию инсулина. Однако после обработки рекомбинантным аденовирусом, содержащим бактериальный ген глицеролкиназы, клетки приобретают способность отвечать на глицерин секрецией инсулина в такой же мере, как и на глюкозу.
Ряд данных указывает на участие в регуляции секреции инсулина не только гликолиза, но и митохондриальных процессов. В частности, существенное значение могут иметь анаплеротические (восполняющие, компенсирующие) реакции: пируват оксалоацетат, глутамат -кетоглутарат. Эти реакции увеличивают количество компонентов цитратного цикла, а следовательно и его мощность. Стимулированная глюкозой секреция инсулина усиливается некоторыми аминокислотами, жирными кислотами, кетоновыми телами: т. о. в стимуляции секреции участвует не только глюкоза, но все основные энергоносители. Иначе говоря, секреция инсулина пропорциональна калорийности потребляемой пищи. Окисление основных энергоносителей в цикле лимонной кислоты, усиленном анаплеротическими реакциями, может быстро привести к изменению отношений АТФ/АДФ и НАДН/НАД + в клетке. Изменение концентрации этих веществ в свою очередь приводит к появлению вторых вестников сигнала (возможно - Са2 + , цАМФ, диацилглицерол, инозитол-3-фосфат), которые включают процесс экзоцитоза инсулиновых гранул.
Механизмы активации экзоцитоза остаются неясными. Ряд экспериментальных данных указывает на участие Са2 + /кальмодулин-зависимой протеинкиназы (КаМПК), а также полифункциональной КаМПК II, которая найдена в островках крысы и активируется глюкозой.
Глюкокиназа - основной элемент глюкозосенсорного механизма -клеток - имеется также и в -клетках, а гликолиз ускоряется пропорционально внеклеточной концентрации глюкозы и в тех, и в других клетках. Между тем секреция гормона (инсулина и глюкагона соответственно) стимулируется глюкозой в -клетках и подавляется в -клетках. Возможно, это связано с тем, что в -клетках, в отличие от -клеток, очень высокая активность пируваткарбоксилазы (анаплеротический фермент), сравнимая с активностью в клетках, для которых характерен глюконеогенез (печень, почки). При этом наблюдается пропорциональность между увеличением концентрации цитрата и малата в клетках и секрецией инсулина. Можно думать, что какие-то метаболиты этих путей или связанная с ними активация пируват-малатного челночного механизма участвуют в сопряжении стимула с секрецией инсулина.
Популяция -клеток в островках неоднородна. В частности есть клетки с различной чувствительностью к глюкозе. Это еще один элемент глюкозосенсорного механизма: при высокой концентрации глюкозы увеличивается число клеток, секретирующих инсулин.
Нарушения секреции инсулина - одна из причин развития инсулиннезависимого сахарного диабета.
Читайте также:
