Трансплантация сердца. Распределение донорских сердец
Обновлено: 01.05.2024
В Российской Федерации 7 % взрослых людей страдают хронической сердечной недостаточностью (ХСН). Ежегодно, даже в условиях лечения в специализированном стационаре, умирает до 12 % больных с клинически выраженной ХСН. Единственное, что может помочь пациенту в терминальной стадии этого заболевания, — трансплантация сердца.
Не все нуждающиеся в операции доживают до ее проведения, но с тех пор как 46 лет назад бригада доктора Кристиана Барнарда провела первую в мире пересадку сердца от человека к человеку, у них по крайней мере появилась надежда на выздоровление.
История вопроса
Успехи трансплантологии связаны с развитием двух независимых сфер медицины: совершенствованием хирургической техники и методов анестезии с одной стороны, и достижениями иммунологии и фармакологии — с другой. Первое обеспечило удачное проведение операций, а второе — благополучное протекание послеоперационного периода.
Первые шаги
Еще в XVI веке итальянский хирург Гаспаро Тальякоцци после ряда неудачных экспериментов с пересадкой кожи от человека к человеку представил публике успешный результат аутотрансплантации (пересадки собственного органа реципиента, в данном случае — кожи). В 1596 году он описал свои наблюдения «силы и мощи индивидуальности» в труде «De Curtorum Chirurgia per Insitionem» (Замещающая хирургия с использованием пересадки).
Однако широкий интерес идея трансплантации органов вызвала лишь спустя 300 лет, когда хирурги массово приступили к практическим опытам. Вновь столкнувшись с проблемой отторжения, они обогатили медицину тремя важными выводами: межвидовые пересадки органов (ксенотрансплантации) всегда неуспешны; пересадки между представителями одного вида (аллогенетические трансплантации) в большинстве случаев тоже, причем повторные пересадки органов между одними и теми же донорами и реципиентами ускоряли отторжение; если между донором и реципиентом было кровное родство, вероятность благоприятного исхода операции значительно увеличивалась, причем пересадка собственных органов (аутотрансплантация) почти всегда были удачна.
Первая описанная в литературе успешная трансплантация датируется II веком нашей эры: индийский хирург Шушрата произвел пересадку кожи в ходе ринопластики.
А в III веке, если верить хроникам римской католической церкви, святые Дамиан и Косма пересадили потерявшему ногу от гангрены римскому дьякону Юстиниану конечность недавно умершего эфиопа.
Собачье сердце
В 1905 году в череде опытов по пересадке органов очередь дошла и до сердца. Первую трансплантацию сердца собаки-донора на сосуды шеи собаки-реципиента осуществили хирург, биолог и патофизиолог Алексис Каррель и физиолог Шарль Гатри, американцы французского происхождения. Донорское сердце проработало 2 часа.
В 1933 году американский физиолог Фрэнк Манн с коллегами повторил опыт Карреля и показал возможность функционирования гетеротопически (то есть размещенного в нетипичном месте) трансплантированного сердца собаки вплоть до 8 суток (собственное сердце собаки оставалось на месте и продолжало работать).
В ногу со временем шли и советские хирурги. Наиболее весомый вклад в экспериментальные основы трансплантации сердца в СССР внес Владимир Петрович Демихов. С 1946 по 1955 год он в нескольких сотнях экспериментов разработал 24 (!) варианта хирургической техники гетеротопической трансплантации сердца в грудную клетку. В некоторых опытах донорское сердце эффективно обеспечивало кровообращение собаки-реципиента в течение более чем 15 часов.
Борьба с ишемией
Самой явной проблемой, вставшей на пути хирургов, стала ишемия: в условиях недостаточного кровотока повреждались и ткани реципиента, и донорские сердца. Трансплантацию невозможно провести в сжатые сроки, поэтому хирурги и анестезиологи стали искать способы, позволяющие продлить время операции. Так были разработаны методы управляемой гипотермии и спроектированы аппараты искусственного кровообращения (ИК).
Управляемая гипотермия позволяет снизить кровопотерю, а также продлить время операции без повышения риска ишемизации тканей.
В 1953 году американские хирурги Уилфорд Нептун и Брайан Куксон с коллегами выполнили первую трансплантацию сердечно-легочного комплекса собаки в условиях глубокой гипотермии (во время операции в комнате поддерживалась температура порядка минус 4 °С).
В 1957 году американцы Уильям Вебб и Хизер Говард повторили этот эксперимент, подключив собаку-реципиента к аппарату ИК. Позднее они сообщили о пересадке в тех же условиях изолированного сердца. Они накладывали девять анастомозов между аортой, легочной артерией, легочной и полой венами. Правда, этот трансплантат профункционировал всего 7 часов.
К середине 60-х Норман Шумуэй и Ричард Лоуэр с коллегами из клиники при Стэнфордском университете разработали методику трансплантации сердца, которая используется по сей день: с использованием «локальной гипотермии» — местного охлаждения до 18–21 °С. С этого момента для успешного проведения операции осталось только одно препятствие — иммунологическое отторжение.
Причины отторжения
В 1952 году иммунологи Жан Доссе (Франция) и Барух Бенасерраф (США) вместе с генетиком Джорджем Снеллом (США) обнаружили, что важнейшие антигены, участвующие в отторжении трансплантата, – антигены главного комплекса гистосовместимости (HLA). За это открытие в 1980 году они были удостоены Нобелевской премии.
Существует порядка 150 вариантов антигенов HLA, и у каждого человека на мембранах клеток присутствует по шесть вариантов таких антигенов. Следовательно, возможно более триллиона их комбинаций – вероятность существования двух людей с одинаковыми комплексами HLA-антигенов близка к нулю, конечно, если они не однояйцевые близнецы. Идеально, если у донора и реципиента наблюдается несовпадение лишь одного антигена из шести. Операции проводят и в том случае, если не совпадают два, однако при этом увеличивается риск развития иммунологического отторжения.
На практике определение совместимости тканей — гистотипирование — осуществляется по лимфоцитам крови.
Со стороны «хозяина» основные эффекторы трансплантационного отторжения – это цитотоксические CD8 T-клетки и CD4 Т-клетки. Последние привлекают в зону отторжения трансплантата клетки воспаления (в том числе макрофаги). Распознание трансплантационных антигенов происходит либо непосредственно на клетках трансплантата, либо в ближайшей лимфоидной ткани.
Немалую роль в отторжении трансплантата могут сыграть и антитела в организме реципиента (например, появившиеся из-за предшествующего переливания цельной крови). Взаимодействуя с антигенами эндотелия сосудов, пронизывающих трансплантат, они инициируют систему комплемента и каскад реакций, приводящий к закупорке сосудов.
Иммуносупрессия
Первыми веществами, которые начали использовать для подавления иммунного ответа, стали кортикостероиды.
В 1948 году американский врач Филип Хенч, применив кортизон в лечении ревматоидного артрита, показал, что препарат обладает выраженным противовоспалительным действием. В 1952 году американский хирург Роджер Бэйкер с коллегами продемонстрировал, что кортизон может использоваться и для иммуносупрессии после трансплантации.
В 1962 году американцы Уиллард Гудвин и Мэтт Мимс впервые использовали азатиоприн — иммуносупрессивный препарат, обладающий наибольшей активностью в отношении Т-лимфоцитов, для предотвращения острого отторжения трансплантированной почки. Пациентам с пересаженным сердцем также планировалось назначать азатиоприн в сочетании с кортикостероидами.
Очередь человека
Человеку сердце было впервые пересажено в 1964 году. Джеймс Харди с коллегами трансплантировали сердце крупного шимпанзе, весившего более 43 кг, больному 68 лет с тяжелой формой ИБС в терминальной стадии прогрессирующей сердечной недостаточности. Вначале трансплантат работал удовлетворительно, однако через час после отключения аппарата ИК развилась острая сердечная недостаточность, обусловленная объемной перегрузкой трансплантата, и больной погиб.
В СССР первая успешная трансплантация сердца была осуществлена в 1987 году знаменитым врачом-трансплантологом академиком АМН СССР Валерием Ивановичем Шумаковым (1931–2008).
Успех первого клинического опыта увлек медицинское сообщество, и к решению задачи трансплантации сердца обратились хирурги всего мира. Однако большинство пациентов умирало вскоре после проведения операции, и интерес исследователей начал угасать: если в 1968 году было проведено 100 трансплантаций сердца, то в 1970 — всего 18. Главной причиной смерти оставалось отторжение пересаженных органов.
Лишь четверо из прооперированных в период с 1967 по 1973 год прожили с новым сердцем дольше года; с 1974 по 1983 год годичная выживаемость увеличилась до 60 %, а вот пятилетняя составила лишь 21 %.
Иммунологи и фармакологи берутся за дело
В 1983 году увенчались успехом клинические исследования нового иммуносупрессора — циклоспорина, нерибосомного полипептида, получаемого из почвенных грибов вида Beauveria nivea. Его выделили в 1970 году в рамках программы по скринингу новых антибиотиков. В 1972 году бельгийский иммунолог Жан-Франсуа Борель открыл способность циклоспорина ингибировать культуру лимфоцитов при отсутствии общего цитостатического эффекта. В конце 70-х британский хирург Рой Калне провел первые испытания эффективности циклоспорина после трансплантации сердца и почек на экспериментальных животных. Его внедрение в широкую практику открыло новую эру в трансплантации сердца, поскольку позволило значительно продлить жизнь пациентов после трансплантации. В 1994 году было одобрено использование для послеоперационной терапии еще одного нового иммуносупрессора — такролимуса (FK-506) из группы макролидов, продуцируемого актиномицетом Streptomyces tsukubaensis. В 1987 году японские иммунологи Шиничи Савада и Джен Судзуки в экспериментах in vitro обнаружили, что такролимус в 100 раз активнее циклоспорина подавляет пролиферацию Т-лимфоцитов. В исследованиях на крысах, собаках и приматах, проводившихся с 1988 по 1993 год, такролимус обеспечивал профилактику отторжения трансплантата в дозах в 10–100 раз более низких, чем циклоспорин, и с меньшим количеством побочных эффектов. Впрочем, модификации циклоспорина, разработанные в то же время, обладали аналогичными преимуществами.
Последние успехи иммуносупрессии связаны с поли- и моноклональными антителами (подробно об этом мы рассказывали в КС № 5 (118) 2013, статья «Достижения фармацевтики: моноклональные антитела»), позволяющими предотвратить стероид-резистентное — не купируемое даже пульс-терапией метилпреднизолоном — отторжение тканей, которое встречается с частотой 10–18 %.
В настоящее время используется трехкомпонентная схема иммуносупрессивной терапии: циклоспорин А или такролимус в сочетании с метилпреднизолоном и микофенолата мофетилом (цитостатиком, который наиболее эффективен в отношении лимфоцитов). Препараты антилимфоцитарных антител (ALG, ATG, ОКТ-3) применяются в качестве вводной терапии, а также при выраженных признаках отторжения или стероид-резистентном отторжении.
Современная статистика
На сегодняшний день в мире проведено уже более 15000 трансплантаций сердца. 10-летняя выживаемость пациентов составляет около 50 %. Самая большая летальность — в первый год после операции (в разных клиниках – от 15 до 25 %). Основные причины смерти — инфекционные заболевания и саркома Капоши, развивающиеся на фоне иммуносупрессивной терапии.
Описаны и счастливые случаи, когда пациенты с трансплантированным сердцем прожили более 25 лет. Мировым рекордсменом стал Тони Хьюзман — пациент клиники при Стэнфордском университете. Его прооперировали в 1978 году, показанием послужила дилатационная кардиомиопатия. После трансплантации он прожил 30 лет и умер в 51 год от рака кожи.
В мире ежегодно выполняется от 2,7 до 4,5 тысяч трансплантаций сердца. Из них в России — всего около 100 операций. Лидер по количеству трансплантаций — США: там проводится до двух тысяч пересадок сердца ежегодно.

На сегодняшний день в России существует 10 центров, осуществляющих трансплантацию сердца (все данные приведены в соответствии с информацией, опубликованной в журнале «Вестник трансплантологии» за 2009–2013 год).

Показания для проведения операции по пересадке сердца
Диагноз:
- кардиомиопатии различного генеза;
- доброкачественные опухоли сердца;
- неоперабельные врожденные пороки сердца (например, гипоплазия левого желудочка).
Клинико-функциональная характеристика пациентов:
- хроническая сердечная недостаточность III-IV ФК по NYHA, резистентная к медикаментозной терапии;
- фракция выброса ЛЖС < 30%;
- конечно-диастолический размер ЛЖС > 7 см;
- конечно-диастолическое давление ЛЖС > 20 мм рт. ст.
- сердечный индекс (CI) < 2,5 л / (мин × м 2 );
- рефрактерность желудочковых тахиаритмий;
- ожидаемая выживаемость потенциального реципиента без трансплантации сердца < 6–12 мес.;
- возраст до 55 лет.
Абсолютные противопоказания:
- стойкая легочная гипертензия (транспульмональный градиент давления > 15 мм рт. ст., общее легочное сопротивление (ОЛС) > 5 ед. Вуда, систолическое давление в легочной артерии более 60 мм рт. ст.);
- острые инфекционные заболевания и/или обострение хронических;
- необратимая полиорганная недостаточность;
- злокачественные новообразования в анамнезе;
- тромбофлебит;
- системные заболевания;
- ожирение (> 30 % должной массы тела);
- психические заболевания, алкоголизм, наркомания;
- недисциплинированность в приеме медикаментов, несоблюдение больничного режима.
Относительные противопоказания
- активный диффузный миокардит;
- инсулинозависимый сахарный диабет;
- язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения;
- нарушение мозгового кровообращения в анамнезе;
- инфицирование вирусами гепатита С и гепатита В;
- атеросклероз сосудов нижних конечностей;
- ограниченная поддержка семьи.
Задачи на будущее
Только порядка 10–15 % больных, ожидающих трансплантацию сердца, доживают до ее проведения. Один из вариантов продления жизни до момента операции — установка искусственного сердца. Средняя выживаемость пациентов с таким протезом — около года. Если за это время подходящего донора не нашлось, больной может погибнуть, как правило, из-за тромботических осложнений. К сожалению, гемодинамические характеристики искусственных сердец пока далеки от совершенства. Новейшее достижение в этой области принадлежит немецкой компании «Berlin Heart»: разработчики заменили механические подшипники прибора миниатюрной турбинкой, подвешенной в управляемом магнитном поле. Это позволило значительно снизить тромбообразование в протезированном сердце.
Член Совета Европейского общества трансплантологов, директор НИИ трансплантологии и искусственных органов академик РАМН Сергей Готье в «Вестнике трансплантологии и искусственных органов» (№ 3, 2012 год) отмечает, что главная причина, по которой в нашей стране не выполняется необходимое количество трансплантаций, — отрицательное отношение населения к посмертному донорству органов. Нужно отметить, что в России, в отличие от США и стран Западной Европы, действует презумпция согласия: закон допускает изъятие тканей и органов у трупа, если умерший или его родственники не выразили своего несогласия.
Интересная методика, позволяющая продлить жизнь ожидающим пересадку сердца пациентам с дилатационной кардиомиопатией, разработана в 2002 году специалистами Научного центра хирургии РАМН во главе с доктором медицинских наук Алексеем Коротеевым. Его команда успешно опробовала на практике следующую методику: после курса интенсивной кардиотерапии больному делают спиральную томографию, чтобы создать точную трехмерную компьютерную модель сердца. Затем по индивидуальному муляжу шьется сетка из специального полиэфирного материала – дакрона. В ходе последующей операции сетку надевают на живое сердце, что препятствует дальнейшей дилатации.

До сих пор актуален поиск эффективной терапии послеоперационных осложнений. Большинство из них (инфекции, саркома Капоши, поражение почек и печени, а также быстрое развитие атеросклероза коронарных сосудов трансплантата) развиваются из-за постоянного использования иммуносупрессоров.
Возможно, когда-нибудь этих проблем удастся избежать, например, «вырастив» для пациента его собственное сердце in vitro из стволовых клеток. В апреле 2006 года ученые калифорнийского Института регенеративной медицины под руководством доктора Энтони Аталы сообщили об успешном выращивании и пересадке пациентам купола мочевого пузыря. Но структурированную ткань сердечной мышцы ни одному коллективу исследователей вырастить не удалось, по крайней мере, пока.
Трансплантация сердца. Распределение донорских сердец


- НИО хирургии аорты, коронарных и периферических артерий
- НИО новых хирургических технологий
- НИО хирургической аритмологии
- НИО эндоваскулярной хирургии
- НИО сосудистой и гибридной хирургии
- НИО онкологии и радиотерапии
- НИО ангионеврологии и нейрохирургии
- НИО анестезиологии и реаниматологии
- НИО лучевой и инструментальной диагностики
- Состав совета по защите докторских и кандидатских диссертаций
- Требования к соискателям
- Соискатели
- Апелляции
- ГОСТ по оформлению диссертации и автореферата
- Контакты совета
- Генеральный директор Центра
- Руководство Центра
- Миссия
- История
- Мероприятия
- Фотопроекты
- Истории пациентов
- Нормативные документы
- Структура отдела
- Организационно-методическая работа с регионами
- Развитие телемедицинских технологий
- Кадровая политика и повышение квалификации
- Публичный отчет
- Устав и регистрационные документы
- Лицензии
- Публичный отчет
- Сведения о медицинских работниках
- План развития Центра
- Политика обработки персональных данных
- Охрана труда
- Политика в области охраны труда
- Противодействие коррупции
- Учетная политика

Сложнейшая операция, требующая высочайшегоо мастерства хирургов и полной совместимости реципиента и донора
На базе НМИЦ им. акад. Е.Н. Мешалкина проводятся сложнейшие и уникальные операции по пересадке сердца. Трансплантация сердца - дорогостоящее лечение, требующее от медицинского персонала высочайшей квалификации и многолетнего опыта. Для проведения хирургического вмешательства необходима полная совместимость тканей пациента и донорского органа. Недостаток донорских органов обуславливает ограниченное количество этого вида оперативного лечения. Но несмотря на это, надежда и желание жить никогда не угасает в людях, и мы готовы помогать таким пациентам. В нашей клинике создана целая команда врачей, которая занимается лечением пациентов с трансплантированным сердцем.
ПОКАЗАНИЯ ДЛЯ ТРАНСПЛАНТАЦИИ
К необходимости операции по пересадке сердца чаще всего приводит дилатационная кардиомиопатия, когда размеры сердца начинают увеличиваться, сердечная мышца "растягивается", а сокращения ее становятся все слабее. Второе место среди заболеваний, приводящих к необходимости пересадки сердца, занимает ишемическая болезнь сердца, часто приводящая к образованию инфарктов миокарда с последующими рубцовыми полями, что приводит к потере сердцем способности выполнять эффективные сокращения. Небольшой процент больных, которым показана пересадка сердца, составляют пациенты с клапанными пороками.
Для того чтобы продлить жизнь пациента до того времени, пока будет найдено донорское сердце, у него приходится применить, по выражению трансплантологов, «мост», т.е. ту или иную методику, улучшающую кровообращение. Первая из них - «фармакологический мост» - интенсивное использование мощных кардиотонических средств. Часто эти лекарственные средства через некоторое время уже не в состоянии обеспечить нужный уровень кровообращения в организме, тогда приходится переходить к «механическому мосту» - применению различных механических насосных устройств - искусственное сердце, которое частично, а иногда и полностью обеспечивает кровообращение.
ЧТО НЕОБХОДИМО ДЛЯ ТРАНСПЛАНТАЦИИ
Для того чтобы не произошло отторжения донорского органа необходимо соблюдение ряда правил. Прежде всего необходимо чтобы донор и реципиент были схожи по антигенам гистосовместимости, которые у человека объединены в систему HLA (Human leucocyte antigens). По результатам теста на совместимость производится подбор наиболее подходящих донора и реципиента.
При помощи второго теста (cross-match) определяются потенциально опасные антитела у реципиента, которые могут повредить трансплантат. Если в крови реципиента их много, высока вероятность отторжения донорского органа.
ТЕРАПИЯ ПОСЛЕ ТРАНСПЛАНТАЦИИ
Из-за реакции иммунной системы организма на чужеродный орган, после трансплантации сердца необходим прием препаратов, не позволяющих организму отторгнуть донорское сердце. Человеку с трансплантированным сердцем необходимо регулярно поддерживать связь с лечащими врачами, прежде всего кардиологами. Специалисты НМИЦ в клинике и после выписки будут следить за вашим состоянием здоровья, делать тесты, чтобы убедиться в том, что ваше новое сердце работает правильно. В первый год после операции, необходимо относиться к своему здоровью с особой осторожностью, чтобы избежать инфекционных осложнений.
В большинстве случаев, люди хорошо себя чувствуют после операции. Могут ходить на работу и вести активный образ жизни. В Клинике им. акад. Е.Н. Мешалкина ежегодно проводятся несколько трансплантаций. Опытные специалисты проводят эту сложнейшую процедуру на высшем уровне. Заботливый медицинский персонал помогает сделать период ожидание донорского органа и послеоперационный период максимально комфортным для пациента.
Трансплантация сердца. Распределение донорских сердец
Трансплантация сердца. Распределение донорских сердец
Трансплантация сердца продолжает считаться «золотым стандартом» лечения пациентов с сердечной недостаточностью в терминальной стадии, резистентной к AT. Успех операций по пересадке сердца неуклонно растет, вместе с тем ужесточаются требования к реципиентам и совершенствуются методы работы с донорскими органами. С появлением в середине 1980-х гг. и дальнейшим развитием терапии циклоспорином в трансплантологии наступила новая эра — циклоспорин полностью изменил схемы иммунной супрессии и терапии отторжения трансплантата.
В этой статье рассматривается роль трансплантации сердца как хирургического метода лечения пациентов с тяжелой СН.
В США распределение донорских органов осуществляется под наблюдением организации United Network of Organ Sharing (UNOS), которая является частной организацией и работает по контракту с федеральным правительством. В структуре донорства США разделено на 11 географических регионов. Согласно правилам UNOS, распределение органов, извлеченных из грудной полости, происходит на основании группы крови, класса медицинской срочности и времени постановки в лист ожидания. Физиологический лимит ишемии донорского сердца составляет 4 час, при его превышении сердце исключают из банка органов.
В настоящее время основным приоритетом выбора реципиента служит тяжесть заболевания.

Каждому кандидату, который находится в листе ожидания, присваивают медицинский статус, соответствующий классу срочности предыдущего кандидата, которому уже запланирована операция. Для кандидатов > 18 лет класс срочности присваивают следующим образом (UNOS, статья 3.73). Статусу 1А соответствуют пациенты с устройством поддержки деятельности желудочков сердца и/или находящиеся на госпитализации; с имплантированным искусственным сердцем; те, кому проводят экстракорпоральную мембранную оксигенацию (ЭКМО) или баллонную контрпульсацию. Пациенты, которым проводят инвазивныи контроль гемодинамики, и пациенты, находящиеся на терапии > 2 инотропных препаратов, также соответствуют статусу 1А.
Данный статус действителен в течение 30 сут, если пациента не исключают из списка. После имплантации ЛЖУВК пациент остается в статусе 1А также в течение 30 сут, а затем переходит в статус 1В, если только в течение этого периода не разовьется инфекция или искусственный желудочек не выйдет из строя. Статусу 1В соответствуют пациенты, находящиеся на госпитализации, пациенты с левым или правым искусственным желудочком, после того как они пробыли в статусе 1А в течение первых 30 сут или продолжают получать инотропную терапию. Тем кандидатам, которые не соответствуют критериям включения в статус 1А или 1В, присваивается статус 2.
Пациенты в статусе 2, как правило, стабильны, находятся на амбулаторном режиме и получают соответствующее лечение. Некоторым пациентам присваивают статус 7: они временно не могут получить трансплантат (с документами, регулирующими данную систему распределения, можно ознакомиться на сайте Organ Procurement and Transplantation network).
- Вернуться в оглавление раздела "Кардиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Трансплантация сердца
Трансплантация сердца – это шанс для пациентов, имеющих любое из следующих состояний и имеющих высокий риск смерти, и серьезные симптомы, несмотря на оптимальное использование препаратов и медицинской аппаратуры:
Сердечная недостаточность Сердечная недостаточность (СН) Сердечная недостаточность (СН) – синдром дисфункции желудочков сердца. Левожелудочковая недостаточность приводит к развитию одышки и быстрой утомляемости, правожелудочковая недостаточность –. Прочитайте дополнительные сведенияТрансплантация также может быть показана пациентам, которые
Не могут быть отлученными от временных сердечно-вспомогательных аппаратов после инфаркта миокарда или нетрансплантационных кардиохирургических операций
Имеют сердечные осложнения заболеваний легких, требующие трансплантации легких
Единственным абсолютным противопоказанием для трансплантации сердца является
Легочная гипертензия, которая не реагирует на предоперационное лечение
Относительные противопоказания включают органную недостаточность (например, легочную, почечную, печеночную) и локальные или системные инфильтративные нарушения (например, саркому сердца, амилоидоз).
Желудочковый аппарат вспомогательного кровообращения: переходной этап к трансплантации и целевое лечение
В последние годы имплантируемые желудочковые аппараты вспомогательного кровообращения значительно улучшились, и эти устройства используются для лечения некоторых пациентов, которым ранее требовалась бы трансплантация сердца, и пациентов, для которых трансплантация противопоказана. Эти устройства обычно используются для оказания помощи в работе левого желудочка в качестве промежуточной меры (переходный этап к трансплантации) или долгосрочного (целевого) лечения у пациентов, не являющихся кандидатами на трансплантацию. Устройства становятся все более компактными, имеющими целью имплантации батарейного отсека под кожу и использования индукционной зарядки. Проблему представляет инфекция, которая может возникать в месте введения под кожу канюлей. Тем не менее, в настоящее время имеются данные о пациентах, которые пережили операцию и хорошо себя чувствуют в течение нескольких лет после того, как эти устройства были имплантированы.
Методика
Донорское сердце хранится в условиях гипотермии. Оно должно быть трансплантировано в течение 4–6 часов. Реципиент находится на аппарате искусственного кровообращения; сердце реципиента удаляют, сохраняя in situ заднюю стенку правого предсердия. Затем сердце донора трансплантируют ортотопически (в нормальном положении) с формированием аортальных анастомозов, анастомозов легочных артерий и вен; простой анастомоз соединяет оставшуюся заднюю стенку предсердия с донорским органом. Использование in vitro насосной системы, изменяющей метаболизм клеток донорского сердца и, следовательно, продлевающей его жизнеспособность до пересадки на более, чем на 4-6 часа, находится в стадии изучения.
Схемы иммуносупрессивной терапии разнообразны, но подобны тем схемам, которые применяются при трансплантации почек Методика и трансплантация печени Методика (например, моноклональные антитела к рецепторам IL-2, ингибиторы кальциневрина, кортикостероиды—см. таблицу Иммуносупрессанты, используемые для лечения реакции отторжения трансплантата [Immunosuppressants Used to Treat Transplant Rejection] Иммуносупрессанты, применяемые при лечении реакции отторжения трансплантата ).
Осложнения при трансплантации сердца
Отторжение
У 50–80% пациентов наблюдается по крайней мере 1 эпизод отторжения Отторжение Трансплантатами могут быть собственные ткани пациента (аутотрансплантанты; например, кости, костный мозг и трансплантаты кожи) Генетически идентичная (сингенная [от монозиготных близнецов]). Прочитайте дополнительные сведения (в среднем 2–3); у большинства пациентов он протекает бессимптомно, но у примерно 5% развиваются дисфункция легочной вентиляции или предсердные аритмии. Максимальное число случаев острого отторжения приходится на 1-й месяц, их число снижается в следующие 5 месяцев и стабилизируется к году.
Факторы риска отторжения включают:
Женщина или чернокожий донор
Несовпадение по главному комплексу гистосовместимости человека
Возможно, цитомегаловирусная инфекция
Поскольку повреждение трансплантата может быть необратимым и катастрофическим, один раз в год проводят биопсию эндомиокарда; при этом в образцах определяют степень и распространенность инфильтратов клеток мононуклеаров и наличие поврежденных миоцитов. При дифференциальной диагностике исключают ишемию вокруг операционной области, цитомегаловирусную инфекцию, идиопатическую В-клеточную инфильтрацию (эффект Quilty).
Слабая степень отторжения (стадия 1) без существенных клинических проявлений не требует никакого лечения; средняя и тяжелая степени отторжения (стадия от 2 до 4) или слабая степень с клиническими проявлениями лечатся с помощью импульсной терапии кортикостероидами (500 мг или 1 г ежедневно в течение нескольких дней) и антитимоцитарным глобулином при необходимости (см. таблицу Признаки отторжения трансплантата сердца по категориям [Manifestations of Heart Transplant Rejection by Category] Проявления отторжения трансплантата сердца по категориям* ). Шкала оценок отклонения отображает прогрессирующие уровни изменений при гистологическом исследовании образцов биопсии.
Васкулопатия аллотрансплантата сердца
Основное осложнение при трансплантации сердца – поражение кровеносных сосудов сердечного аллотрансплантата, форма атеросклероза, при которой происходит диффузное сужение или облитерация просвета сосудов (у 25% пациентов). Это полиэтиологическое заболевание, и его развитие зависит от возраста донора, холодовой или реперфузионной ишемии, дислипидемии, применения иммуносупрессантов, хронического отторжения и вирусной инфекции (аденовирус у детей, цитомегаловирус у взрослых).
С целью ранней диагностики во время эндомиокардиальной биопсии часто проводят стресс-тест или коронарную ангиографию с внутрисосудистым ультразвуковым исследованием или без него.
Лечение заключается в агрессивном снижении уровня липидов Лечение Дислипидемией называют либо повышение уровней холестерина, триглицеридов (ТГ) или того и другого, либо низкий уровень холестерина липопротеинов высокой плотности в плазме, что способствует. Прочитайте дополнительные сведенияПрогноз при трансплантации сердца
Однолетняя выживаемость после трансплантации сердца составляет 85–90%, а ежегодная смертность в дальнейшем – около 4%.
Предтрансплантационные предикторы 1-летней смертности включают в себя
Потребность в предоперационной вентиляции или аппарате для поддержки функции левого желудочка
Реципиент или донор женского пола
Другие диагнозы, кроме сердечной недостаточности или ишемической болезни сердца
Посттрансплантационные прогностические факторы включают:
Повышение уровней С-реактивного белка и тропонина
Причиной смерти в течение первого года наиболее часто является острое отторжение или инфицирование; после первого года –васкулопатия аллотрансплантата сердца или лимфопролиферативные заболевания.
У реципиентов, которым было пересажено сердце и которые прожили > 1 года, отмечаются отличные показатели функционального статуса; возможность физических упражнений ниже нормы, но достаточна для ежедневной активности и может повыситься с течением времени в связи с симпатической реиннервацией. Более 95% пациентов достигает I функционального класса по классификации Нью-Йоркской ассоциации кардиологов (NYHA) Классификация выраженности хронической сердечной недостаточности Нью-Йоркской кардиологической ассоциации (NYHA) , и > 70% возвращаются к работе на полный рабочий день.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Правила распределения органов от скончавшихся доноров Принципы распределения
Существует единый общеизраильский список людей, ожидающих трансплантации, который содержит их данные.
• Каждый пациент, являющийся жителем Израиля, в соответствии с медицинскими рекомендациями имеет право быть включенным в список ожидающих трансплантации.
• Данные всех пациентов, ожидающих трансплантации в Израиле, находятся в компьютерной базе данных Национального центра трансплантаций. Эти данные постоянно обновляются и содержат различные медицинские сведения.
• В отношении каждого органа существует система критериев для его распределения, устанавливаемая в соответствии с параметрами, требуемыми для совместимости между донором и реципиентом (например, группа крови, вес и рост), и с параметрами самого органа с иммунологической точки зрения (степень необходимости тканевой совместимости), а также с шансами на обеспечение качества жизни и на спасение жизни (данные возраста, продолжительность времени ожидания, результаты анализа крови и т.п.). Эти критерии встроены в компьютерную программу, разработанную и установленную специально для каждого органа.
• Когда в какой-либо из израильских больниц находится донор, семья которого разрешила пожертвование, его данные передаются в Национальный центр трансплантаций и вводятся в компьютерную систему.
• Система сравнивает данные донора с данными людей, ожидающих пересадки, и выявляет пациентов, наиболее подходящих для пересадки органа.
• Система распределения органов действует на основе равноправности и «прозрачности».
• Руководящий комитет центра трансплантаций проводит периодические проверки распределения органов и выполняет обновления программы распределения в соответствии с необходимостью и научным прогрессом в области трансплантологии.
• В случае дилеммы, когда компьютер находит двух или более пациентов с равными правами на получение органа, Национальный центр трансплантаций обращается к консультантам – специалистам с целью медицинского обсуждения и принятия решения, кому будет пересажен орган. Если на этом этапе не удается прийти к решению, центр трансплантаций продолжает консультации с дополнительными специалистами, специально назначаемыми для этой цели и не связанными ни по работе, ни как-либо иначе с теми больницами, где должны производиться пересадки. При необходимости в принятии решения участвует также председатель руководящего комитета, а иногда даже генеральный директор Министерства здравоохранения.
• Предоставление преимущества в очереди на пересадку органа в соответствии с программой предоставления таких преимуществ основывается на Законе о пересадке органов, параграф 9.
Принципы
Распределение донорских сердец осуществляется согласно соответствию группы крови и веса тела между донором и реципиентом и согласно времени ожидания в очереди на пересадку. Во внимание также принимается серьезность состояния различных кандидатов на пересадку. Список ожидающих делится на две части в соответствии с серьезностью болезни: статус 1 и статус 2 (подробности приведены ниже).
Список ожидающих пересадки
Запись на пересадку сердца проводится без возрастных ограничений.
Список статуса 1: кандидаты в состоянии, требующем срочной пересадки, в т.ч.
А. Больные, находящиеся в больнице ввиду своего тяжелого состояния и нуждающиеся в медикаментах, постоянно вводимых внутривенно, и/или механической поддержке с помощью насоса.
Б. Кандидаты с искусственным сердцем, даже если они не находятся постоянно в больнице.
Список статуса 2: Ожидающие пересадки больные, включенные в этот список, находятся у себя дома в относительно стабильном состоянии болезни.

Метод распределения
Когда находится сердце для пересадки, в компьютер вводятся данные о группе крови и физических данных (вес и рост) донора, и компьютер выдает список ожидающих кандидатов на пересадку, подходящих с точки зрения размеров тела (до 20% больше или меньше, чем у донора) с учетом времени ожидания в очереди (более длительное время ожидания дает преимущество).
При принятии решения о распределенииии первым фактором является медицинская срочность пересадки, поэтому пересадка предлагается прежде всего пациентам статуса 1. Вторым фактором здесь является группа крови.
Прежде всего, рассматриваются кандидаты с той же группой крови, и только, если нет кандидата на срочную пересадку с той же группой крови, проверяется возможность пересадки данного сердца другому срочному больному с совместимой группой крови, подходящему с точки зрения соответствия размеров тела между ним и донором.
В случае, если имеются два или более кандидата на одно и то же донорское сердце, врачи – кардиологи, ведущие этих больных, совещаются между собой, и решают, кто из ожидающих находится в более тяжелом состоянии и получит донорское сердце. Если же они не приходят между собой к согласию, решение принимает «внешний» кардиолог (не связанный с теми больницами, где выполняются пересадки сердца), назначаемый для этой цели Национальным центром трансплантаций, после того, как выслушает мнения сторон. Чтобы гарантировать принятие правильного и заслуживающего доверия решения, «внешний» врач посещает срочных больных статуса 1 в их больничных отделениях. Такие посещения производятся время от времени совместно с представителем Национального центра трансплантаций.

Принципы
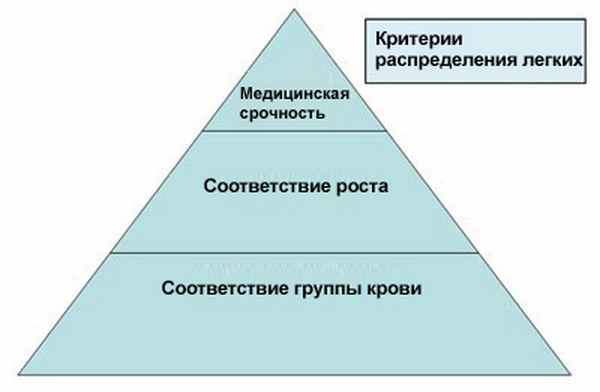
Выделение донорских легких осуществляется согласно соответствию группы крови и серьезности болезни, а также соответствию роста между донором и реципиентом. Метод выделениРаспределение донорских легких осуществляется согласно соответствию группы крови и серьезности болезни, а также соответствию роста между донором и реципиентом. Метод распределения основан на оценке LAS (Lung Allocation Score), принимающей в расчет: возраст, время ожидания, вид заболевания легких и характеристики легочной активности, измеряемые рядом параметров.
Тяжесть заболевания: диапазон оценки LAS от 27 до 80, причем более высокая оценка соответствует более серьезному медицинскому состоянию.
Список ожидающих пересадки
Запись на пересадку лёгких проводится без возрастных ограничений. Кандидаты на пересадку, состояние которых ухудшилось до такой степени, что требуется искусственная вентиляция легких и их оценка LAS превысила 70, имеют право на получение органа от донора как с той же самой, так и с совместимой группой крови.
Метод распределения
При получении донорских легких, они выделяются больному, находящемуся в самой тяжелой степени заболевания, и рост которого соответствует росту донора. Есть больные, нуждающиеся в пересадке одного легкого, и есть такие, кому требуется пересадка двух легких.
Распределение органов для комбинированной пересадки сердца – легких
Принципы
Существуют два метода распределения печени для пересадки – для взрослых и для детей.
Распределение печени для взрослых
Метод распределения печени для взрослых называется MELD (Model for End stage Liver Disease) и основан на математической формуле, разработанной в одном из важнейших трансплантологических центров США. Этот метод принят американской организацией распределения донорских органов UNOS, а также большинством западных стран, в том числе и Израилем.
Оценка MELD Score представляет собой логарифмическую формулу, подсчитывающую степень тяжести заболевания печени и шанс больного выжить без пересадки. Диапазон оценок – от 6 и выше. Чем больше степень тяжести заболевания, тем выше оценка. Запись взрослых пациентов на пересадку печени зависит от оценки MELD = 10 и выше на момент записи. Если после записи оценка снижается ниже 10, больной не удаляется из списка.
Распределение печени для детей
Дети до 18 лет записываются в специальный список для детей и ранжируются в соответствии со степенью тяжести заболевания по методике, раздельной для возраста до 12 лет и после 12 лет.
Дети в возрасте до 12 лет: степень тяжести заболевания вычисляется по формуле PELD Score (Pediatric End-Stage Liver Disease), основанной на тех же принципах, что и методика для взрослых пациентов, причем для детей учитываются дополнительные параметры: рост, вес, возраст и дата записи в общеизраильский список ожидающих пересадки. Это обусловлено процессом взросления. Диапазон оценок – от 6 до 40. Чем больше степень тяжести заболевания, тем выше оценка.
Дети в возрасте от 12 до 18 лет: включаются в список детей, ожидающих пересадки, но степень тяжести заболевания вычисляется по методике MELD, принятой для взрослых.
Список ожидающих пересадки
Имеются два списка ожидающих пересадки, один для взрослых и другой для детей (в возрасте до 18 лет). Записаться на пересадку можно в возрасте до 65 лет.
Оба списка основаны на оценке степени тяжести заболевания и совпадения группы крови. Существует разница в формулах для расчета степени тяжести заболевания для взрослых и для детей, вызванная специфическими параметрами заболеваний и возраста. Учитывается соответствие размеров тела между донором и реципиентом.
Для каждой группы существует отдельный список для срочных состояний – статус 1, в котором числятся больные с острым или быстро прогрессирующим заболеванием печени (согласно постоянным критериям), находящиеся в больнице в критическом состоянии с ожидаемой продолжительностью жизни без пересадки менее 7 дней.
Метод распределения
1. В первую очередь донорская печень выделяется срочному кандидату статуса 1 с совпадающей или совместимой группой крови.
2. Если нет больного статуса 1, печень выделяется больному с совпадающей группой крови относительно донора, и с наиболее высокой оценкой, т.е. с самой высокой степенью тяжести заболевания.
3. В особых случаях тяжелых больных с оценкой MELD выше 30 и с редкой группой крови, предоставляется возможность пересадки также от донора с совместимой группой крови (а не только совпадающей).
Выделение почек для пересадки
Принципы
При распределении почек отсутствует критерий срочности.
Распределение почек для пересадки осуществляется в соответствии с совпадением группы крови (О для О, В для В и т.д.) между донором и реципиентом.
Принципы распределения почек и поджелудочных желез (для больных диабетом типа 1)
1. Совпадение группы крови.
2. Отрицательный результат анализа на перекрестную иммунологическую реакцию между клетками крови кандидата на пересадку и клетками донора, а также время пребывания с списке ожидающих пересадки (существует отдельный список больных диабетом, ожидающих пересадки почки и поджелудочной железы).
Список ожидающих пересадки
Нет ограничения по возрасту при пересадке почки. Как правило, запись на пересадку почек от умершего донора возможна только после начала диализа. Когда больной записан на пересадку, время ожидания для него рассчитывается со дня начала процедуры диализа (а не со дня записи на пересадку).
Больной, подвергающийся диализу и записавшийся в список на пересадку в определенном возрасте, а потом перешедший в другую возрастную группу ввиду длительного ожидания, продолжает сохранять балл той возрастной группы, к которой он относился во время записи (чем моложе ожидающий пересадки, те более высокий балл он получает).
Метод распределения
При получении пожертвования почек, из тела донора изымаются железы и передаются в общеизраильскую лабораторию исследования тканей. В лаборатории имеются пробы крови всех кандидатов на пересадку почек и пересадку почки и поджелудочной железы (эти пробы посылаются туда раз в месяц). Из желез берутся клетки, которые проверяются в сравнении с пробами крови ожидающих пересадки с той же группой крови, что и у донора. Этот анализ называется "перекрестным". Только те кандидаты, перекрестный анализ которых с клетками донора дал отрицательный результат, могут получить почку или почку с поджелудочной железой от данного донора. Среди кандидатов с отрицательным результатом перекрестного анализа относительно донора очередность устанавливается в соответствии с четырьмя критериями: возраст, время ожидания (исчисляемое месяцами с начала диализа), генетическая близость (HLA) и уровень антител (PRA). Для каждого критерия установлено переменное число баллов от 0 до 4, кроме уровня антител (PRA), для которого баллы исчисляются от 0 до 6. В приведенных ниже таблицах детализирован метод присвоения баллов. У части ожидающих пересадки имеется высокий уровень антител. Это означает, что у них имеются антитела относительно многих людей, и их шанс найти совместимого донора низок. Чтобы компенсировать этот низкий шанс найти почку для пересадки, центр имплантаций устанавливает более высокий балл для людей с высоким уровнем антител. Для каждого кандидата с отрицательным результатом перекрестного анализа относительно донора подсчитывается общее количество баллов, и кандидат с самым высоким баллом получает орган для пересадки.
Особые ситуации:
1. Если донор является ребенком моложе 18 лет: прежде всего, проверяется совместимость с кандидатами моложе 18 лет.
2. Если донор старше 60 лет: пересадка выполняется больным старше 60 лет.
Таблицы критериев и баллов для распределения почек для пересадки:
1. Возраст
| 0-18 | 4 балла |
| 19-40 | 2 балла |
| 41-60 | 1 балл |
| Старше 60 | 0 баллов |
2. Уровень антител PRA
| 0-25% | 0 баллов |
| 26-50% | 2 балла |
| 51-75% | 4 балла |
| 76%+ | 6 балла |
3. Время ожидания (месяцев)
| До 24 | 0 баллов |
| 25-48 | 1 балл |
| 49-96 | 2 балла |
| 97 + новые | 4 балла |
4. Совместимость HLA - генетическая близость
Читайте также:
